Содержание
- 2. Кислотность и основность – это ключевые понятия, определяющие физико-химические свойства и специфическую биологическую ак-тивность органических соединений
- 3. Теория Бренстеда-Лоури (1923) Й.-Н. Бренстед Т. М. Лоури Кислота - это нейтральная молекула (или ион), способная
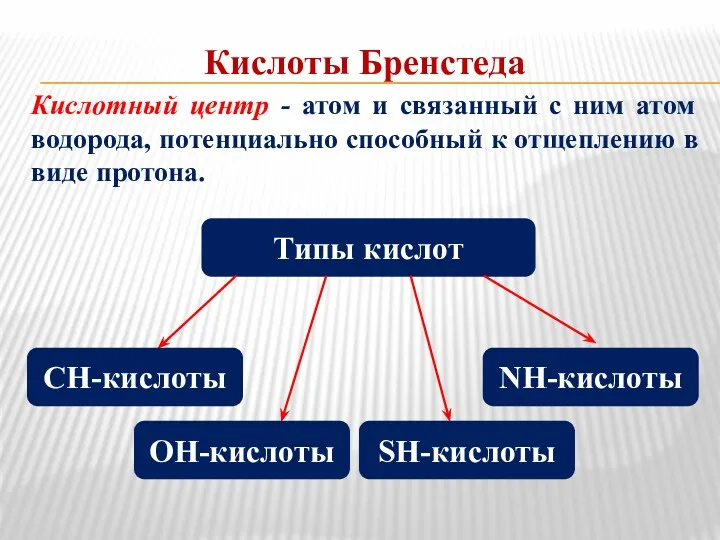
- 4. Кислоты Бренстеда Кислотный центр - атом и связанный с ним атом водорода, потенциально способный к отщеплению
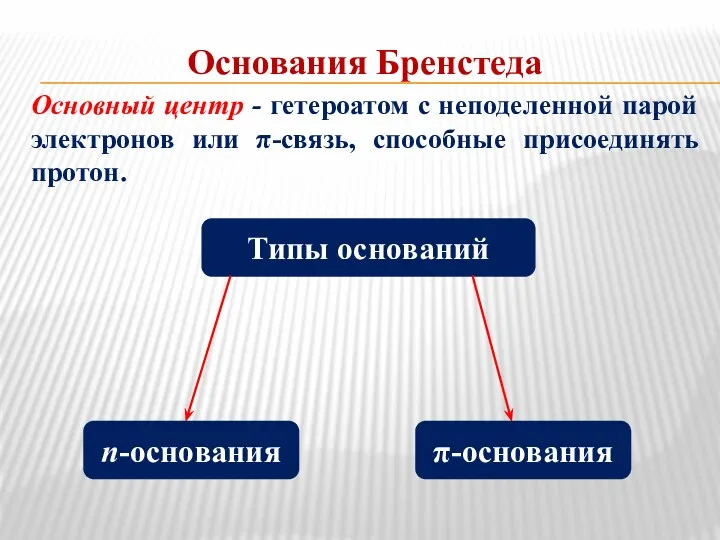
- 5. Основания Бренстеда Основный центр - гетероатом с неподеленной парой электронов или π-связь, способные присоединять протон. Типы
- 6. Факторы, влияющие на кислотность Сила кислоты определяется стабильностью сопряженного основания (аниона) – чем стабильнее анион, тем
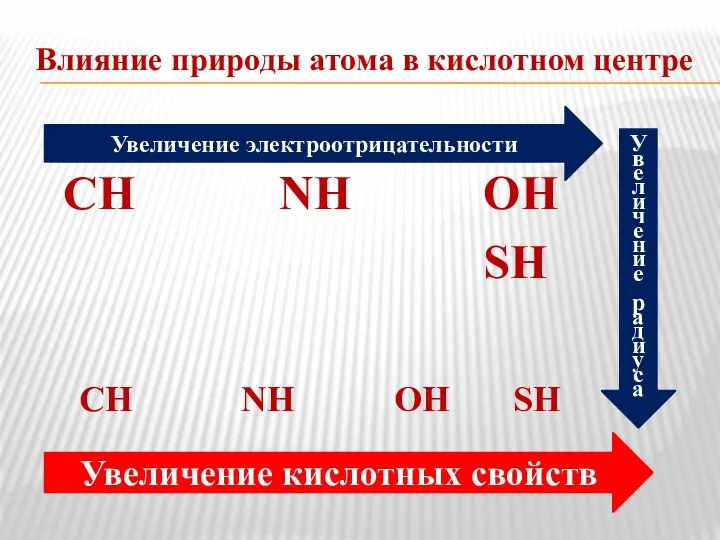
- 7. Влияние природы атома в кислотном центре СН NH ОН SH СН NH ОН SH Увеличение электроотрицательности
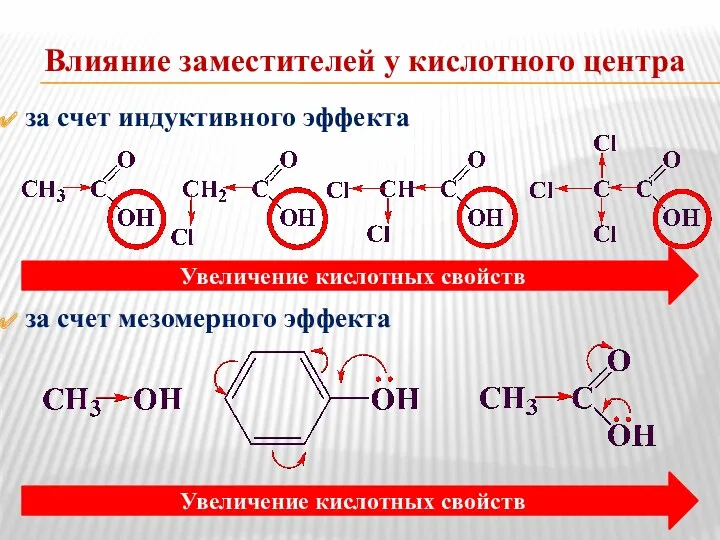
- 8. Влияние заместителей у кислотного центра за счет индуктивного эффекта за счет мезомерного эффекта Увеличение кислотных свойств
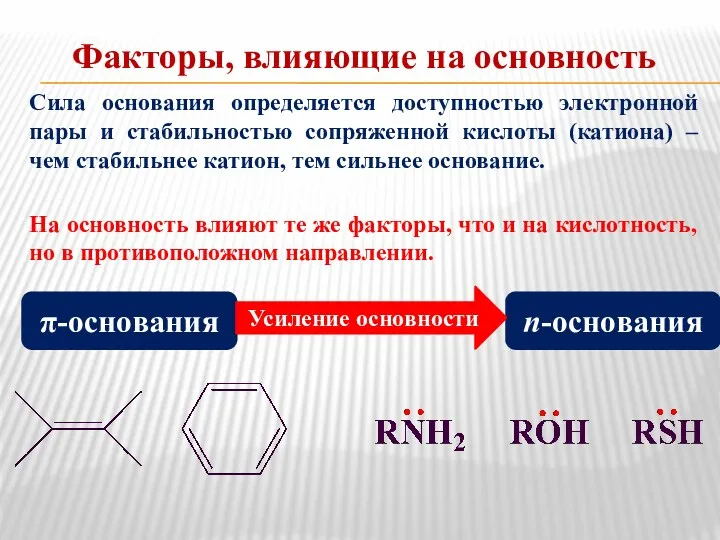
- 9. Факторы, влияющие на основность Сила основания определяется доступностью электронной пары и стабильностью сопряженной кислоты (катиона) –
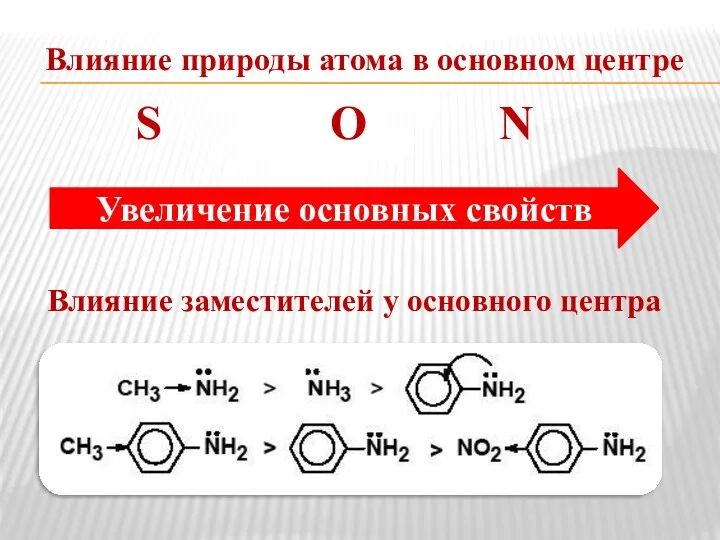
- 10. Влияние природы атома в основном центре S О N Влияние заместителей у основного центра Увеличение основных
- 11. Закономерности влияния заместителей на кислотность и основность Электронодонорные заместители ослабляют кислотность; усиливают основность. Электроноакцепторные заместители усиливают
- 12. Теория Льюиса Кислота - это нейтральная молекула (или ион), являющаяся акцептором электронной пары. Основание - это
- 13. Принцип ЖМКО Пирсона Жесткие кислоты - это кислоты Льюиса, имеющие акцепторные атомы небольших размеров, обладающие большим
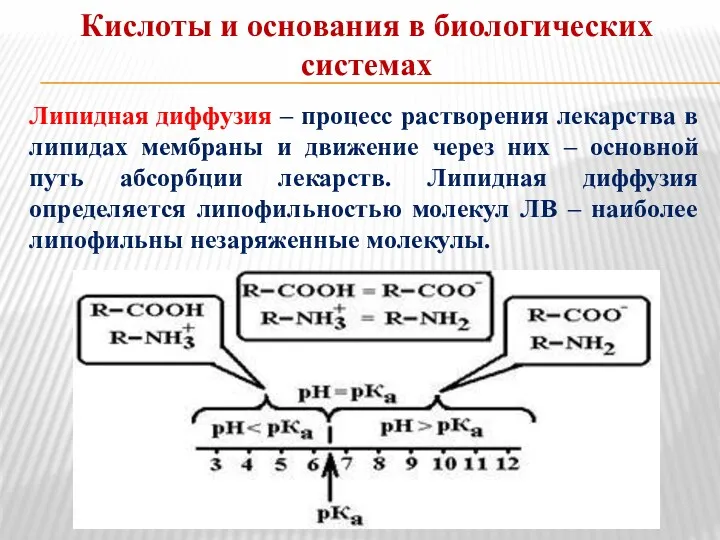
- 14. Кислоты и основания в биологических системах Липидная диффузия – процесс растворения лекарства в липидах мембраны и
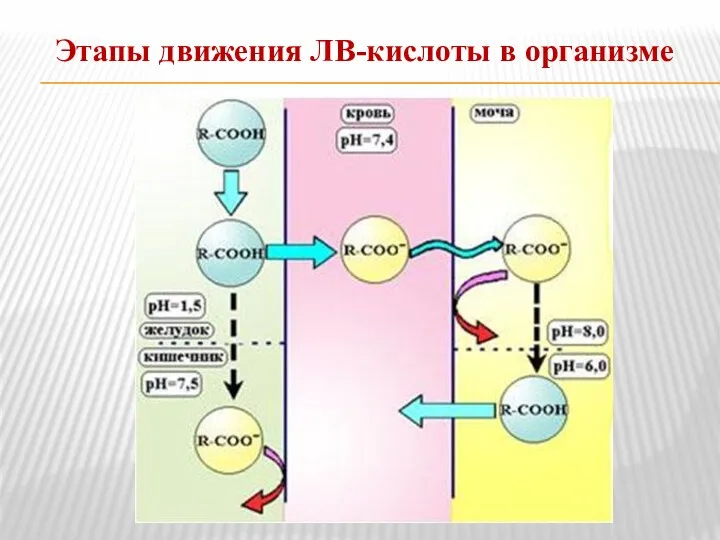
- 15. Этапы движения ЛВ-кислоты в организме
- 17. Скачать презентацию






 Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Трансформация энергии в процессе оксигенного фотосинтеза
Трансформация энергии в процессе оксигенного фотосинтеза Состав энергетических напитков
Состав энергетических напитков Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми
Найважливіші мікробіологічні процеси, збудники яких є мікроорганізми Геохимия гранитоидов, зоны гипергенеза, осадочного процесса
Геохимия гранитоидов, зоны гипергенеза, осадочного процесса Валентность и степень окисления
Валентность и степень окисления Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Свойства растворов высокомолекулярных соединений
Свойства растворов высокомолекулярных соединений Оксиды, их классификация и свойства (8 класс)
Оксиды, их классификация и свойства (8 класс) Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Аммиак. Строение, свойства, получение, применение
Аммиак. Строение, свойства, получение, применение Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Основные понятия. Химический язык
Основные понятия. Химический язык Щелочные металлы
Щелочные металлы Chimia coordinativă
Chimia coordinativă Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Монотерпеноиды. Химическое строение и общая характеристика. Тема № 2
Монотерпеноиды. Химическое строение и общая характеристика. Тема № 2 Химия нефти и газа
Химия нефти и газа Задачи на избыток-недостаток
Задачи на избыток-недостаток Чистые вещества и смеси
Чистые вещества и смеси Инертные газы
Инертные газы Классификация процессов и производств в химической технологии
Классификация процессов и производств в химической технологии Дисперсные системы (продолжение)
Дисперсные системы (продолжение) Органическая химия. Альдегиды и кетоны
Органическая химия. Альдегиды и кетоны