Содержание
- 2. Configuraţia electronică a elementelor d
- 3. Caracteristici ale ionilor metalelor 3d
- 4. Din istoria descoperirilor în chimia compușilor coordinativi
- 5. Sinteza compușilor complecși
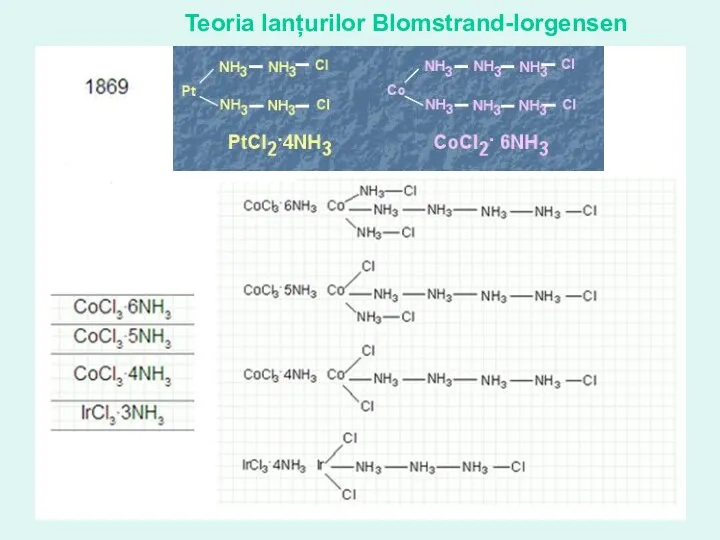
- 6. Unii din primii compuși coordinativi
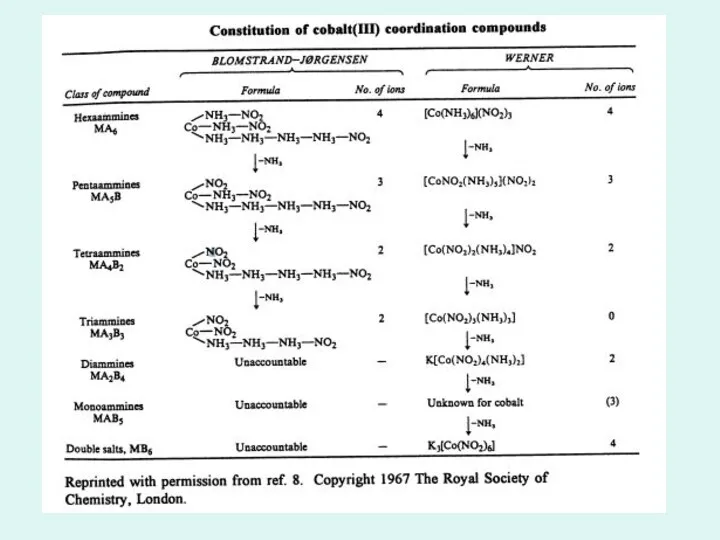
- 7. Studierea compușilor coordinativi prin metode chimice
- 8. Compoziția Culoarea Seria Numărul de ioni Cl precipitați Oranj Purpurie Verde Violetă Albastru -verde Studierea compușilor
- 9. ????? Cum pot interacționa două substanțe cu valențele saturate? De ce din substanțe inițiale identice se
- 10. Dezvoltarea chimiei compușilor coordinativi pînă la Werner
- 11. Teoria lanțurilor Blomstrand-Iorgensen
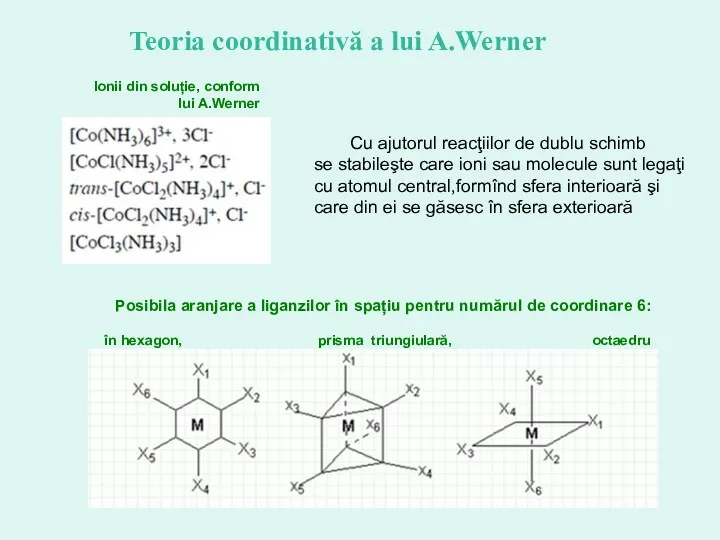
- 13. Teoria coordinativă a lui A.Werner
- 14. Ionii din soluție, conform lui A.Werner Teoria coordinativă a lui A.Werner Posibila aranjare a liganzilor în
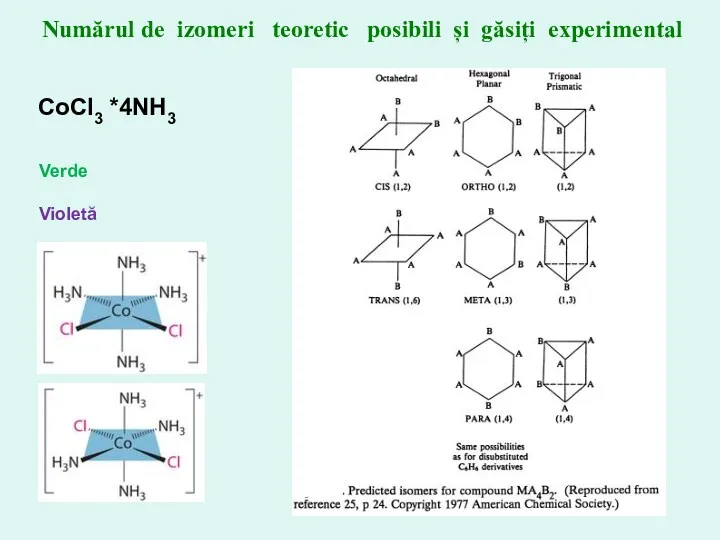
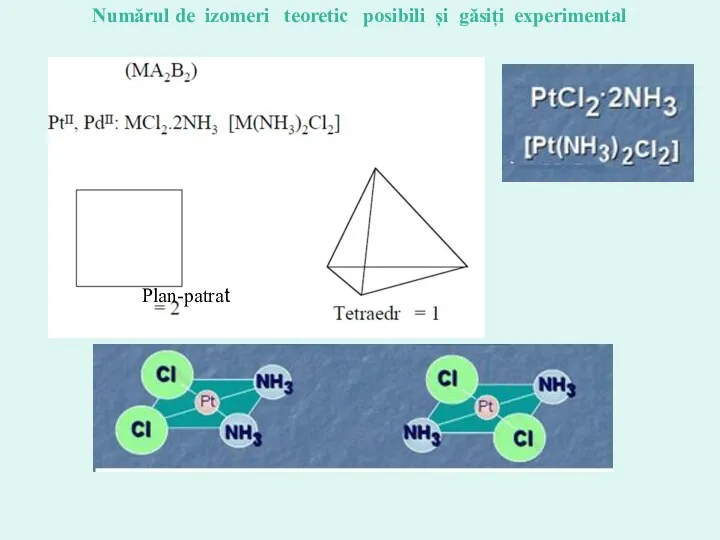
- 15. Numărul de izomeri teoretic posibili și găsiți experimental CoCl3 *4NH3 Verde Violetă
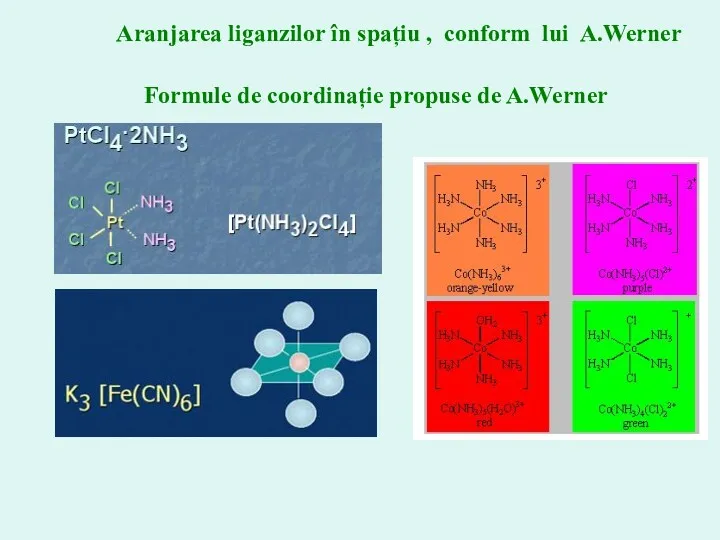
- 16. Aranjarea liganzilor în spațiu , conform lui A.Werner Formule de coordinație propuse de A.Werner
- 17. Plan-patrat Numărul de izomeri teoretic posibili și găsiți experimental
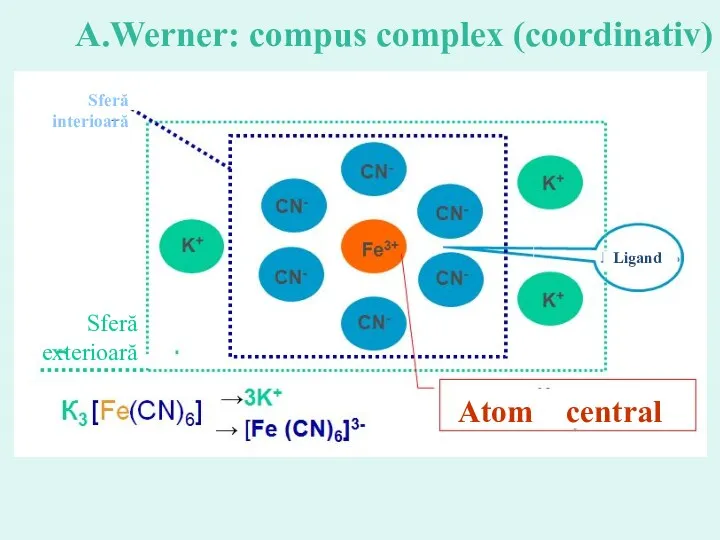
- 18. Atom central Ligand Sferă interioară Sferă exterioară A.Werner: compus complex (coordinativ)
- 19. Teoria coordinativă a şui A.Werner 1893 - A.Werner propune teoria coordinativă cu următoarele postulate: 1. Majoritatea
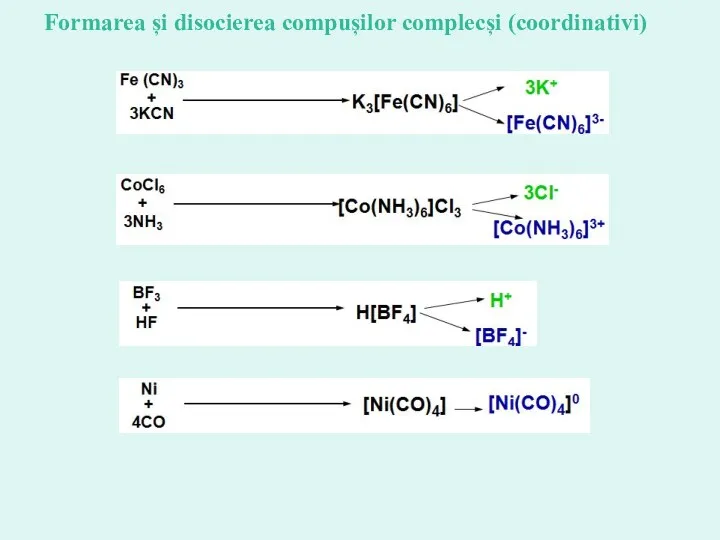
- 20. Formarea și disocierea compușilor complecși (coordinativi)
- 21. Ionii, care nu intră in sfera interioară de coordinaţie, la dizolvare în apă disociază şi determină
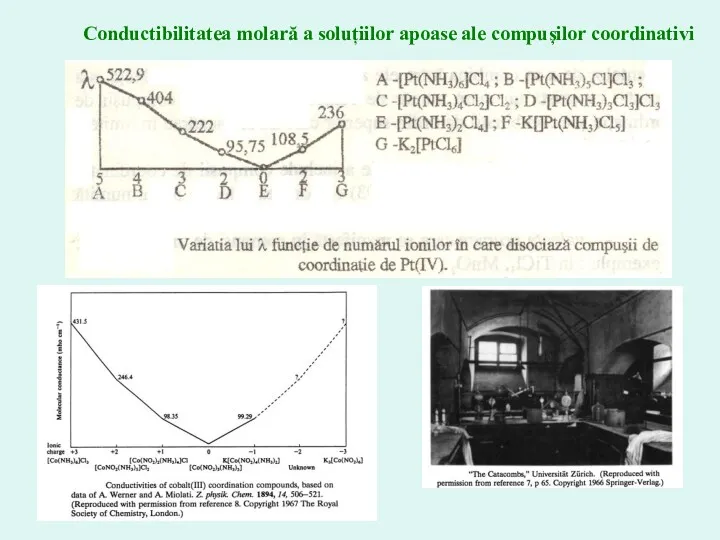
- 22. Studierea compuşilor coordinativi prin metode fizice Compoziţia sferei interioare se poate stabili şi prin măsurarea conductibilităţii
- 23. Conductibilitatea molară a soluțiilor apoase ale compușilor coordinativi
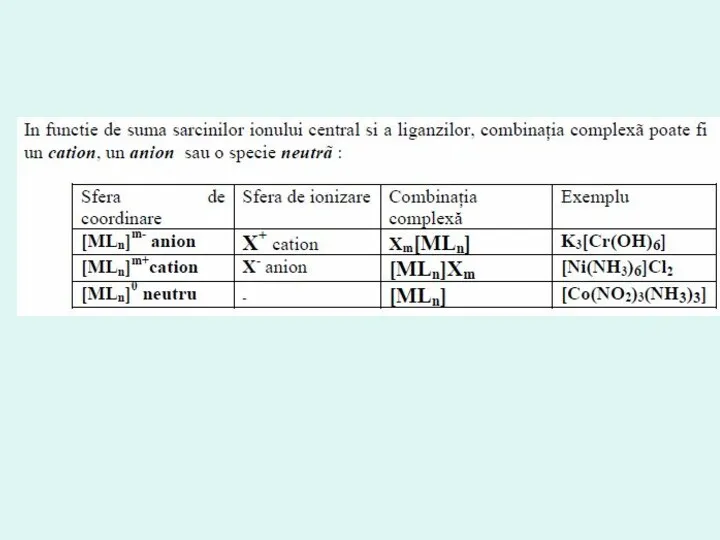
- 24. Compuşi coordinativi şi săruri duble A.Werner: Compuşi coordinativi – substanţe de ordinul superior, stabile în soluţii
- 25. [Co(NH3)6]3+ - complex [Co(NH3)6]Cl3 – compus complex (coordinativ) [Fe(CO)5] – complex şi compus complex (coordinativ) Complex
- 26. Combinaţiile complexe (coordinative) sunt compuşi de ordin superior cu dimensiuni moleculare. 1. Ele se formează prin
- 28. Generatorul de coomplex, împreună cu liganzii formează aşa numita sferă interioară a complexului. La scrierea formulelor
- 29. Atomul central Metal Nemetal
- 31. Într-un compus coordinativ se scrie în primul rînd atomul metalic central, urmat de liganzii cationici în
- 32. [Cu(H2O)4](SO4)·H2O Atom central Liganzi Sfera interioară Sfera exterioară
- 33. Liganzi Sfera exterioară Sfera interioară Număr de coordinaţie Generator de complex K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-
- 34. Generator de complex Liganzi Sfera exterioară Sfera interioară Număr de coordinaţie H[AuCl4] → H+ + [AuCl4]-
- 35. Atom central Liganzi Număr de coordinaţie Sfera interioară Sfera exterioară [Ag(NH3)2]OH → [Ag(NH3)2]+ + OH-
- 36. Proprietăţile chimice 1.Disocierea [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42- 2. Reacţii cu participarea sferei exterioare FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl [Cu(NH3)4]SO4+BaCl2→[Cu(NH3)4]Cl2+BaSO4↓
- 37. 3. Reacţii cu participarea liganzilor [Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4 4. Reacţii cu participarea generatorului de complex de schimb: [Ag(NH3)2]Cl
- 38. Realizări ale chimiei compușilor coordinativi
- 43. C.Turtă A.Gulea M.Revenco Academicieni ai AŞM – specialişti în chimia coordinativă
- 45. Aplicații moderne ale chimiei compușilor coordinativi
- 48. Скачать презентацию














![[Co(NH3)6]3+ - complex [Co(NH3)6]Cl3 – compus complex (coordinativ) [Fe(CO)5] –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/167015/slide-24.jpg)





·H2O Atom central Liganzi Sfera interioară Sfera exterioară](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/167015/slide-31.jpg)
![Liganzi Sfera exterioară Sfera interioară Număr de coordinaţie Generator de complex K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/167015/slide-32.jpg)
![Generator de complex Liganzi Sfera exterioară Sfera interioară Număr de coordinaţie H[AuCl4] → H+ + [AuCl4]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/167015/slide-33.jpg)
![Atom central Liganzi Număr de coordinaţie Sfera interioară Sfera exterioară [Ag(NH3)2]OH → [Ag(NH3)2]+ + OH-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/167015/slide-34.jpg)
![Proprietăţile chimice 1.Disocierea [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42- 2. Reacţii cu participarea sferei exterioare FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl [Cu(NH3)4]SO4+BaCl2→[Cu(NH3)4]Cl2+BaSO4↓](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/167015/slide-35.jpg)
![3. Reacţii cu participarea liganzilor [Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4 4. Reacţii cu participarea](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/167015/slide-36.jpg)







 Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Химическая коррозия. Методы защиты от химической коррозии
Химическая коррозия. Методы защиты от химической коррозии Biomass Feedstocks
Biomass Feedstocks Углерод. Элемент IV группы
Углерод. Элемент IV группы Экспедиция Изучай мир. Содержание углекислого газа в воздухе
Экспедиция Изучай мир. Содержание углекислого газа в воздухе Типы химических реакций в органической химии
Типы химических реакций в органической химии Приборы радиационной и химической разведки
Приборы радиационной и химической разведки Конструкционные и функциональные волокнистые композиты
Конструкционные и функциональные волокнистые композиты Металлы и сплавы
Металлы и сплавы Периодический закон Д.И. Менделеева. Строение атома. Химическая связь
Периодический закон Д.И. Менделеева. Строение атома. Химическая связь Адсорбция на твердых телах
Адсорбция на твердых телах Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Практическая работа по разделению смесей
Практическая работа по разделению смесей Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Газовые смеси
Газовые смеси Кристаллические решетки
Кристаллические решетки Электрохимические методы анализа
Электрохимические методы анализа Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Азот
Азот Массообменные процессы
Массообменные процессы Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Спирт. Спирты в природе. Влияние спирта на человека
Спирт. Спирты в природе. Влияние спирта на человека Степень окисления в органической химии
Степень окисления в органической химии Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Решение задачи №10. Гидроксид рубидия. Команда Карбораны
Решение задачи №10. Гидроксид рубидия. Команда Карбораны Вредные вещества
Вредные вещества Номенклатура органических веществ
Номенклатура органических веществ Роль хімії у розв`язанні екологічної проблеми
Роль хімії у розв`язанні екологічної проблеми