Содержание
- 2. Реакции замещения Это такие реакции, в результате которых осуществляется замена одного атома или группы атомов в
- 3. Реакции присоединения- это реакции, в результате которых две или более молекул присоединяются в одну. Гидрирование (присоединение
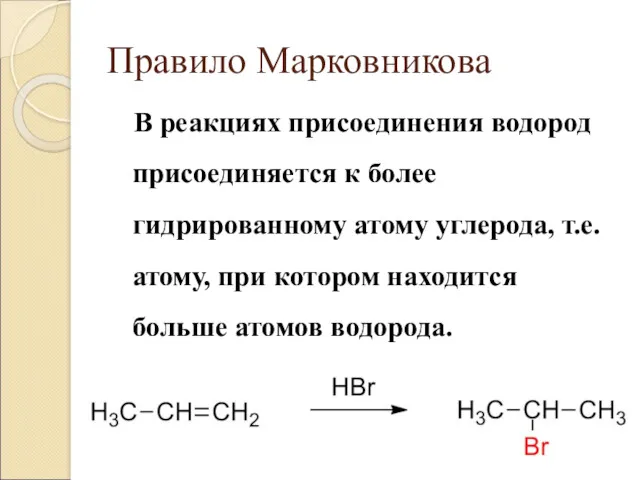
- 4. Правило Марковникова В реакциях присоединения водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором
- 5. Реакция отщепления (элиминирования) Дегидрирование (отщепление водорода) Дегидратация (отщепление воды) Дегидрохлорирование (отщепление хлороводорода) Крекинг (расщепление алканов с
- 6. Правило Зайцева При отщеплении воды от молекулы спирта атом водорода отрывается от наименее гидратированного атома углерода.
- 7. Ароматизация Это реакция отщепления молекулы водорода и циклизация алкана с шестью и более атомами углерода в
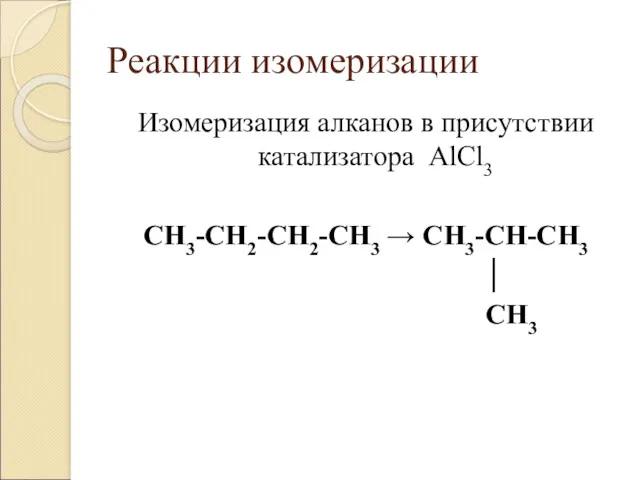
- 8. Реакции изомеризации Изомеризация алканов в присутствии катализатора AlCl3 CH3-CH2-CH2-CH3 → CH3-CH-CH3 │ CH3
- 9. Реакции окисления 1. Полное – горение. Продукты СО2 и Н2О: СН4 + 2О2 = СО2 +
- 10. Реакция «серебряного зеркала» Это окисление альдегидов до карбоновых кислот аммиачным раствором оксида серебра. R-COH + 2[Ag(NH3)2]OH
- 11. Реакции восстановления (гидрирования) алкен + Н2 = алкан алкин + Н2 = алкен бензол + Н2
- 12. Пиролиз Это реакции разложения без доступа кислорода CH4 → C+H2 (t=10000C) 2CH4 → C2H2+ 3H2 (t=15000C)
- 13. Риформинг Это промышленный процесс переработки нефти с целью получения высокооктановых бензинов и ароматических углеводородов. Риформинг включает
- 14. Именные реакции в органической химии Реакция Вюрца Реакция Коновалова Реакция Кучерова Реакция Зелинского Метод Лебедева Реакция
- 15. Реакция Вюрца Это удвоение цепочки углеводорода под действием металлического натрия на галогенопроизводные 2RBr +2Na →R—R +
- 16. Реакция Коновалова Это реакция алканов, циклоалканов, ароматических углеводородов с 10% -ным раствором азотной кислоты. CH4 +
- 17. Реакция Кучерова Это реакция гидратации алкинов в присутствии солей двухвалетной ртути HC≡CH + H2O →CH3-CHO C6H5-C≡CH
- 18. Реакция Зелинского Тримеризация ацетилена. Реакция происходит при пропускании ацетилена над активированным углем при температуре 400 °C.
- 19. Метод Лебедева Производство бутадиена -1,3 из этилового спирта: 2CH3-CH2-OH→CH2=CH-CH=CH2+2H2O+ H2 (t= 4250C, катализаторы Al2O3 , ZnO)
- 21. Скачать презентацию
















 Основные интермедиаты в органических реакциях. Часть 1
Основные интермедиаты в органических реакциях. Часть 1 Цветные металлы
Цветные металлы Көмірсулар. Моносахаридтер. Жіктелуі. Гексозалар. Құрылысы
Көмірсулар. Моносахаридтер. Жіктелуі. Гексозалар. Құрылысы Л3. Учение о растворах (Химия)
Л3. Учение о растворах (Химия) Олигомеризация олефинов
Олигомеризация олефинов D-элементы VII-В группы. Марганец
D-элементы VII-В группы. Марганец Алкадиены (диены)
Алкадиены (диены) Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Серная кислота и её свойства
Серная кислота и её свойства Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Занимательные опыты в качественном анализе
Занимательные опыты в качественном анализе Способи очищення води
Способи очищення води Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Сахароза
Сахароза Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Химические реакции в растворах электролитов. Обобщение и систематизация знаний
Химические реакции в растворах электролитов. Обобщение и систематизация знаний Органические и неорганические кислоты
Органические и неорганические кислоты БАЗ синтездеудің химиялық технологиясы Синтетикалық түсінік
БАЗ синтездеудің химиялық технологиясы Синтетикалық түсінік Фосфор и его соединения. Электронные формулы атома фосфора
Фосфор и его соединения. Электронные формулы атома фосфора Механизм и закономерности кристаллизации металлов
Механизм и закономерности кристаллизации металлов Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Активационный анализ
Активационный анализ Тема 7-Карбоновые кислоты
Тема 7-Карбоновые кислоты Переработка нефти. (10 класс)
Переработка нефти. (10 класс) Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения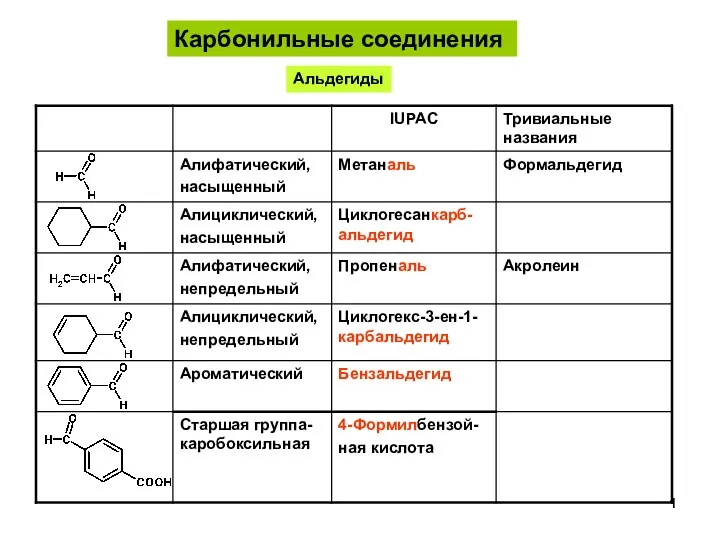 АльдегидыКетоны-1
АльдегидыКетоны-1 Алканы: общая формула, состав, гомологический ряд
Алканы: общая формула, состав, гомологический ряд