Слайд 2

Многие органические реакции проходят через образование промежуточных малостабильных частиц – карбокатионов,
карбоанионов, радикалов…
Стабилизация частиц достигается в первую очередь за счет резонансных структур, а не индуктивных эффектов
Слайд 3

Карбокатионы
Карбокатионы – неустойчивые частицы, в которых атом углерода имеет три заместителя
и несет положительный заряд
Как правило плоские -> ахиральны
Слайд 4

Устойчивость
Наличие донорных групп стабилизирует карбокатион. Например, устойчивость возрастает в ряду CH3+>CH3CH2+>CH(CH3)2+>C(CH3)3+
Наличие
в α-положении двойной связи стабилизирует карбокатион (PhCH2+ и CH2=CHCH2+ стабильнее CH3+)
Слайд 5
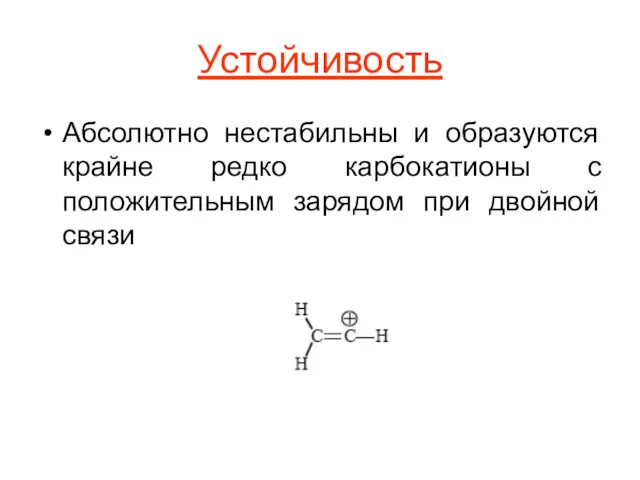
Устойчивость
Абсолютно нестабильны и образуются крайне редко карбокатионы с положительным зарядом при
двойной связи
Слайд 6
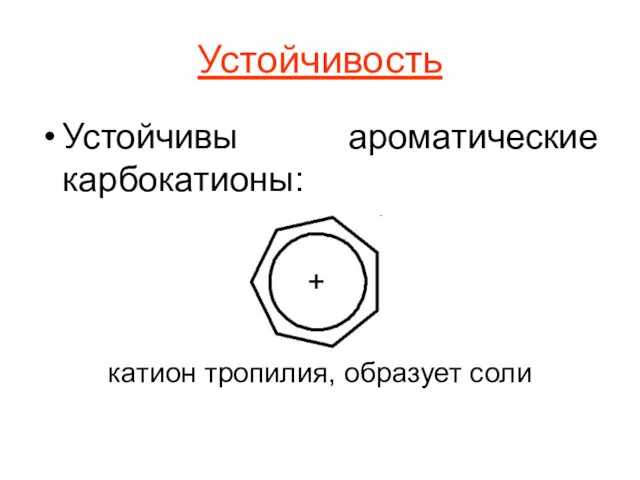
Устойчивость
Устойчивы ароматические карбокатионы:
катион тропилия, образует соли
Слайд 7
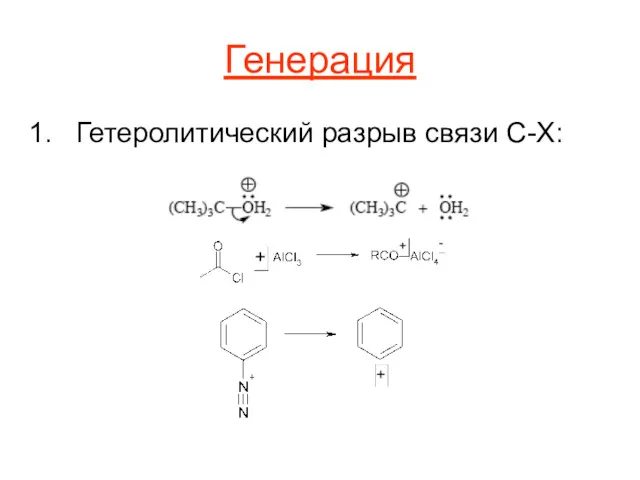
Генерация
Гетеролитический разрыв связи C-X:
Слайд 8
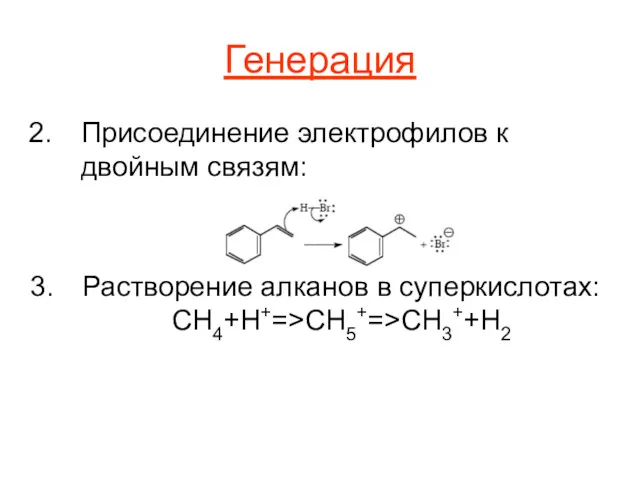
Генерация
Присоединение электрофилов к двойным связям:
Растворение алканов в суперкислотах: CH4+H+=>CH5+=>CH3++H2
Слайд 9
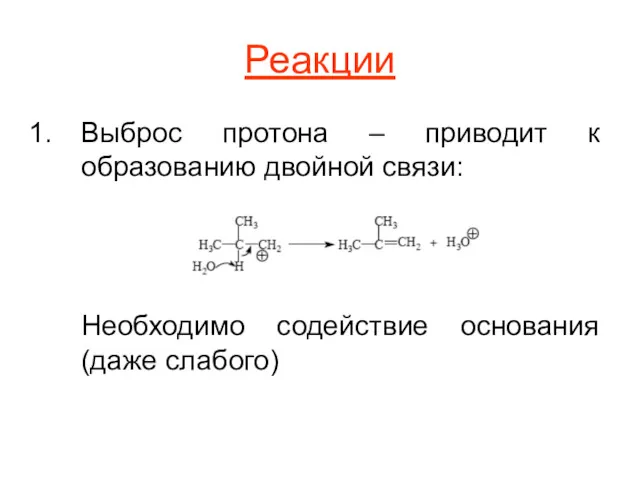
Реакции
Выброс протона – приводит к образованию двойной связи:
Необходимо содействие основания (даже
слабого)
Слайд 10
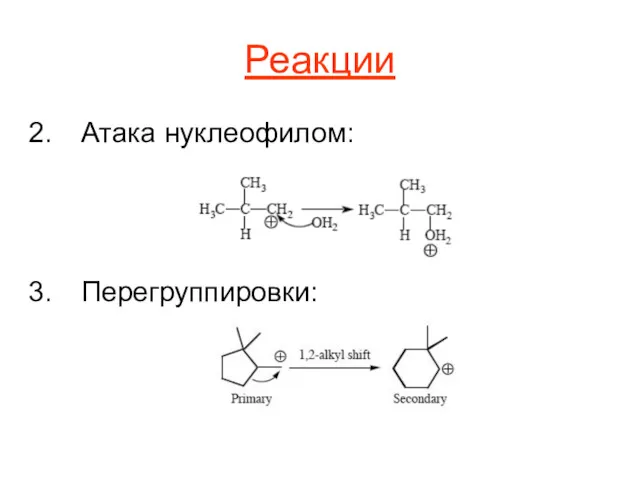
Реакции
Атака нуклеофилом:
Перегруппировки:
Слайд 11
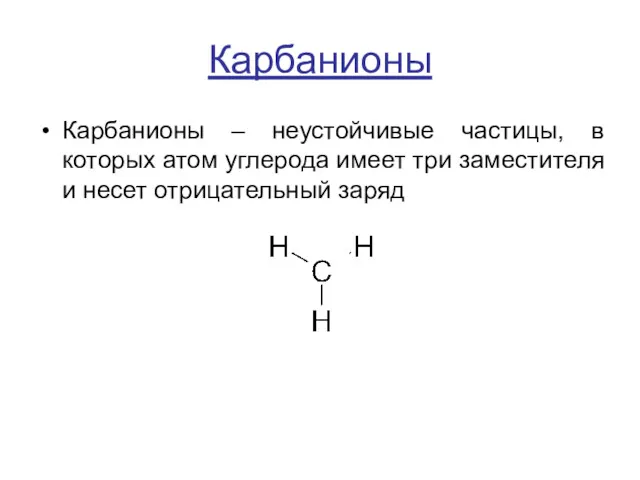
Карбанионы
Карбанионы – неустойчивые частицы, в которых атом углерода имеет три заместителя
и несет отрицательный заряд
Слайд 12

Устойчивость
Наличие акцепторных групп стабилизирует карбанион: pKa для кетонов ~25, а для
алканов ~50
Относительно более стабильны анионы аллильного и бензильного типа
Стабильны ароматические карбанионы:
Слайд 13
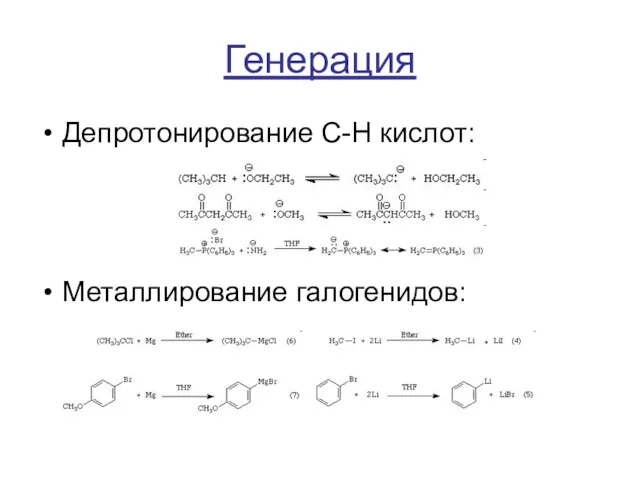
Генерация
Депротонирование C-H кислот:
Металлирование галогенидов:
Слайд 14
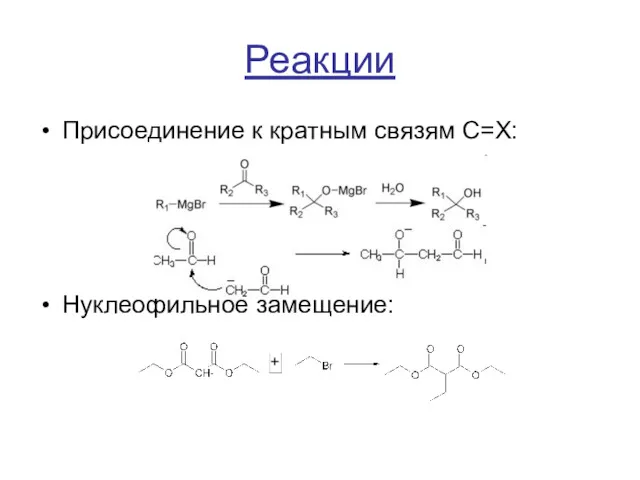
Реакции
Присоединение к кратным связям C=X:
Нуклеофильное замещение:
Слайд 15
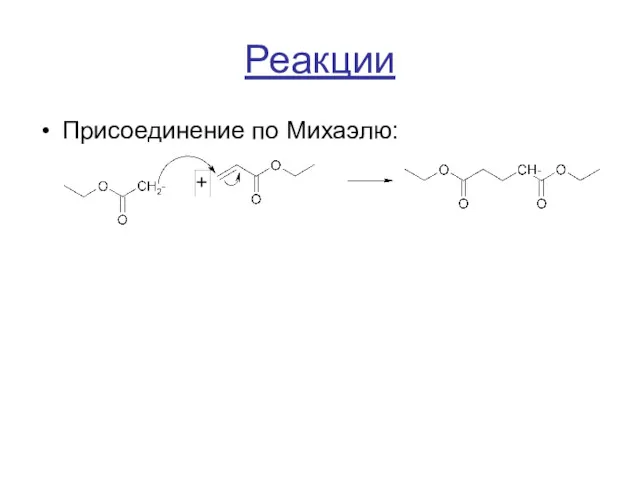
Реакции
Присоединение по Михаэлю:
Слайд 16

Радикалы
В общем случае – частицы с неспаренными электронами
В общем случае не
обязательно плоские
Слайд 17
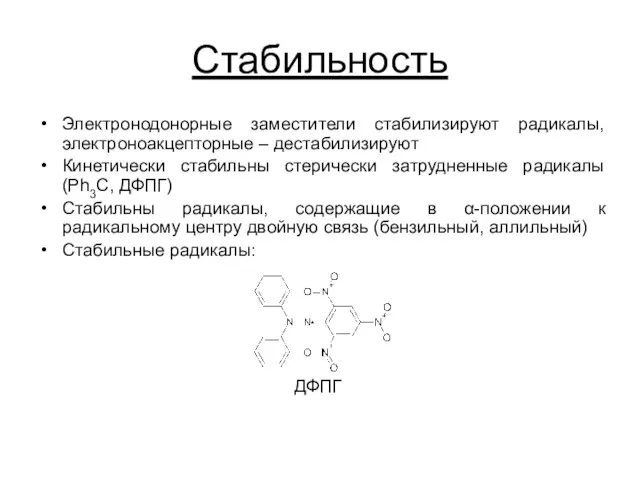
Стабильность
Электронодонорные заместители стабилизируют радикалы, электроноакцепторные – дестабилизируют
Кинетически стабильны стерически затрудненные радикалы
(Ph3C, ДФПГ)
Стабильны радикалы, содержащие в α-положении к радикальному центру двойную связь (бензильный, аллильный)
Стабильные радикалы:
ДФПГ
Слайд 18

Генерация
Термический распад некоторых соединений (пероксидов, азосоединений):
Реакции «обычных» молекул с радикалами:
Слайд 19
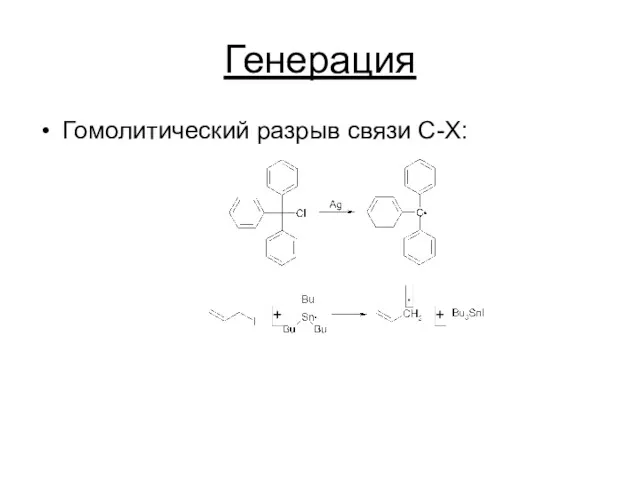
Генерация
Гомолитический разрыв связи C-X:
Слайд 20
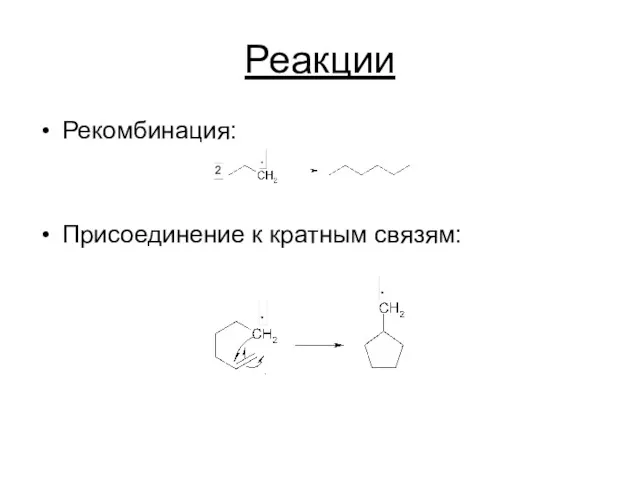
Реакции
Рекомбинация:
Присоединение к кратным связям:
Слайд 21
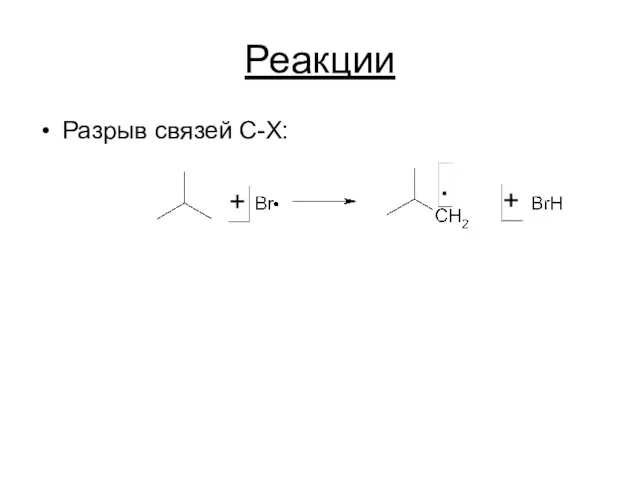
Реакции
Разрыв связей C-X:
Слайд 22
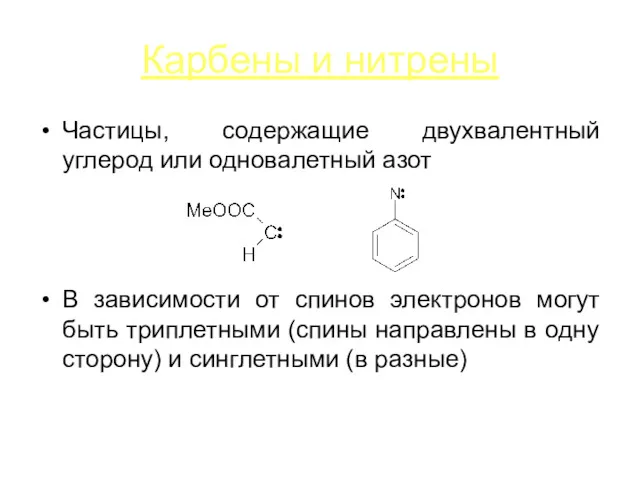
Карбены и нитрены
Частицы, содержащие двухвалентный углерод или одновалетный азот
В зависимости от
спинов электронов могут быть триплетными (спины направлены в одну сторону) и синглетными (в разные)
Слайд 23

Устойчивость
Все карбены крайне неустойчивы
Возможна стабилизация за счет резонанса (опять же арильные
и винильные заместители)
Слайд 24
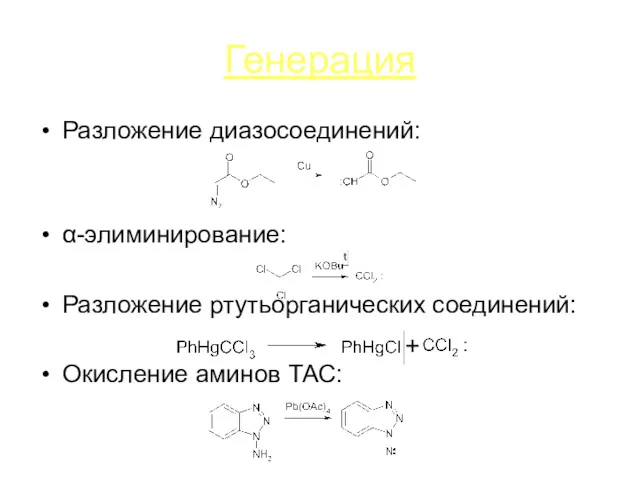
Генерация
Разложение диазосоединений:
α-элиминирование:
Разложение ртутьорганических соединений:
Окисление аминов ТАС:
Слайд 25

Реакции
Встраивание в связь C-X:
Циклоприсоединение к кратным связям:
Слайд 26

Помимо описанных выше частиц существует много других (ион-радикалы, арины, металлоорганические соединения).
Они встречаются реже и будут рассмотрены в соответствующих реакциях
Слайд 27

Часть 2
Основные механизмы органических реакций
Слайд 28

Нуклеофильное замещение
R-X+Nu:->R-Nu+X:
Нуклеофил – частица (ион, молекула), имеющая электронную пару
Нуклеофильное замещение может
проходить по механизмам SN1, SN2, SNAr, SNi
Слайд 29
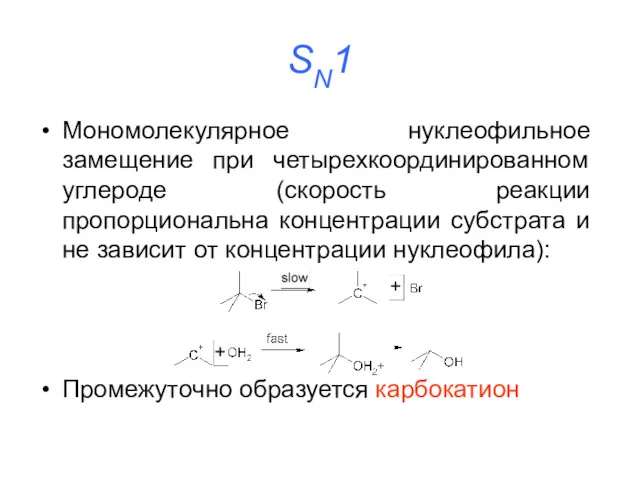
SN1
Мономолекулярное нуклеофильное замещение при четырехкоординированном углероде (скорость реакции пропорциональна концентрации субстрата
и не зависит от концентрации нуклеофила):
Промежуточно образуется карбокатион
Слайд 30
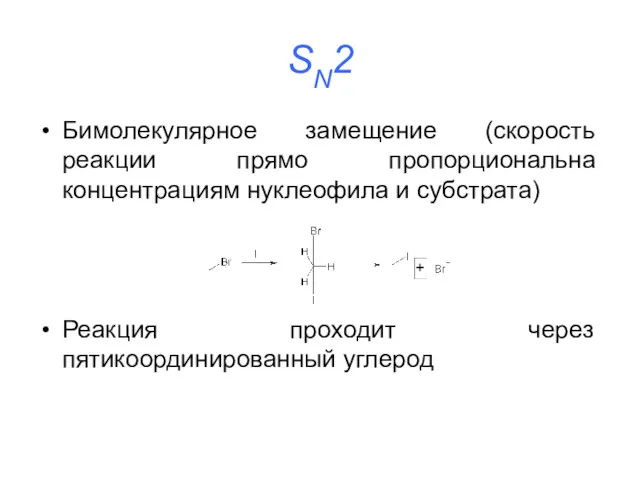
SN2
Бимолекулярное замещение (скорость реакции прямо пропорциональна концентрациям нуклеофила и субстрата)
Реакция проходит
через пятикоординированный углерод
Слайд 31

Сравнение SN1 и SN2
SN2 приводит к полному обращению конфигурации, SN1 –
к полной (частичной) рацемизации
SN2 не проходит для субстратов, содержащих объемные группы при атакуемом атоме углерода (например (CH3)3CCI)
Оптимальный растворитель для SN1 – достаточно кислый протонный (CH3COOH), а для SN2 – биполярный апротонный (ДМФА, ацетон)
Слайд 32

SNAr
Нуклеофильное замещение в ароматических соединениях
Может проходить через комплекс Мейзенхеймера, арины, по
радикальному механизму и механизму ANRORC
Слайд 33

SNAr через комплекс Мейзенхеймера
Характерно для активированных субстратов (содержащих электроноакцепторные группы)
Для неактивированных
субстратов проходит с очень большим трудом (реакция хлорбензола с NaOH проходит при 350oС и под давлением)
Слайд 34
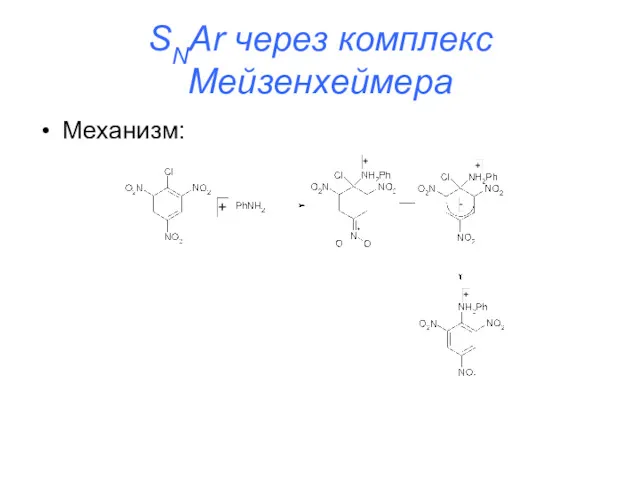
SNAr через комплекс Мейзенхеймера
Механизм:
Слайд 35

SNAr через образование аринов
Протекает под действием сильных оснований
Приводит к образованию смеси
продуктов
Слайд 36
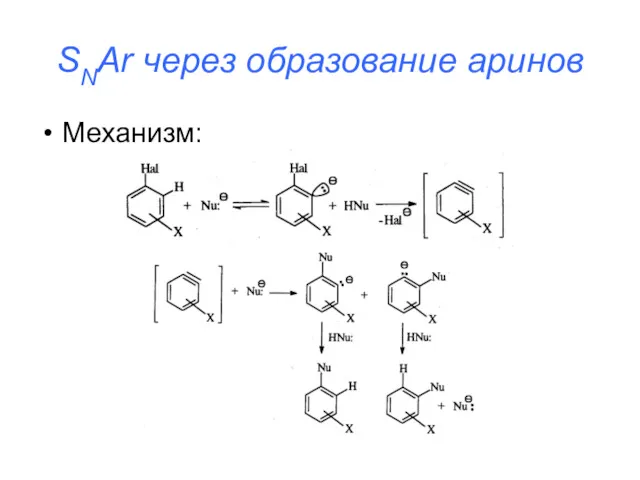
SNAr через образование аринов
Механизм:
Слайд 37

ANRORC
Addition of Nucleofile, Ring Opening, Ring Cloisure (присоединение нуклеофила, раскрытие цикла,
закрытие цикла)
Слайд 38
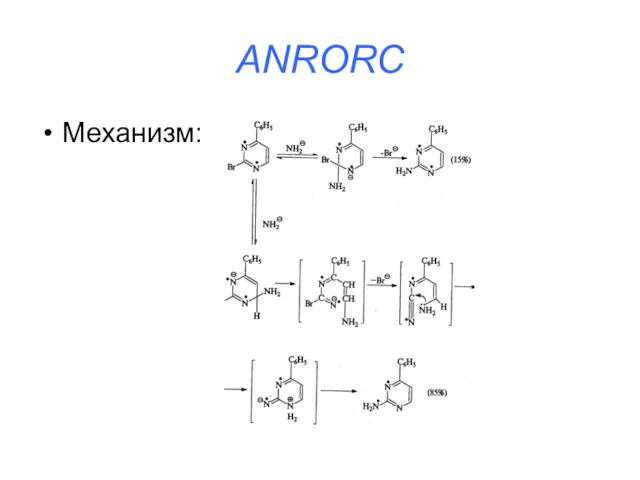
Слайд 39

SNi
Известно, что в реакции между тионилхлоридом и оптически активным спиртом инверсии
конфигурации не происходит:
Поэтому предложили механизм «SNi», в котором Cl- атакует с фронта:
Слайд 40
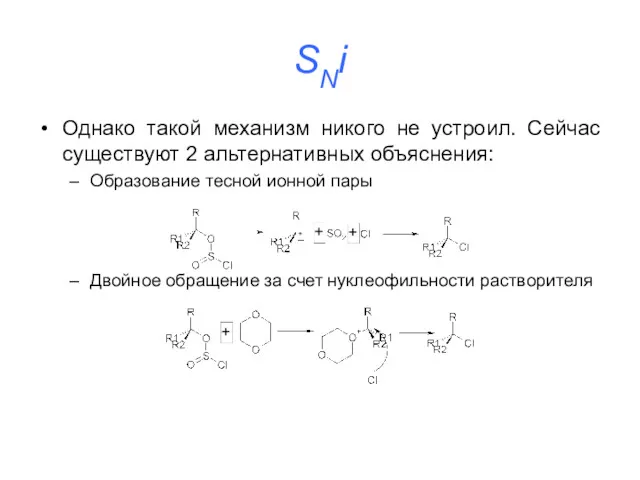
SNi
Однако такой механизм никого не устроил. Сейчас существуют 2 альтернативных объяснения:
Образование
тесной ионной пары
Двойное обращение за счет нуклеофильности растворителя
Слайд 41

Нуклеофильное присоединение
Присоединение нуклеофильных реагентов к кратной связи (в основном к связям
C=X, где X=O,N)
Реакция обратима!
Слайд 42

Электрофильное замещение
Характерно для ароматических субстратов (SEAr)
Механизм:
Правила ориентации (школьная программа)
Слайд 43
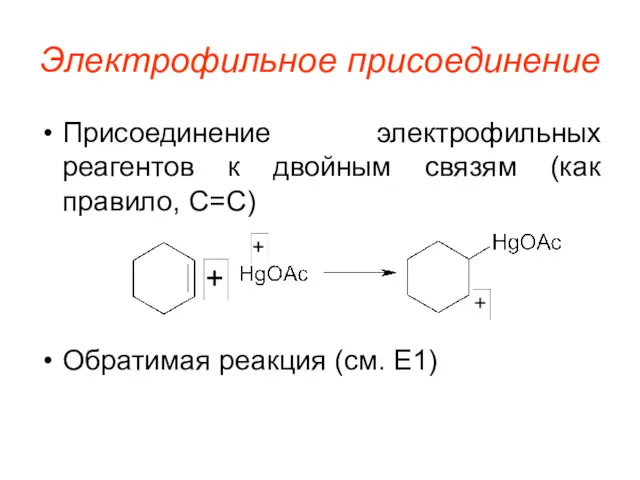
Электрофильное присоединение
Присоединение электрофильных реагентов к двойным связям (как правило, C=C)
Обратимая реакция
(см. E1)
Слайд 44
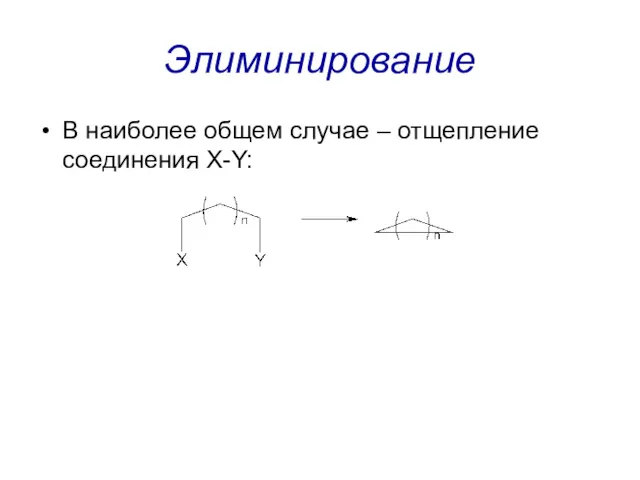
Элиминирование
В наиболее общем случае – отщепление соединения X-Y:
Слайд 45
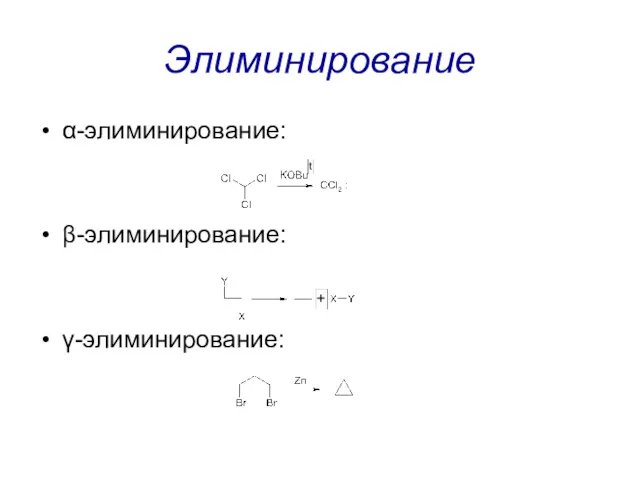
Элиминирование
α-элиминирование:
β-элиминирование:
γ-элиминирование:
Слайд 46
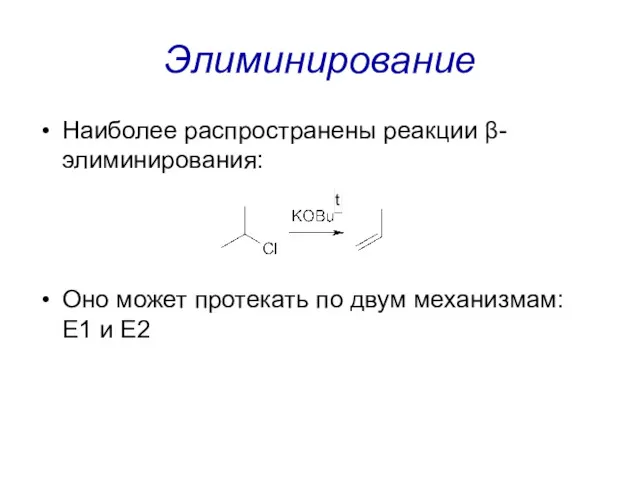
Элиминирование
Наиболее распространены реакции β-элиминирования:
Оно может протекать по двум механизмам: E1 и
E2
Слайд 47

Элиминирование
E1: мономолекулярное элиминирование; проходит через образование карбокатиона в достаточно кислых средах
E2:
бимолекулярное элиминирование; требует антиперипланарного расположения H и X
Слайд 48

Элиминирование
При β-элиминировании как правило образуется наиболее замещенный и транс-алкен (правило Зайцева)
Исключение
из правила Зайцева – разложение гидроксидов четвертичных аминов (реакция Гофмана):
Как правило, элиминирование конкурирует с нуклеофильным замещением; при этом элиминированию способствует нагревание и использование сильных оснований
Слайд 49
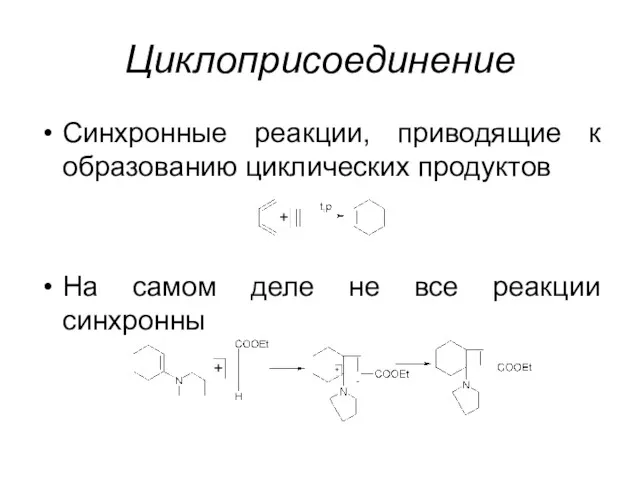
Циклоприсоединение
Синхронные реакции, приводящие к образованию циклических продуктов
На самом деле не все
реакции синхронны
Слайд 50
![[1,n]-сдвиги Сдвиги заместителей (характерны для карбокатионов и карбанинов) [1,2]-гидридный сдвиг: [1,2]-алкильный сдвиг:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-49.jpg)
[1,n]-сдвиги
Сдвиги заместителей (характерны для карбокатионов и карбанинов)
[1,2]-гидридный сдвиг:
[1,2]-алкильный сдвиг:
Слайд 51

Часть 3
Именные и безымянные органические реакции
Слайд 52

Конденсации
Реакции образования C-C связей, протекающие с отщеплением небольших молекул
В большинстве реакций
участвуют карбонильные соединения
Мощный метод построения углеродного скелета
Слайд 53
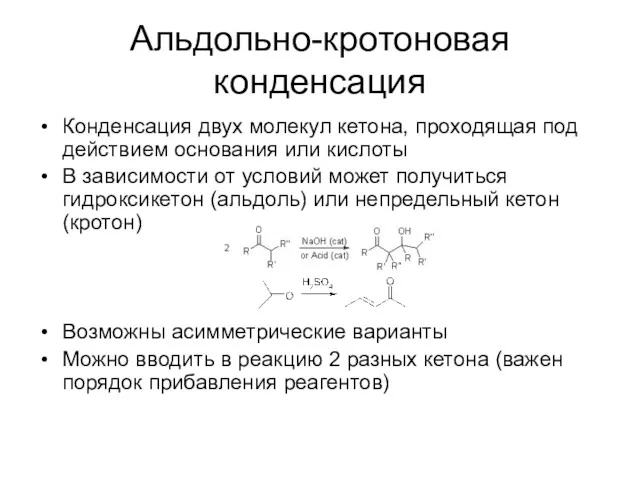
Альдольно-кротоновая конденсация
Конденсация двух молекул кетона, проходящая под действием основания или кислоты
В
зависимости от условий может получиться гидроксикетон (альдоль) или непредельный кетон (кротон)
Возможны асимметрические варианты
Можно вводить в реакцию 2 разных кетона (важен порядок прибавления реагентов)
Слайд 54
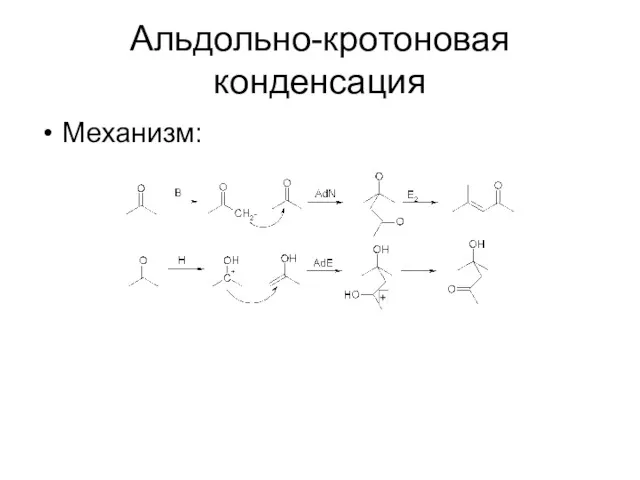
Альдольно-кротоновая конденсация
Механизм:
Слайд 55
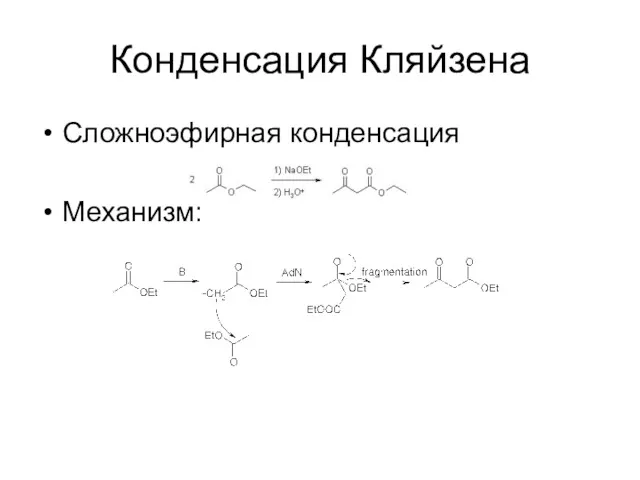
Конденсация Кляйзена
Сложноэфирная конденсация
Механизм:
Слайд 56
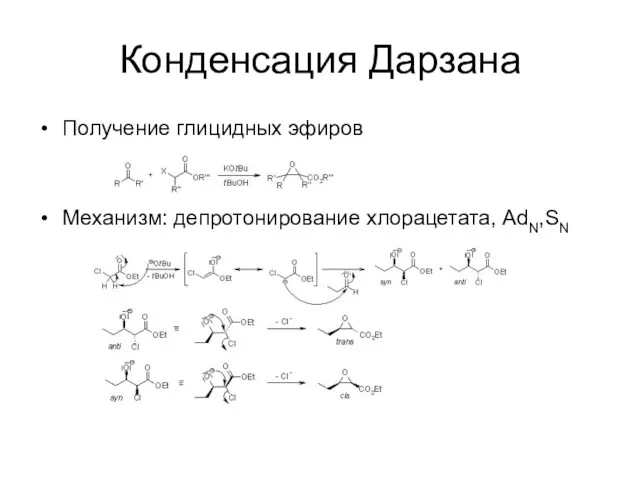
Конденсация Дарзана
Получение глицидных эфиров
Механизм: депротонирование хлорацетата, AdN,SN
Слайд 57
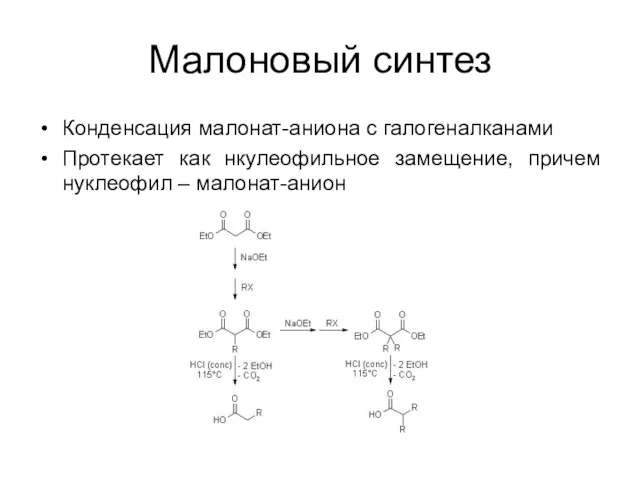
Малоновый синтез
Конденсация малонат-аниона с галогеналканами
Протекает как нкулеофильное замещение, причем нуклеофил –
малонат-анион
Слайд 58

Конденсация Манниха
Многокомпонентная конденсация неенолизуемого альдегида, амина и енолизуемого кетона:
Механизм: AdN, E2
и опять AdN
Слайд 59
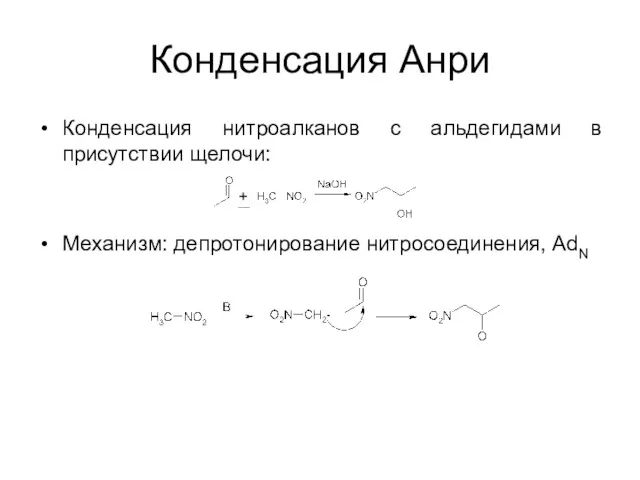
Конденсация Анри
Конденсация нитроалканов с альдегидами в присутствии щелочи:
Механизм: депротонирование нитросоединения, AdN
Слайд 60
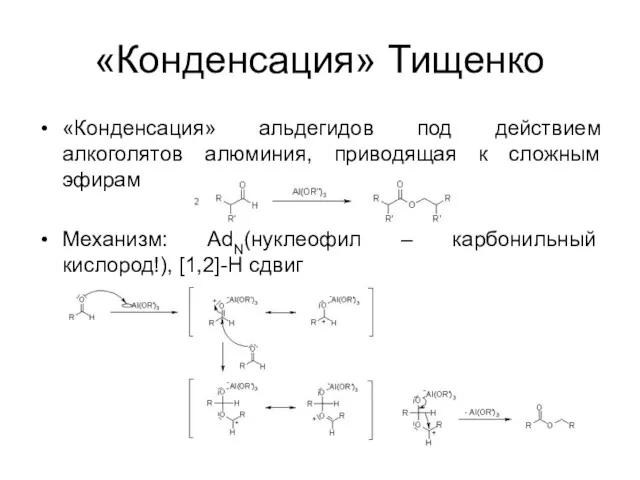
«Конденсация» Тищенко
«Конденсация» альдегидов под действием алкоголятов алюминия, приводящая к сложным эфирам
Механизм:
AdN(нуклеофил – карбонильный кислород!), [1,2]-H сдвиг
Слайд 61
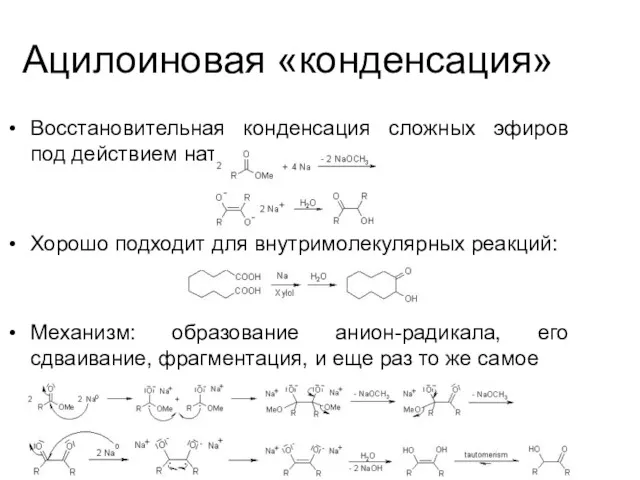
Ацилоиновая «конденсация»
Восстановительная конденсация сложных эфиров под действием натрия:
Хорошо подходит для внутримолекулярных
реакций:
Механизм: образование анион-радикала, его сдваивание, фрагментация, и еще раз то же самое
Слайд 62
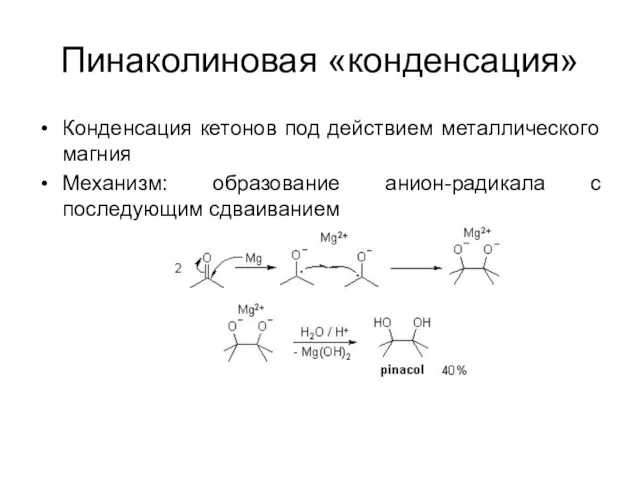
Пинаколиновая «конденсация»
Конденсация кетонов под действием металлического магния
Механизм: образование анион-радикала с последующим
сдваиванием
Слайд 63
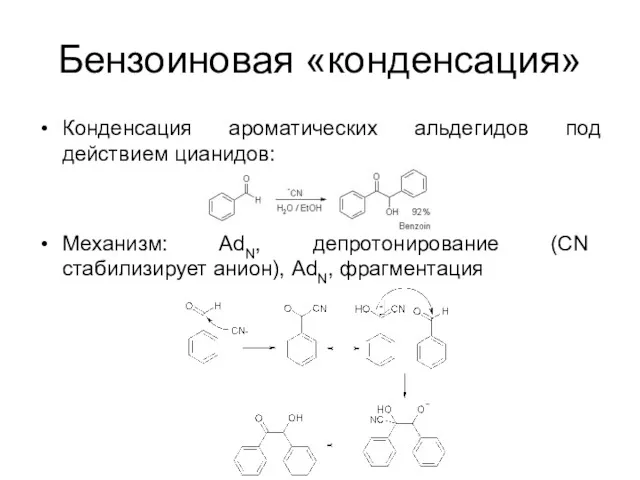
Бензоиновая «конденсация»
Конденсация ароматических альдегидов под действием цианидов:
Механизм: AdN, депротонирование (CN стабилизирует
анион), AdN, фрагментация
Слайд 64

Реакции окисления и восстановления
Формально очень многие органические реакции относятся к ОВ-реакциям
(например, SEAr), но мы не будем их рассматривать с такой точки зрения
Слайд 65

Восстановление карбонильных соединений
Реакционная способность падает в ряду RCHO>RCOR’>RCOOR’>RCOO-
Наиболее мощный восстановитель –
LiAlH4. Восстанавливает все до спиртов:
Боргидрид натрия NaBH4 восстанавливает альдегиды и кетоны (с трудом)
Вариации на тему боргидрида натрия – ацетоксиборгидрид натрия NaBH(OAc)3, цианоборгидрид натрия NaBH3CN, L-селектрид K[BH(CH(CH3)C(CH)3)3] – более селективны
Слайд 66
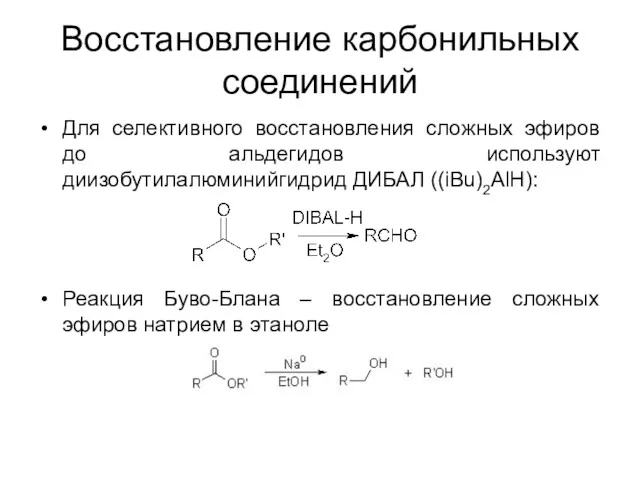
Восстановление карбонильных соединений
Для селективного восстановления сложных эфиров до альдегидов используют диизобутилалюминийгидрид
ДИБАЛ ((iBu)2AlH):
Реакция Буво-Блана – восстановление сложных эфиров натрием в этаноле
Слайд 67
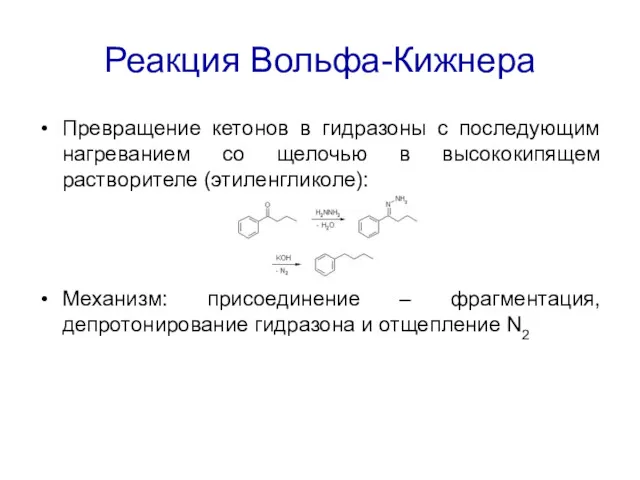
Реакция Вольфа-Кижнера
Превращение кетонов в гидразоны с последующим нагреванием со щелочью в
высококипящем растворителе (этиленгликоле):
Механизм: присоединение – фрагментация, депротонирование гидразона и отщепление N2
Слайд 68
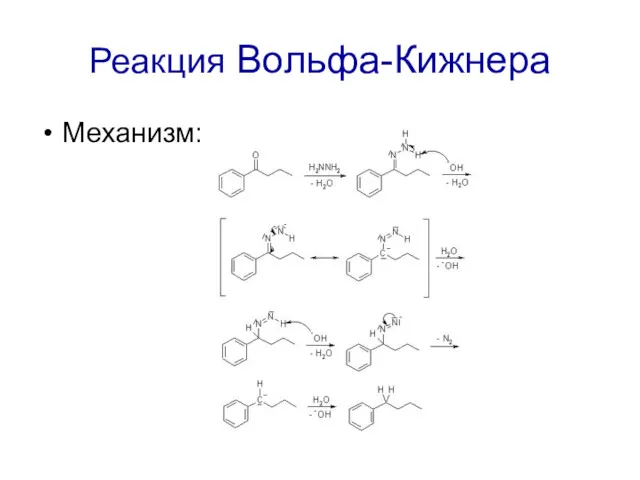
Реакция Вольфа-Кижнера
Механизм:
Слайд 69
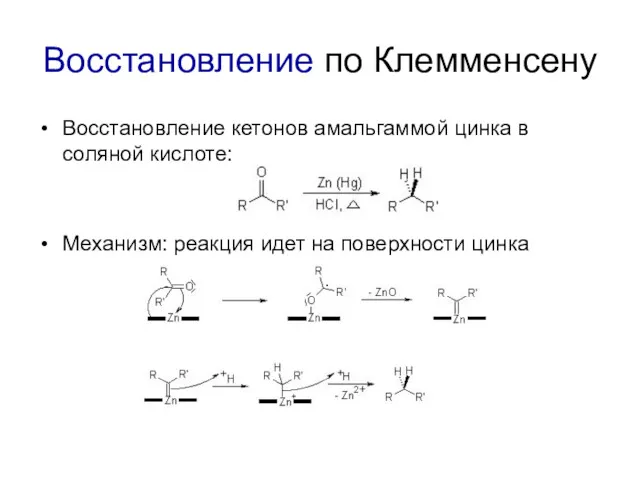
Восстановление по Клемменсену
Восстановление кетонов амальгаммой цинка в соляной кислоте:
Механизм: реакция идет
на поверхности цинка
Слайд 70
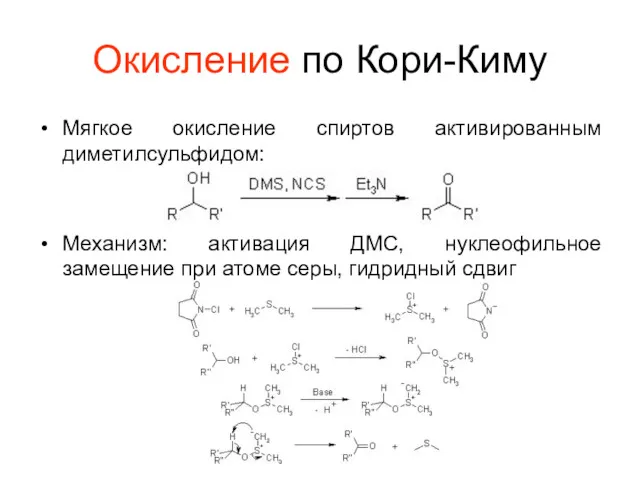
Окисление по Кори-Киму
Мягкое окисление спиртов активированным диметилсульфидом:
Механизм: активация ДМС, нуклеофильное замещение
при атоме серы, гидридный сдвиг
Слайд 71
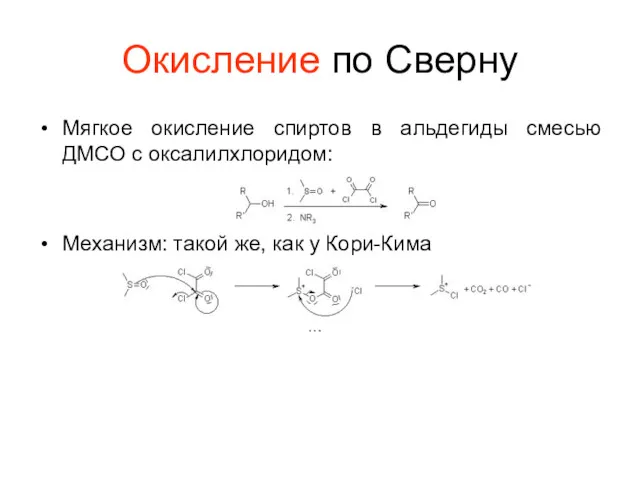
Окисление по Сверну
Мягкое окисление спиртов в альдегиды смесью ДМСО с оксалилхлоридом:
Механизм:
такой же, как у Кори-Кима
…
Слайд 72
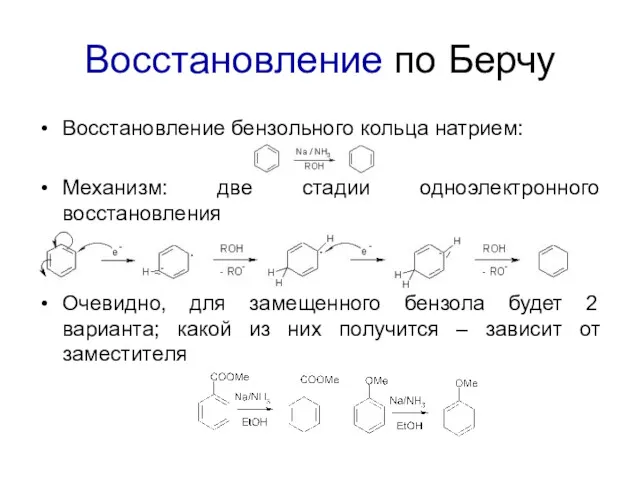
Восстановление по Берчу
Восстановление бензольного кольца натрием:
Механизм: две стадии одноэлектронного восстановления
Очевидно, для
замещенного бензола будет 2 варианта; какой из них получится – зависит от заместителя
Слайд 73
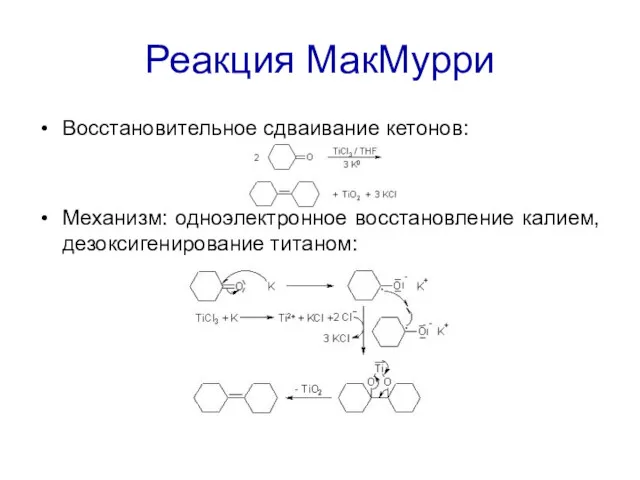
Реакция МакМурри
Восстановительное сдваивание кетонов:
Механизм: одноэлектронное восстановление калием, дезоксигенирование титаном:
Слайд 74

Реакция Глязера
Окислительное сдваивание терминальных ацетиленов под действием одновалентной меди:
Реакция видимо идет
через радикалы
Слайд 75

Реакция Нефа
Гидролиз нитросоединений до карбонильных соединений:
Механизм: депротонирование, AdN, фрагментация:
Слайд 76
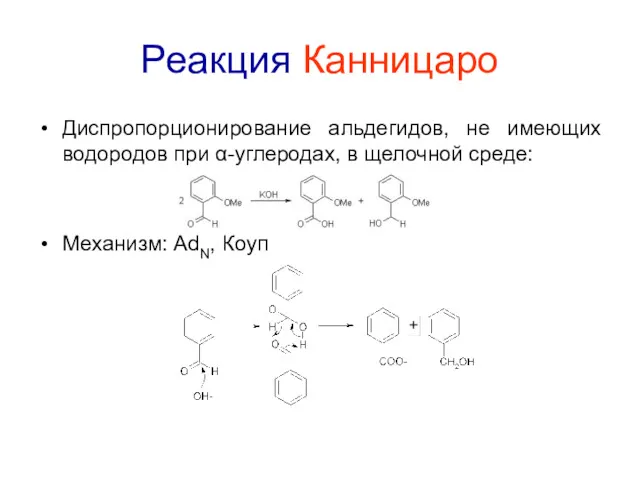
Реакция Канницаро
Диспропорционирование альдегидов, не имеющих водородов при α-углеродах, в щелочной среде:
Механизм:
AdN, Коуп
Слайд 77

Реакция Канницаро
Если целевым продуктом является спирт, используют кросс-Каницарро с формальдегидом:
Слайд 78

Реакции с участием фосфорорганических соединений
Слайд 79
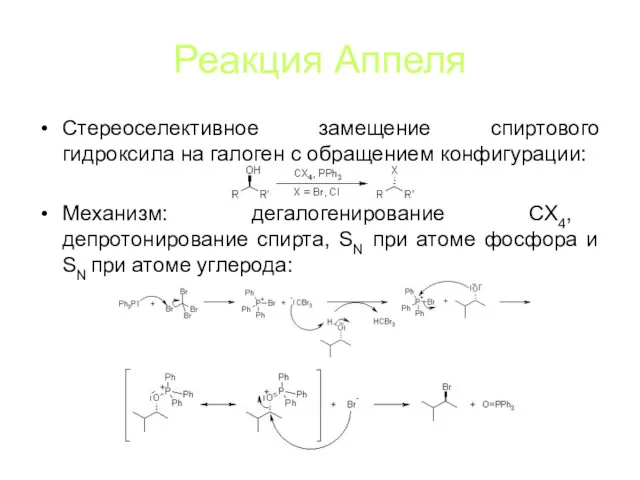
Реакция Аппеля
Стереоселективное замещение спиртового гидроксила на галоген с обращением конфигурации:
Механизм: дегалогенирование
CX4, депротонирование спирта, SN при атоме фосфора и SN при атоме углерода:
Слайд 80
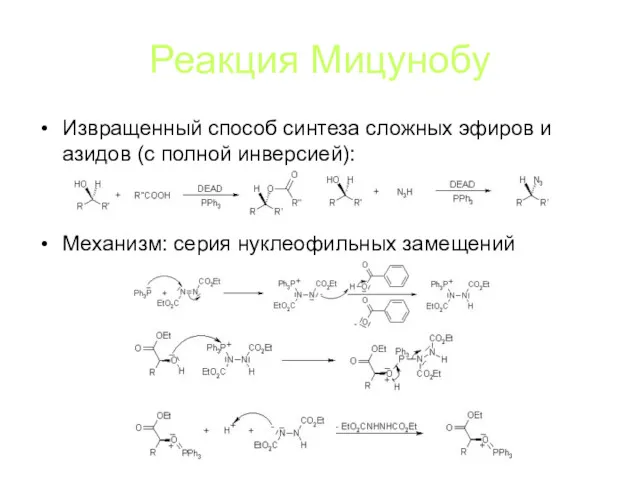
Реакция Мицунобу
Извращенный способ синтеза сложных эфиров и азидов (с полной инверсией):
Механизм:
серия нуклеофильных замещений
Слайд 81
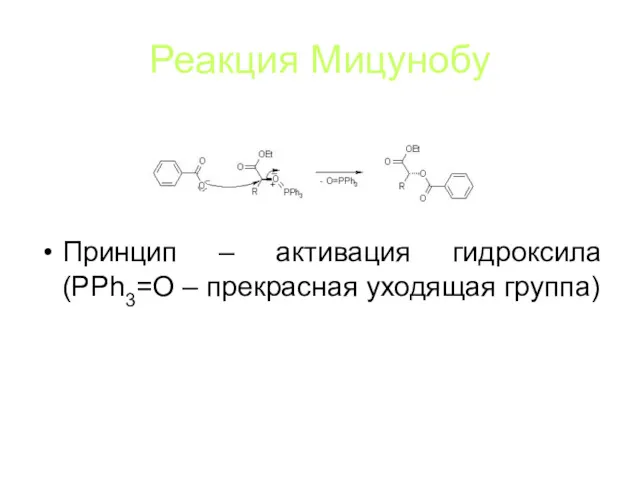
Реакция Мицунобу
Принцип – активация гидроксила (PPh3=O – прекрасная уходящая группа)
Слайд 82
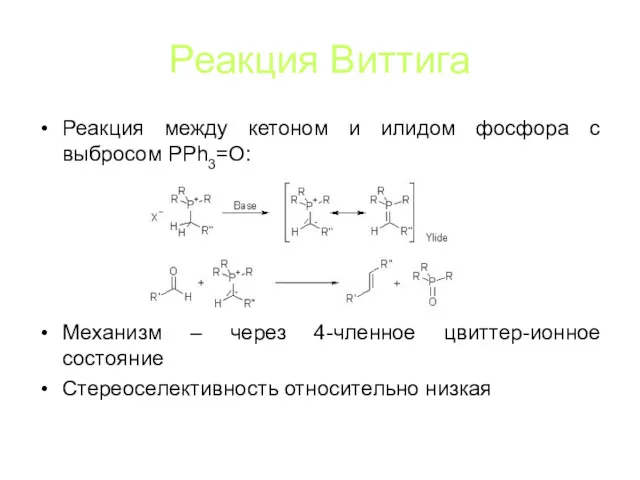
Реакция Виттига
Реакция между кетоном и илидом фосфора с выбросом PPh3=O:
Механизм –
через 4-членное цвиттер-ионное состояние
Стереоселективность относительно низкая
Слайд 83
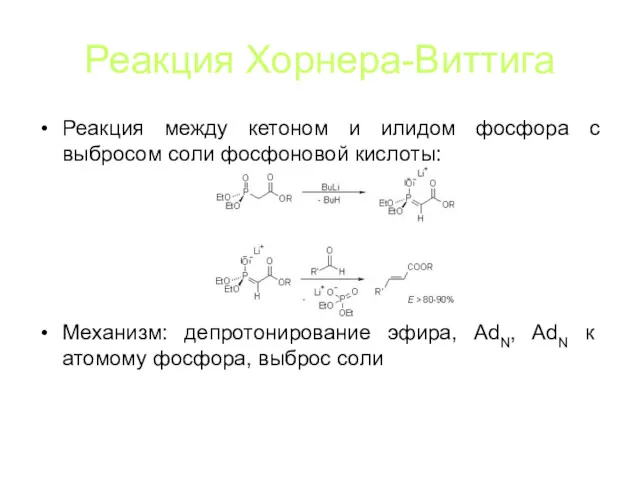
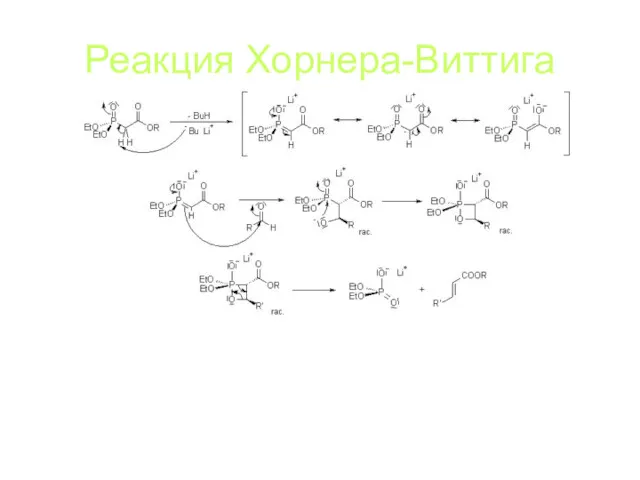
Реакция Хорнера-Виттига
Реакция между кетоном и илидом фосфора с выбросом соли фосфоновой
кислоты:
Механизм: депротонирование эфира, AdN, AdN к атомому фосфора, выброс соли
Слайд 84
Слайд 85

Слайд 86
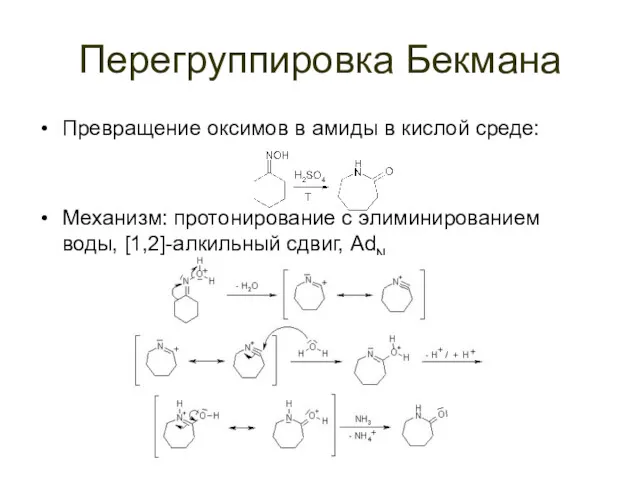
Перегруппировка Бекмана
Превращение оксимов в амиды в кислой среде:
Механизм: протонирование с элиминированием
воды, [1,2]-алкильный сдвиг, AdN
Слайд 87
![Бензильная перегруппировка Перегруппировка 1,2-дикетонов в α-гидроксикислоты в щелочной среде: Механизм: AdN, [1,2]-алкильный сдвиг](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-86.jpg)
Бензильная перегруппировка
Перегруппировка 1,2-дикетонов в α-гидроксикислоты в щелочной среде:
Механизм: AdN, [1,2]-алкильный сдвиг
Слайд 88
![Пинаколиновая перегруппировка Перегруппировка пинаконов в пинаколины в кислой среде: Механизм: протонирование, отщепление воды, [1,2]-алкильный сдвиг](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-87.jpg)
Пинаколиновая перегруппировка
Перегруппировка пинаконов в пинаколины в кислой среде:
Механизм: протонирование, отщепление воды,
[1,2]-алкильный сдвиг
Слайд 89

Перегруппировка Курциуса
Превращение ацилазидов в изоцианаты, которые затем могут дать карбаматы или
уретаны:
Механизм: отщепление азота, перегруппировка нитрена, AdN
Слайд 90
![Перегруппировка Коупа [3,3]-сигматропная перегруппировка Проходит по синхронному механизму:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-89.jpg)
Перегруппировка Коупа
[3,3]-сигматропная перегруппировка
Проходит по синхронному механизму:
Слайд 91
![Перегруппировка Кляйзена [3,3]-сигматропная перегруппировка аллилвиниловых и аллилфениловых эфиров: Механизм: синхронный, через шестичленное ПС](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-90.jpg)
Перегруппировка Кляйзена
[3,3]-сигматропная перегруппировка аллилвиниловых и аллилфениловых эфиров:
Механизм: синхронный, через шестичленное
ПС
Слайд 92
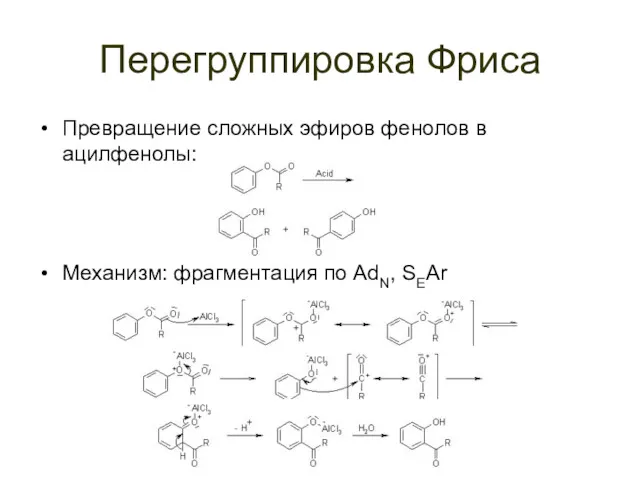
Перегруппировка Фриса
Превращение сложных эфиров фенолов в ацилфенолы:
Механизм: фрагментация по AdN, SEAr
Слайд 93
![Перегруппировка Фаворского Раскрытие циклопропанонов под действием щелочи: Механизм: AdN, [1,2]-гидридный сдвиг Общеизвестный вариант – гидролиз α-хлоркетонов:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-92.jpg)
Перегруппировка Фаворского
Раскрытие циклопропанонов под действием щелочи:
Механизм: AdN, [1,2]-гидридный сдвиг
Общеизвестный вариант –
гидролиз α-хлоркетонов:
Слайд 94

Часто используемые препаративные реакции
Слайд 95
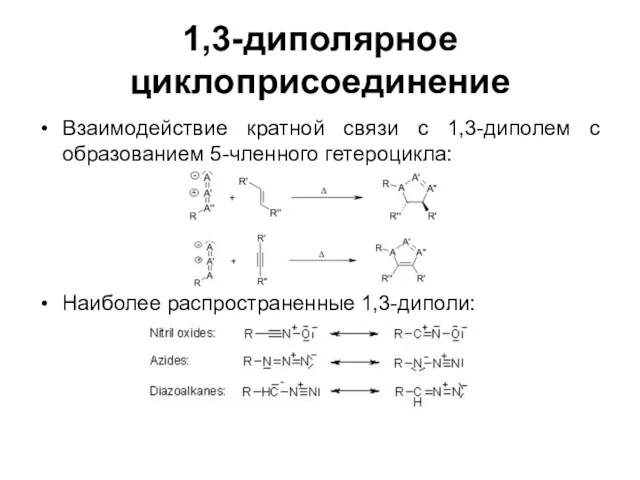
1,3-диполярное циклоприсоединение
Взаимодействие кратной связи с 1,3-диполем с образованием 5-членного гетероцикла:
Наиболее распространенные
1,3-диполи:
Слайд 96
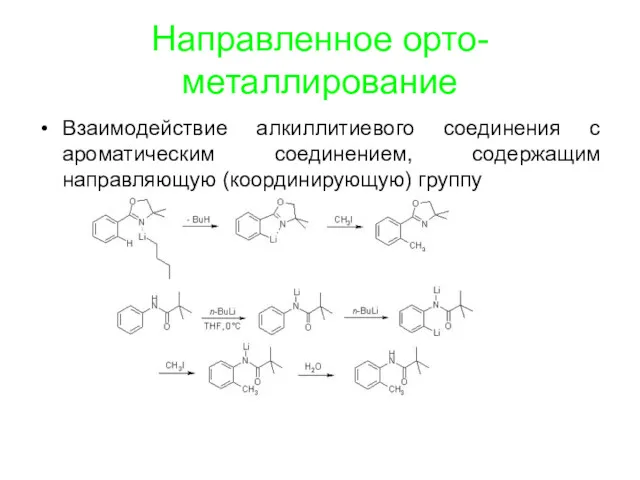
Направленное орто-металлирование
Взаимодействие алкиллитиевого соединения с ароматическим соединением, содержащим направляющую (координирующую) группу
Слайд 97
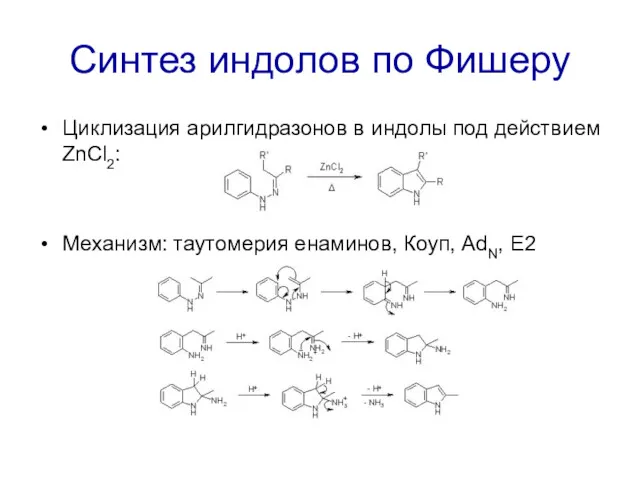
Синтез индолов по Фишеру
Циклизация арилгидразонов в индолы под действием ZnCl2:
Механизм: таутомерия
енаминов, Коуп, AdN, E2
Слайд 98
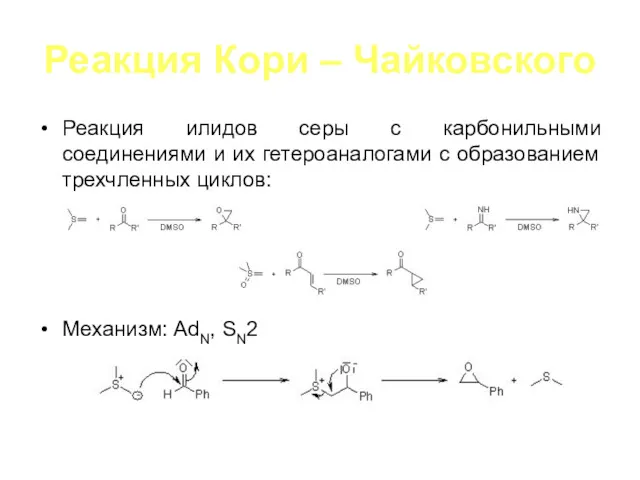
Реакция Кори – Чайковского
Реакция илидов серы с карбонильными соединениями и их
гетероаналогами с образованием трехчленных циклов:
Механизм: AdN, SN2
Слайд 99
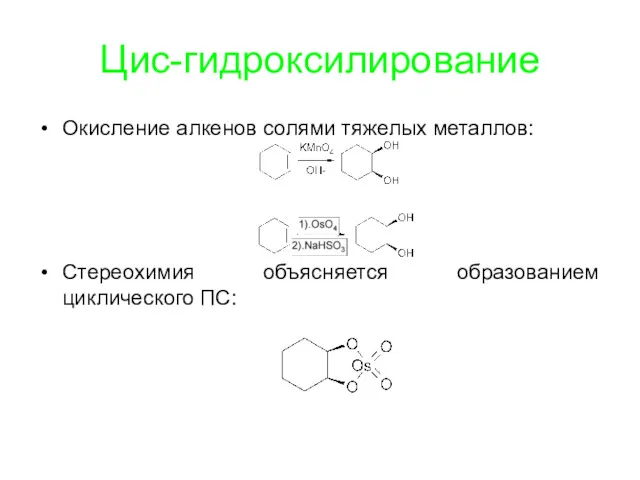
Цис-гидроксилирование
Окисление алкенов солями тяжелых металлов:
Стереохимия объясняется образованием циклического ПС:
Слайд 100
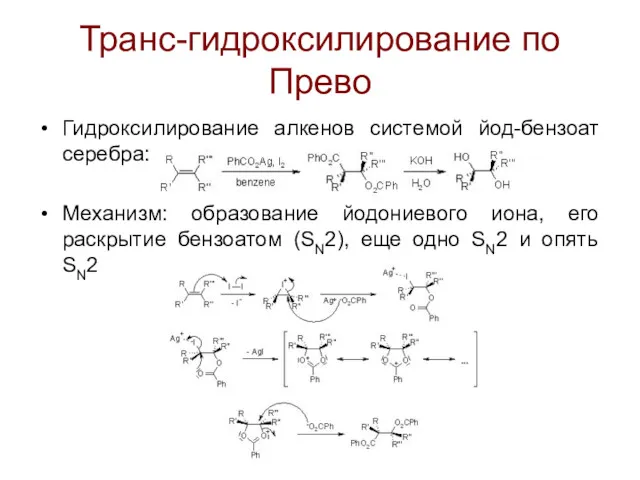
Транс-гидроксилирование по Прево
Гидроксилирование алкенов системой йод-бензоат серебра:
Механизм: образование йодониевого иона, его
раскрытие бензоатом (SN2), еще одно SN2 и опять SN2
Слайд 101
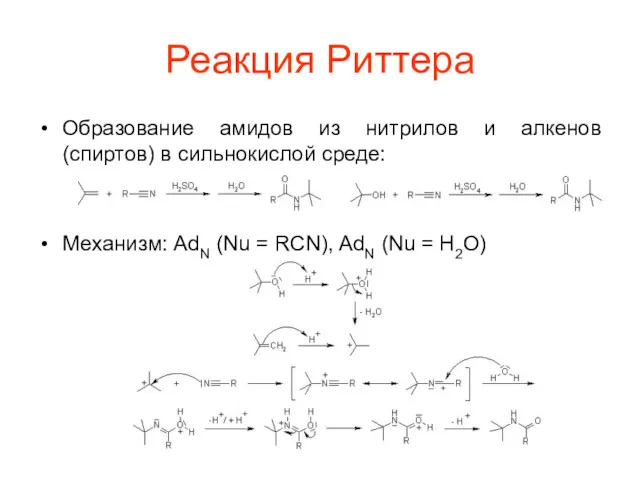
Реакция Риттера
Образование амидов из нитрилов и алкенов (спиртов) в сильнокислой среде:
Механизм:
AdN (Nu = RCN), AdN (Nu = H2O)
Слайд 102
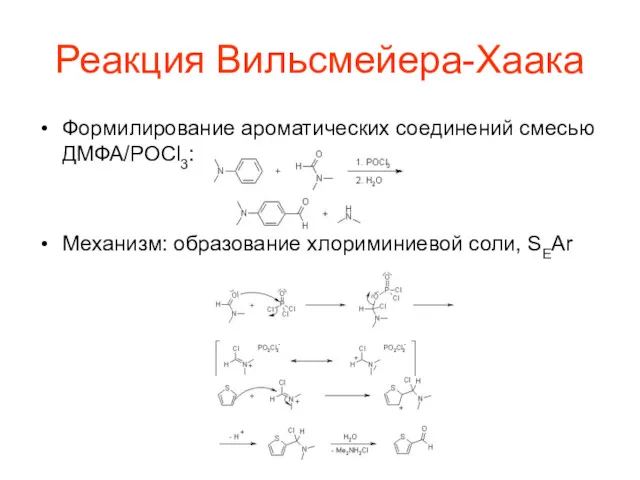
Реакция Вильсмейера-Хаака
Формилирование ароматических соединений смесью ДМФА/POCl3:
Механизм: образование хлориминиевой соли, SEAr
Слайд 103
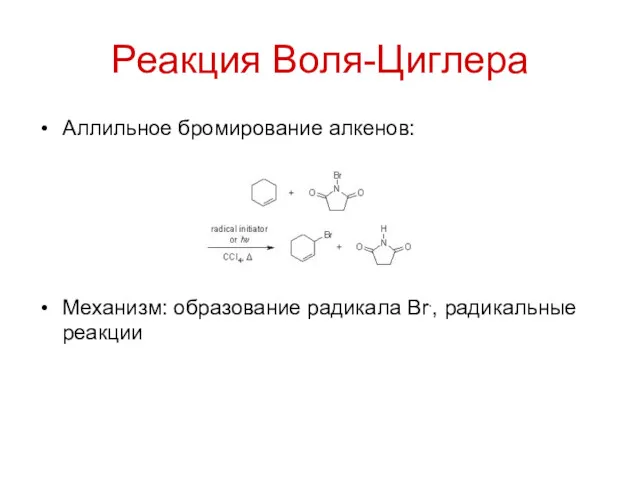
Реакция Воля-Циглера
Аллильное бромирование алкенов:
Механизм: образование радикала Br., радикальные реакции
Слайд 104
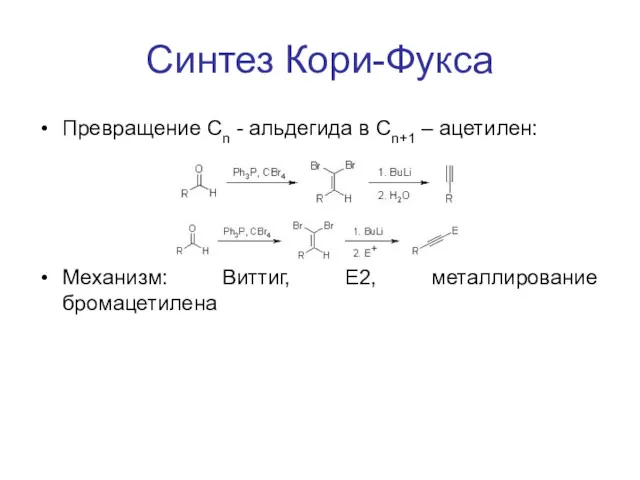
Синтез Кори-Фукса
Превращение Cn - альдегида в Сn+1 – ацетилен:
Механизм: Виттиг, E2,
металлирование бромацетилена
Слайд 105

Синтез Арндта-Айстерта
Удлинение углеродной цепи карбоновой кислоты на 1 атом углерода:
Механизм: AdN,
фрагментация нуклеофила, распад диазосоединения, [1,2]-алкильный сдвиг, AdN
Слайд 106
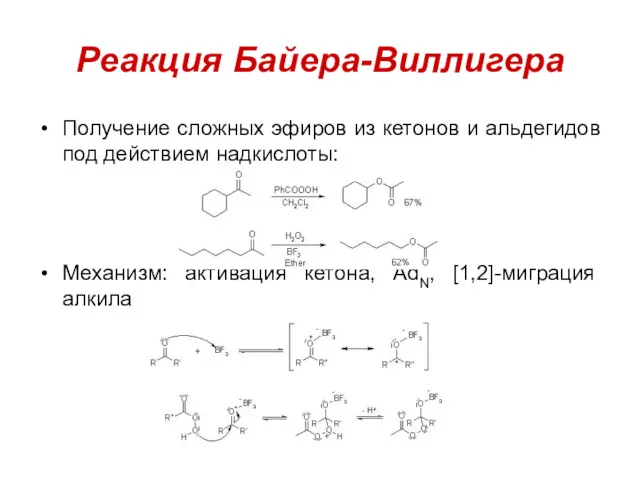
Реакция Байера-Виллигера
Получение сложных эфиров из кетонов и альдегидов под действием надкислоты:
Механизм:
активация кетона, AdN, [1,2]-миграция алкила
Слайд 107

Реакция Байера-Виллигера
Лучше мигрируют заместители, образующие более стабильные карбокатионы
Слайд 108
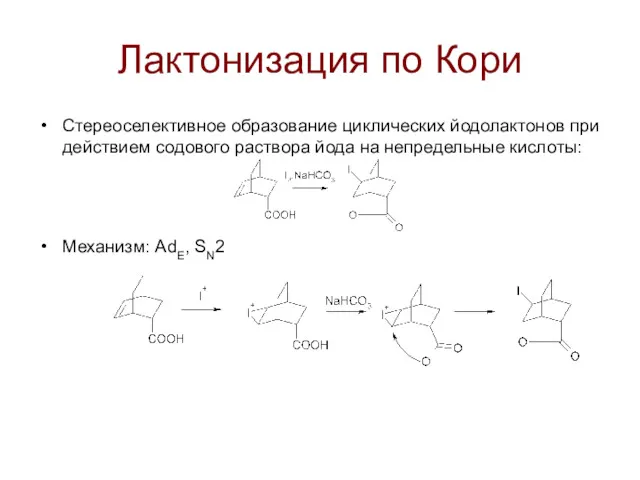
Лактонизация по Кори
Стереоселективное образование циклических йодолактонов при действием содового раствора йода
на непредельные кислоты:
Механизм: AdE, SN2
Слайд 109

Слайд 110

Расчетная задача на сообразительность
Пары циклогексена пропустили через нагретую до температуры красного
каления железную трубку. После пропускания объем смеси увеличился на 10%, а количество бромной воды на обесцвечивание продуктов реакции не изменилось по сравнению с количеством воды на обесцвечивание исходного циклогексена. Расчитать степень превращения циклогексена и состав продуктов на выходе.
Слайд 111

Задачи
1.При жестком окислении кетона Х получены равные количества CH3COOH, C2H5COOH и
C5H11COOH. Найти кетон.
2.Из циклопентанона можно синтезировать циклобутанкарбоновую кислоту следующим образом:
C5H8O + BuONO ? A
A + NH2Cl ? B
B (hv) ? C
C + H2O ? C4H7COOH
Какие вещества получаются на каждой стадии?
Слайд 112
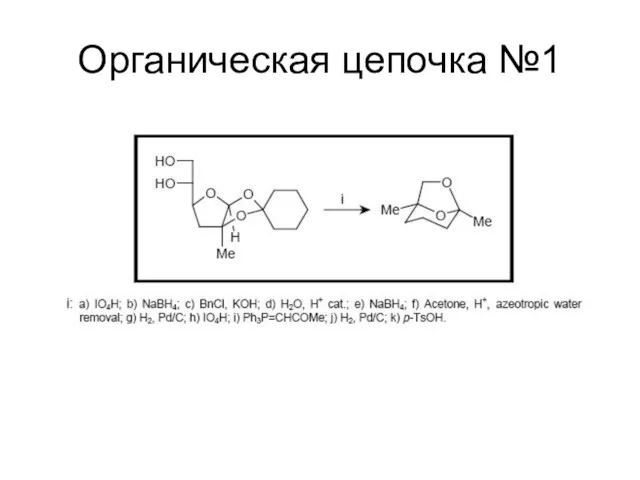
Слайд 113
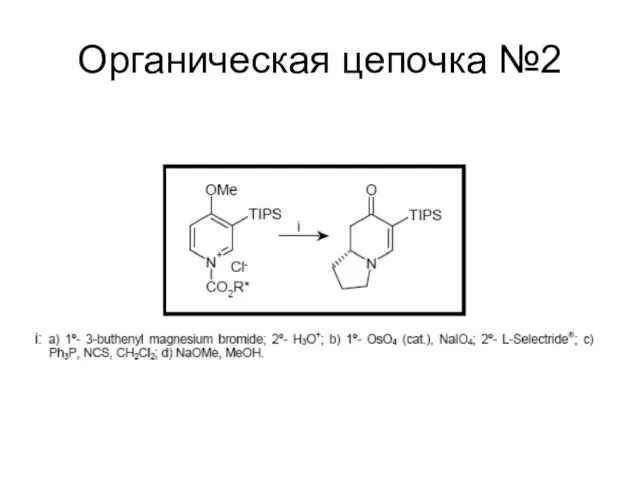
Слайд 114
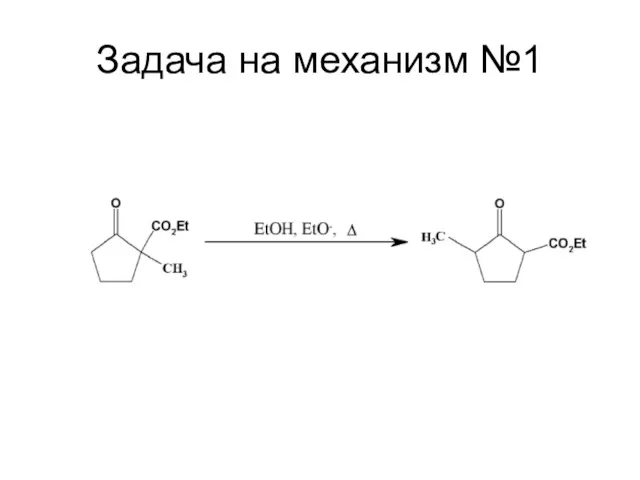
Слайд 115
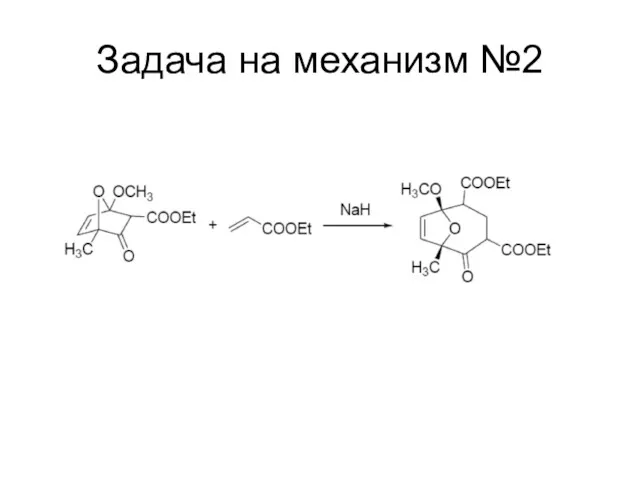
Слайд 116
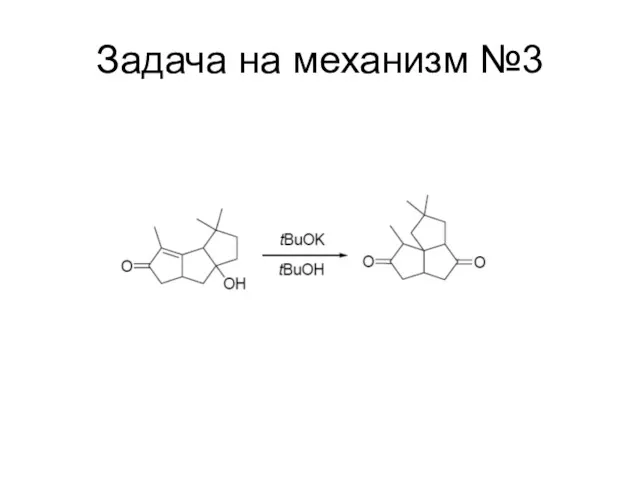
Слайд 117
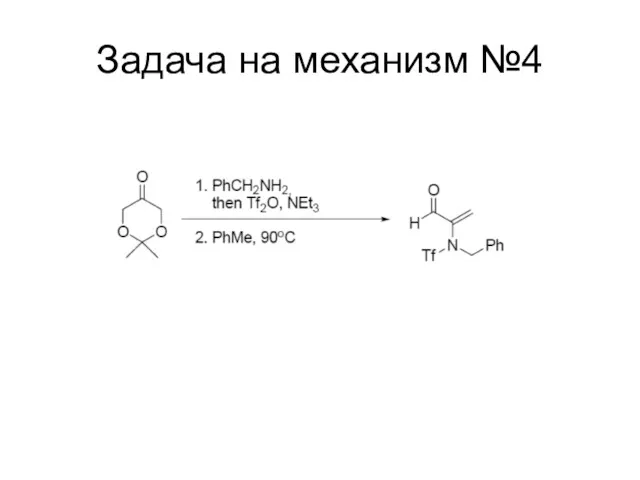
Слайд 118
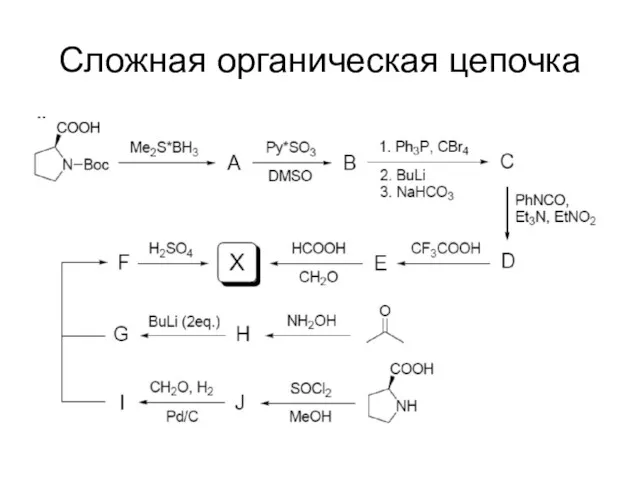
Сложная органическая цепочка
Слайд 119

ТАС
Интересное с теоретической точки зрения соединение Х можно получить исходя
из фталимида (А) следующим образом (ТАС - тетраацетат свинца):
A + NH2Cl (NaHCO3) ? Б
Б + С2Н4 + ТАС ? B
B + N2H4 ? Г + Д (изомер Б)
Г + ТАС + C2H4 ? X (C4H8N2)
Нагревание Х приводит к его изомеризации в гидразид ацетальдегида.
Напишите уравнения реакций. Рассмотрите эту схему синтеза, используя вместо этилена пропилен. Какие изомеры будут существовать для аналога Х в этом случае?
Слайд 120
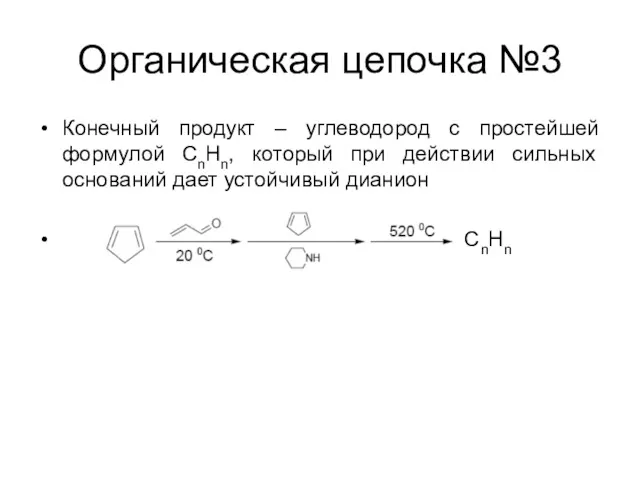
Органическая цепочка №3
Конечный продукт – углеводород с простейшей формулой CnHn, который
при действии сильных оснований дает устойчивый дианион
CnHn
Слайд 121
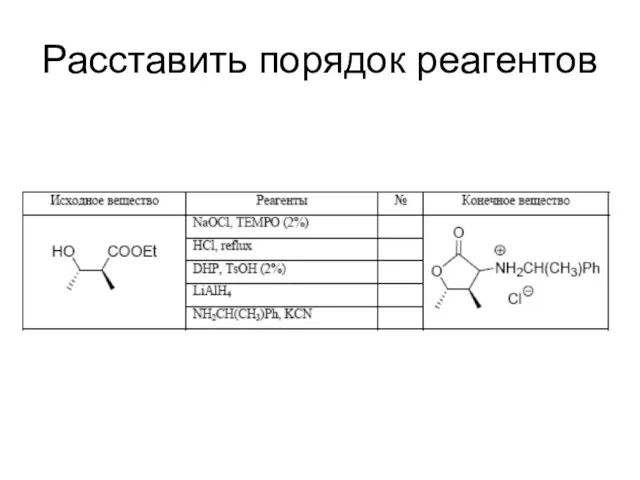
Расставить порядок реагентов
Слайд 122
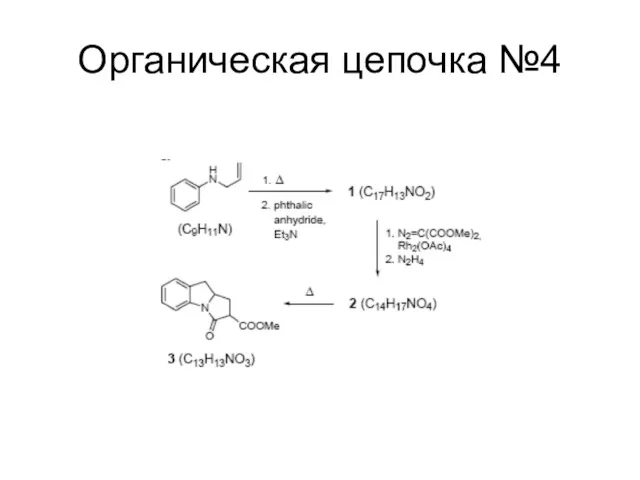
Слайд 123

Слайд 124
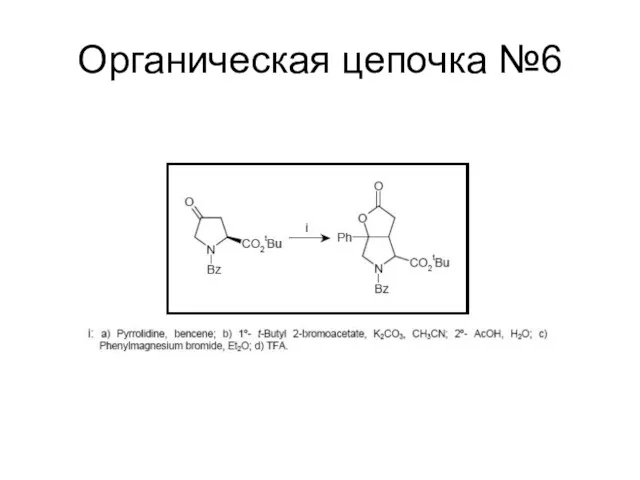
Слайд 125

Изомерные углеводороды
Два изомерных углеводорода, не обесцвечивающие бромную воду и имеющие соотношение
атомов углерода и водорода в них 1:2, образуют только по 1 монохлорпроизводному. Один из них образует 6, а другой - 7 дихлорпроизводных (без учета оптических изомеров). Найти углеводороды.
Слайд 126

Задача на механизм №5
Аминокетоны – важный класс органических соединений, так как
на их основе можно синтезировать различные гетероциклы. Также многие из них обладают физиологической активностью. Один из общих методов получения α-аминокетонов – синтез Небера. Расшифруйте промежуточные продукты, приведите механизм превращения B в C
















































![[1,n]-сдвиги Сдвиги заместителей (характерны для карбокатионов и карбанинов) [1,2]-гидридный сдвиг: [1,2]-алкильный сдвиг:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-49.jpg)




































![Бензильная перегруппировка Перегруппировка 1,2-дикетонов в α-гидроксикислоты в щелочной среде: Механизм: AdN, [1,2]-алкильный сдвиг](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-86.jpg)
![Пинаколиновая перегруппировка Перегруппировка пинаконов в пинаколины в кислой среде: Механизм: протонирование, отщепление воды, [1,2]-алкильный сдвиг](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-87.jpg)

![Перегруппировка Коупа [3,3]-сигматропная перегруппировка Проходит по синхронному механизму:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-89.jpg)
![Перегруппировка Кляйзена [3,3]-сигматропная перегруппировка аллилвиниловых и аллилфениловых эфиров: Механизм: синхронный, через шестичленное ПС](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-90.jpg)

![Перегруппировка Фаворского Раскрытие циклопропанонов под действием щелочи: Механизм: AdN, [1,2]-гидридный сдвиг Общеизвестный вариант – гидролиз α-хлоркетонов:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121567/slide-92.jpg)

































 Соединения химических элементов
Соединения химических элементов Строение атома. Химическая связь
Строение атома. Химическая связь Лекция № 7. Конкурентные реакции у насыщенного атома
Лекция № 7. Конкурентные реакции у насыщенного атома Монокристаллы InSb. Свойства, выращивание, применение
Монокристаллы InSb. Свойства, выращивание, применение Железо и его соединения
Железо и его соединения Значення хімічних процесів у природі
Значення хімічних процесів у природі Аминокислоты. Номенклатура
Аминокислоты. Номенклатура Распространенность химических элементов на земле и в космосе
Распространенность химических элементов на земле и в космосе Ізомери в природі
Ізомери в природі План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома Химический элемент. Неон
Химический элемент. Неон Полимеры. Каучук
Полимеры. Каучук Ансамбль пор в реальном твердом теле
Ансамбль пор в реальном твердом теле Введение в коллоидную химию. Основные понятия и закономерности
Введение в коллоидную химию. Основные понятия и закономерности Синтетические каучуки и их применение
Синтетические каучуки и их применение Побутові хімікати
Побутові хімікати Высшие жирные кислоты. Липиды
Высшие жирные кислоты. Липиды Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Свинец и цинк в природе
Свинец и цинк в природе Молекулы и атомы (часть 2)
Молекулы и атомы (часть 2) Защитно-декоративные покрытия
Защитно-декоративные покрытия Атомның электрондық конфегурациясы
Атомның электрондық конфегурациясы Карбонильные соединения
Карбонильные соединения Вода. Практическая работа
Вода. Практическая работа Растворы. Концентрация растворов
Растворы. Концентрация растворов Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Органическая химия. Пособие
Органическая химия. Пособие Фолий қышқылы (B9 дәрумені)
Фолий қышқылы (B9 дәрумені)