Содержание
- 2. Он один из самых гениальных химиков XIX века; провёл многочисленные определения физических констант соединений (удельные объёмы,
- 3. Дмитрий Иванович Менделеев Д. И. Менделеев — автор фундаментальных исследований по химии, физике, метрологии, метеорологии, экономике,
- 4. Дмитрий Иванович Менделеев родился 8 февраля 1834 года в селе Верхние Аремзяны недалеко от Тобольска, в
- 5. Научная деятельность Д. И. Менделеев исследовал (в 1854—1856 годах) явления изоморфизма, раскрывающие отношения между кристаллической формой
- 6. Периоди́ческая система хими́ческих элеме́нтов — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного
- 7. Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от
- 9. Структура периодической системы Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная».
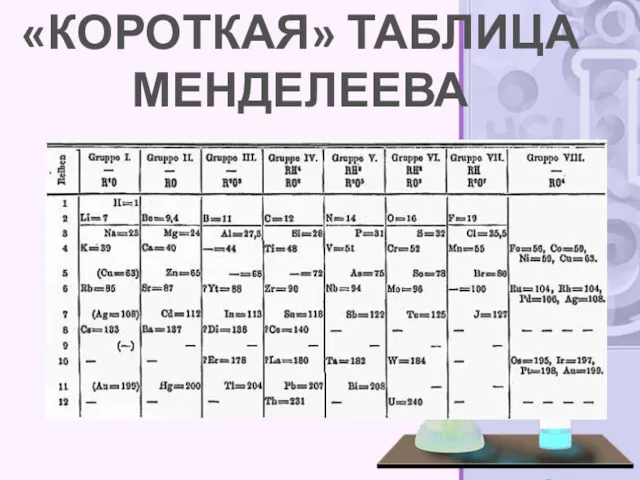
- 10. «КОРОТКАЯ» ТАБЛИЦА МЕНДЕЛЕЕВА
- 11. ДЛИННАЯ ФОРМА ТАБЛИЦЫ МЕНДЕЛЕЕВА
- 12. Короткая форма таблицы, содержащая восемь групп элементов[была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию
- 13. Значение периодической системы Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря
- 14. Разработанная в XIX в. в рамках науки химии, периодическая таблица явилась готовой систематизацией типов атомов для
- 15. Появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук —
- 16. ОПРЕДЕЛЕНИЯ, КОТОРЫЕ НАМ НАДО ЗНАТЬ ДЛЯ ИЗУЧЕНИЯ ТЕМЫ:
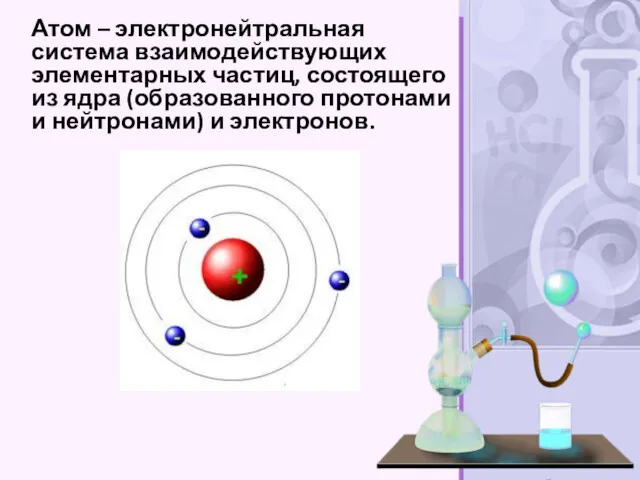
- 17. Атом – электронейтральная система взаимодействующих элементарных частиц, состоящего из ядра (образованного протонами и нейтронами) и электронов.
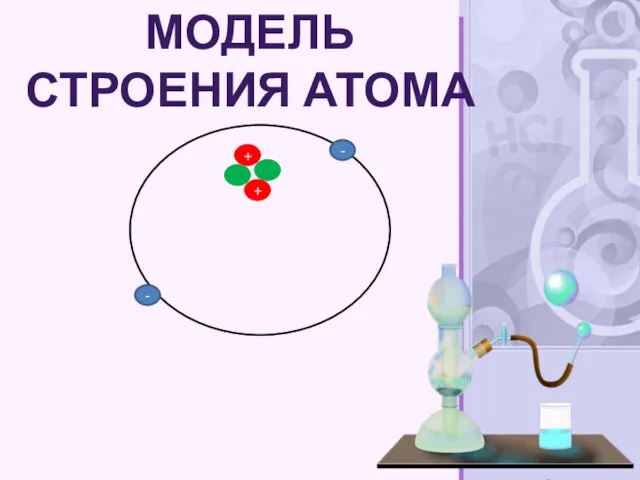
- 18. - - МОДЕЛЬ СТРОЕНИЯ АТОМА
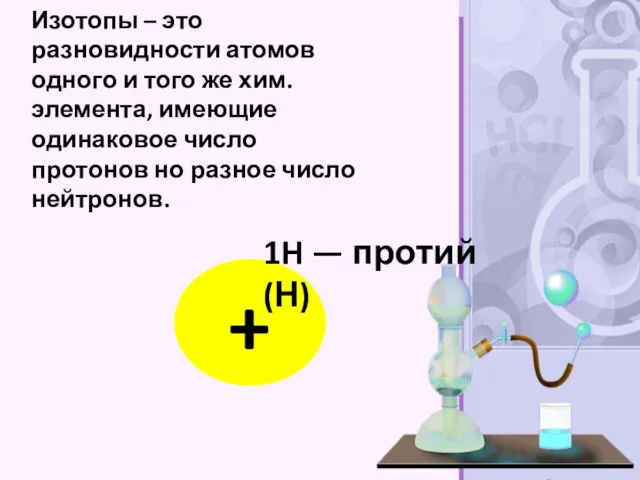
- 19. Изотопы – это разновидности атомов одного и того же хим.элемента, имеющие одинаковое число протонов но разное
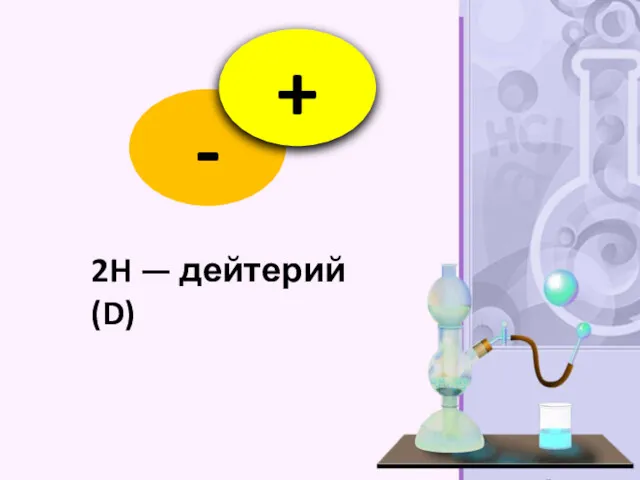
- 20. 2H — дейтерий (D)
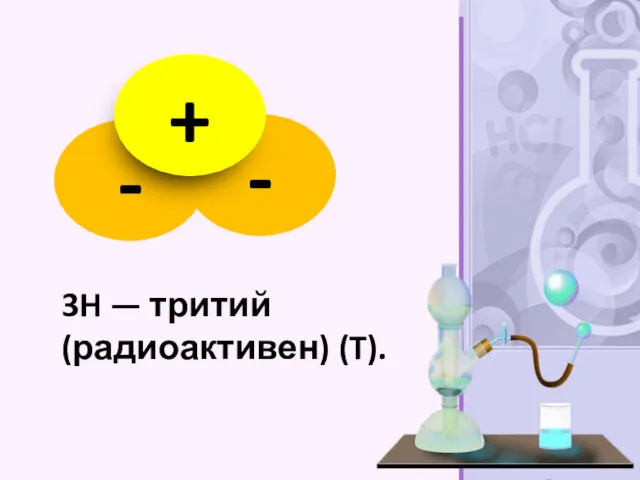
- 21. 3H — тритий (радиоактивен) (T).
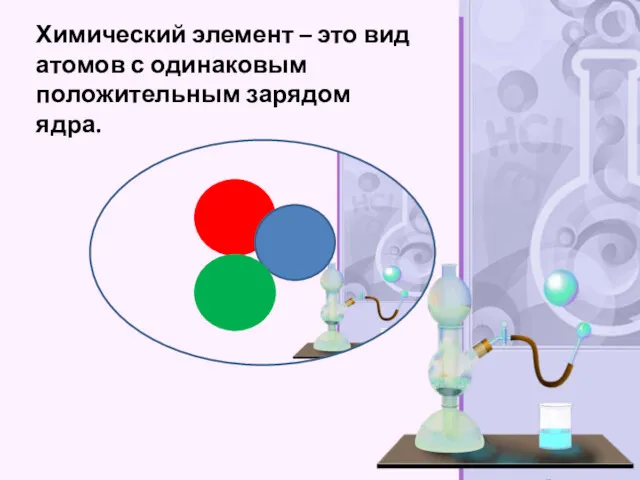
- 22. Химический элемент – это вид атомов с одинаковым положительным зарядом ядра.
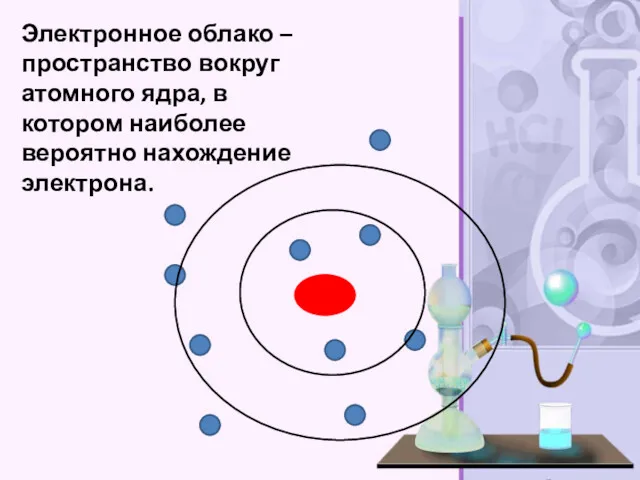
- 23. Электронное облако – пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона.
- 24. ФОРМЫ ЭЛЕКТРОННЫХ ОБЛАКОВ.
- 25. Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру
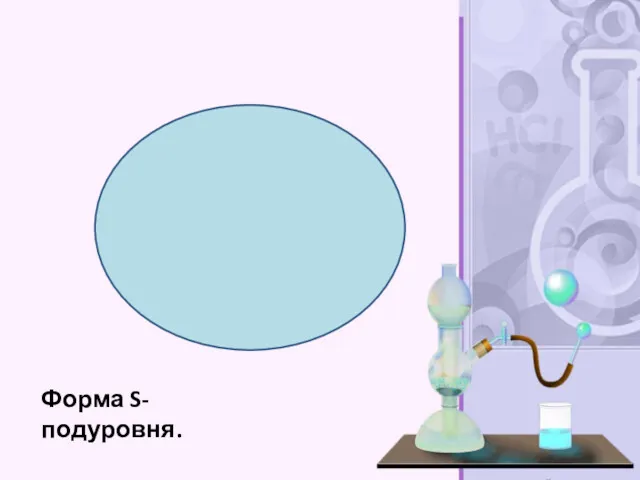
- 26. Форма S-подуровня.
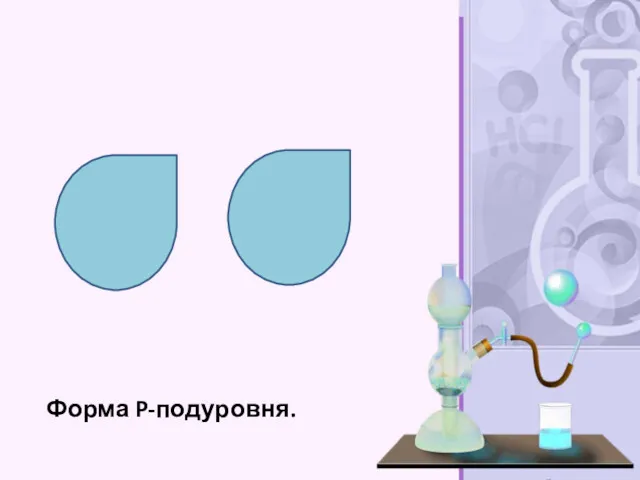
- 27. Форма P-подуровня.
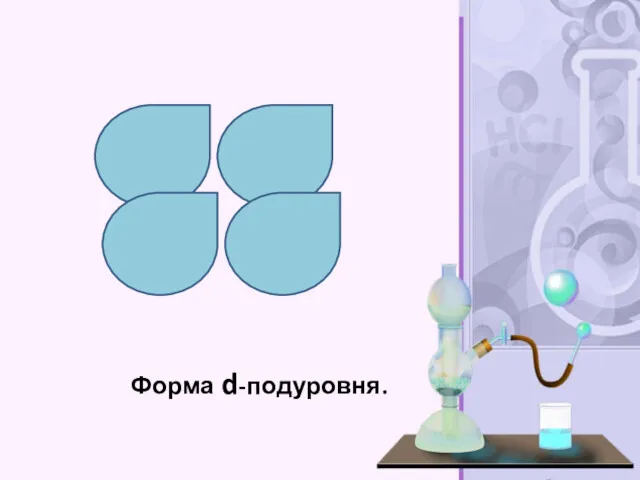
- 28. Форма d-подуровня.
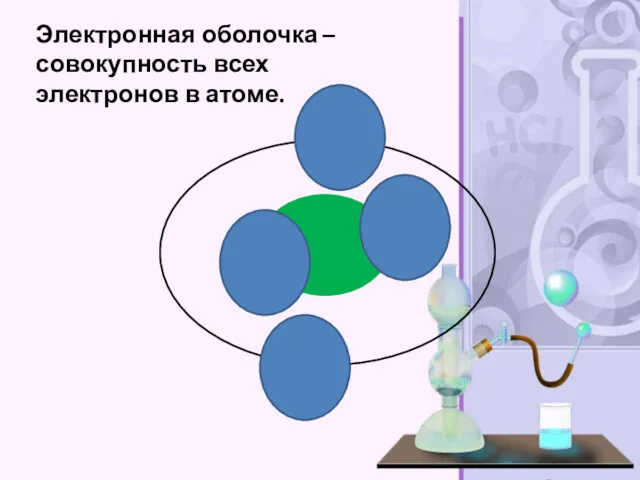
- 29. Электронная оболочка – совокупность всех электронов в атоме.
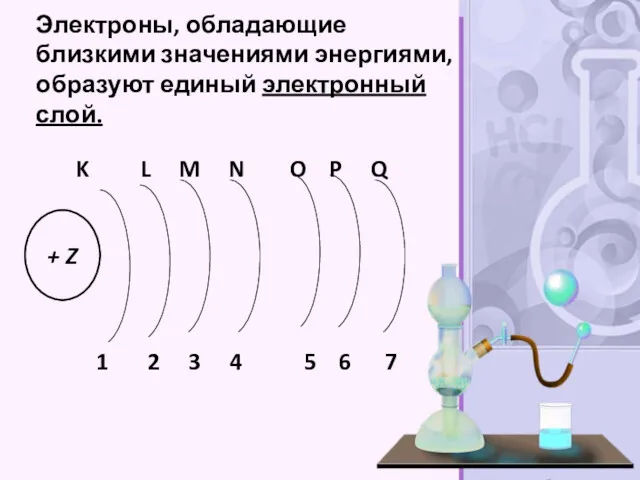
- 30. Электроны, обладающие близкими значениями энергиями, образуют единый электронный слой.
- 31. ПЕРИОДИЧЕСКАЯ СИСТЕМА Д. И. МЕНДЕЛЕЕВА В СВЕТЕ УЧЕНИЯ О СТРОЕНИИ АТОМА.
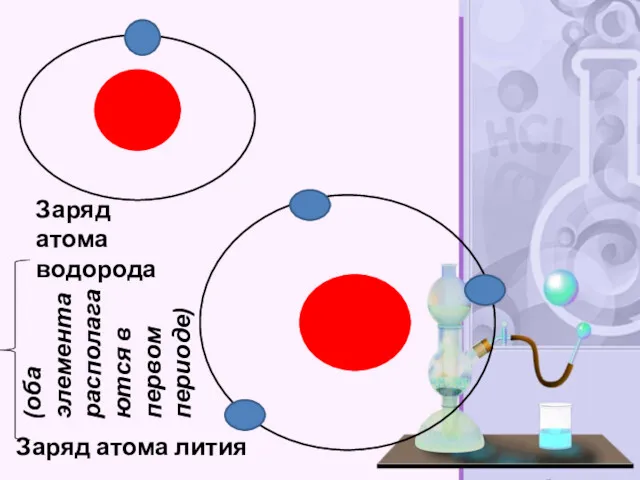
- 32. В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются, так как: а)
- 33. Заряд атома водорода Заряд атома лития (оба элемента располагаются в первом периоде)
- 34. В пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают,
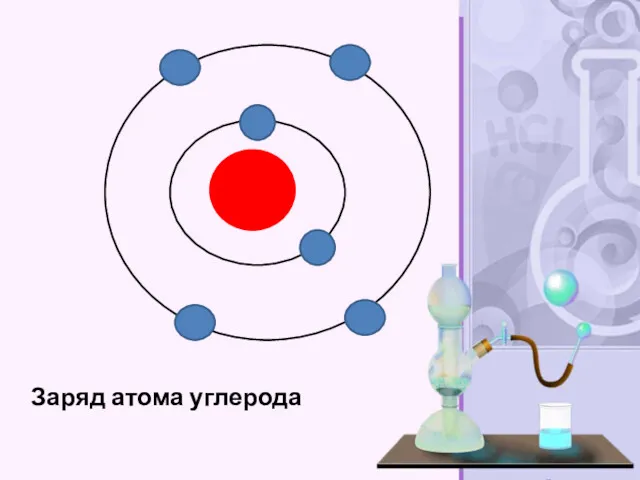
- 35. Заряд атома углерода
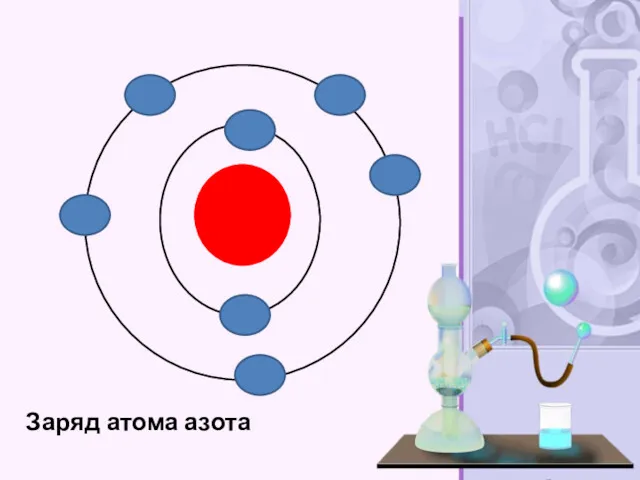
- 36. Заряд атома азота
- 37. ПРИМЕРЫ ГРАФИЧЕСКИХ ФОРМУЛ НЕКОТОРЫХ МЕТАЛЛОВ И НЕМЕТАЛЛОВ
- 38. Элементы неметаллов Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической
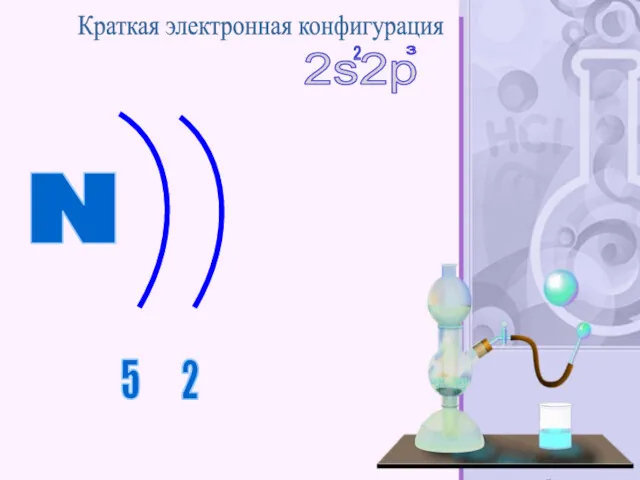
- 40. N 5 2 2 Краткая электронная конфигурация 2s2p 2 3
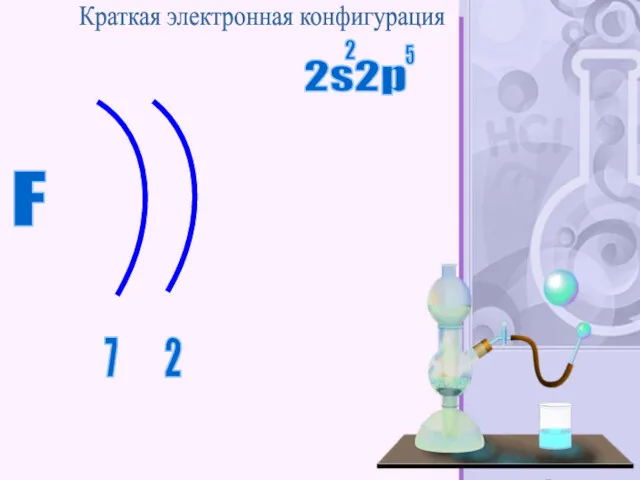
- 42. F 2 7 Краткая электронная конфигурация 2s2p 2 5
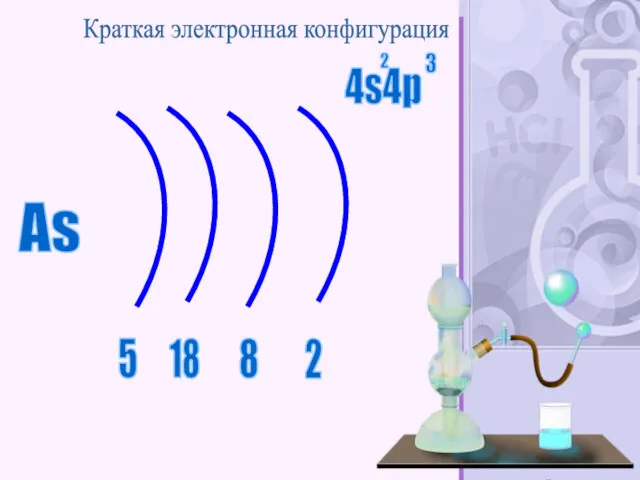
- 44. As 2 5 18 8 Краткая электронная конфигурация 4s4p 2 3
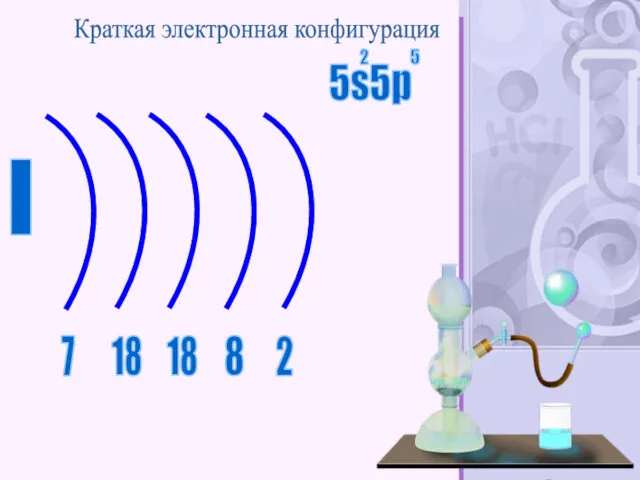
- 46. I 2 18 18 8 7 Краткая электронная конфигурация 5s5p 2 5
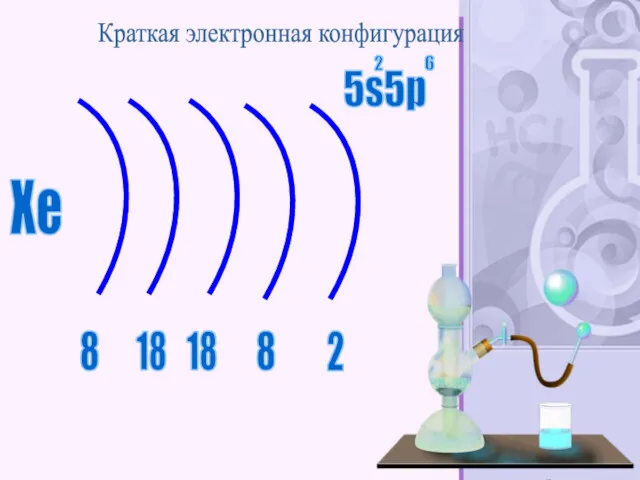
- 48. Xe 2 8 8 18 18 Краткая электронная конфигурация 5s5p 2 6
- 49. Элементы металлов По своему электронному строению металлы делятся на s-, p-, d- и f-металлы. s-металлы расположены
- 51. Cu 2 2 8 17 Краткая электронная конфигурация 3d4s 10 1
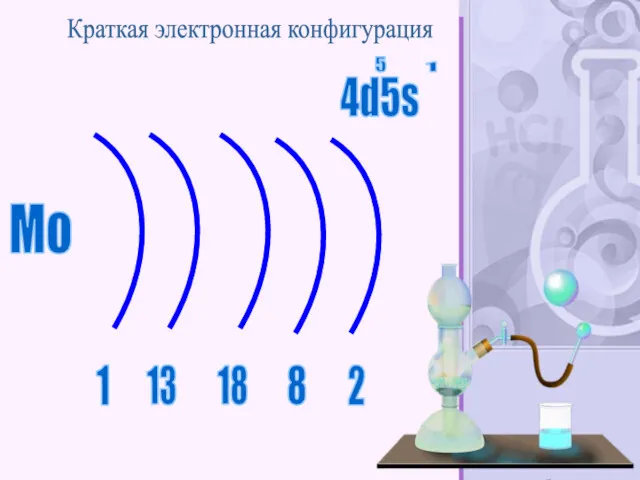
- 52. Молибде́н — элемент побочной подгруппы шестой группы пятого периода периодической системы химических элементов Д. И. Менделеева,
- 53. Mo 2 1 13 18 8 Краткая электронная конфигурация 4d5s 5 1
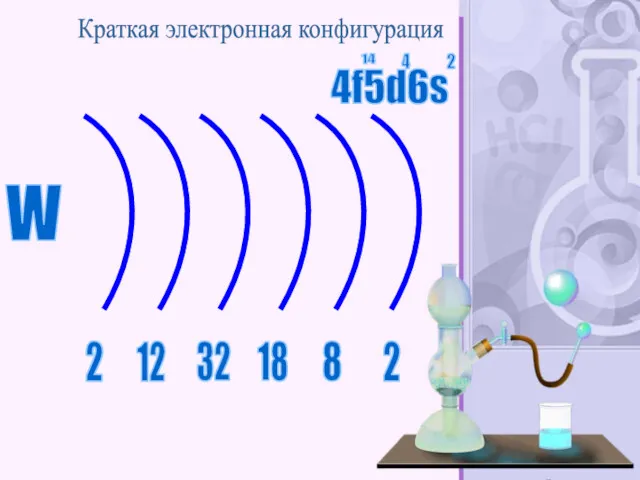
- 54. Вольфра́м — химический элемент с атомным номером 74 в периодической системе, обозначается символом W (лат. Wolframium),
- 55. W 2 2 12 32 18 8 2 Краткая электронная конфигурация 4f5d6s 14 4 2
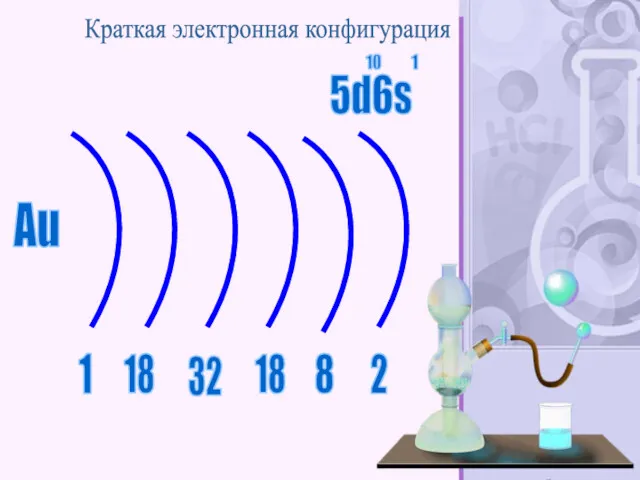
- 56. Зо́лото — элемент побочной подгруппы первой группы, шестого периода периодической системы химических элементов Д. И. Менделеева,
- 57. Au 2 18 32 18 8 1 Краткая электронная конфигурация 5d6s 10 1
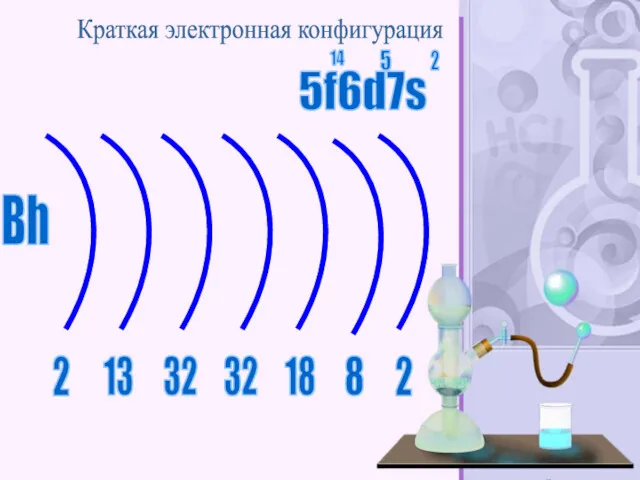
- 58. Бо́рий (лат. Bohrium, обозначается символом Bh) — нестабильный радиоактивный химический элемент с атомным номером 107. Известны
- 59. Bh 2 8 2 13 32 32 18 Краткая электронная конфигурация 5f6d7s 14 5 2
- 60. ИСПОЛЬЗУЕМАЯ ЛИТЕРАТУРА: Интернет – источники; Габриелян О. С., 11 Класс; Базовый уровень.
- 61. ВЫПОЛНИЛИ: УЧЕНИЦЫ 11 А КЛАССА
- 62. САМОЙЛОВА ОКСАНА И
- 64. Скачать презентацию




































 Хімічний зв'язок
Хімічний зв'язок Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері Натуральный и синтетический каучуки. Резина
Натуральный и синтетический каучуки. Резина Химическая картина мира
Химическая картина мира Строение и свойства циклоалканов
Строение и свойства циклоалканов Теория строения органических соединений. Лекция 17
Теория строения органических соединений. Лекция 17 Аминокислоты. Производные карбоновых кислот,
Аминокислоты. Производные карбоновых кислот, Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Кислородсодержащие органические соединения- спирты. 10 класс
Кислородсодержащие органические соединения- спирты. 10 класс Комплексные соединения
Комплексные соединения Химические вещества как строительные и поделочные материалы
Химические вещества как строительные и поделочные материалы Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты
Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты Металлическая связь
Металлическая связь Атомы химических элементов. Электроотрицательность атомов химических элементов
Атомы химических элементов. Электроотрицательность атомов химических элементов Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз Природные источники углеводородов и топливные ресурсы Западной Сибири
Природные источники углеводородов и топливные ресурсы Западной Сибири Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Способы разделения смесей, применяемые в быту
Способы разделения смесей, применяемые в быту Химические свойства металлов
Химические свойства металлов Органикалық қосылыстардың
Органикалық қосылыстардың Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений
Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений Хром. Хром в организме человека
Хром. Хром в организме человека Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Полимеры. Классификация полимеров
Полимеры. Классификация полимеров Оксиды. Названия оксидов
Оксиды. Названия оксидов Природные источники углеводородов
Природные источники углеводородов Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях
Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях