Содержание
- 2. Хімічний зв’язок це сила, яка діє між атомами і забезпечує сполучення їх у молекулу або кристал
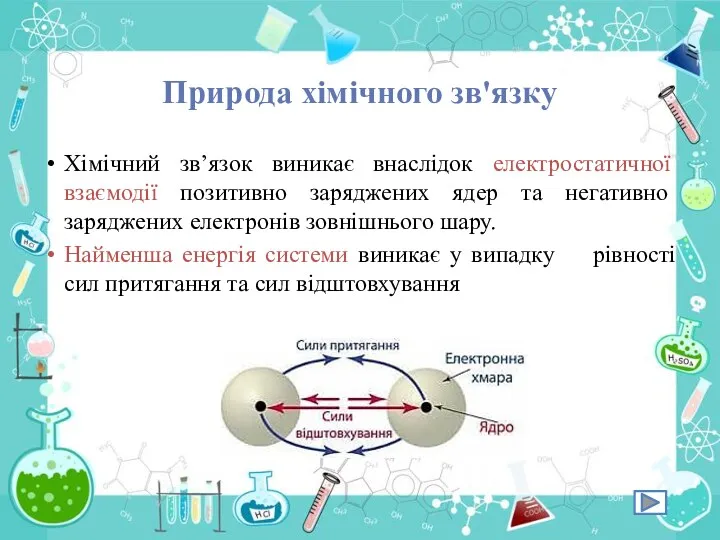
- 3. Природа хімічного зв'язку Хімічний зв’язок виникає внаслідок електростатичної взаємодії позитивно заряджених ядер та негативно заряджених електронів
- 4. Природа хімічного зв'язку Причиною утворення хімічного зв'язку є «прагнення» атомів досягти найбільш стійких електронних конфігурацій, в
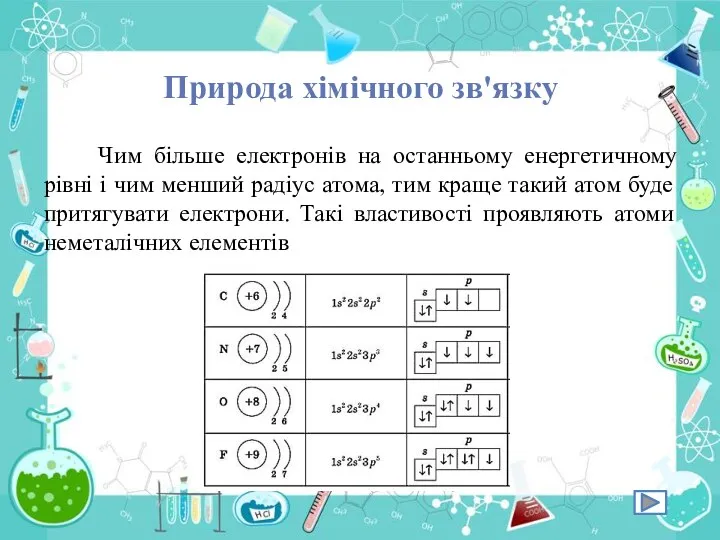
- 5. Природа хімічного зв'язку Чим більше електронів на останньому енергетичному рівні і чим менший радіус атома, тим
- 6. Природа хімічного зв'язку Чим менше електронів на останньому енергетичному рівні і чим більший радіус атома, тим
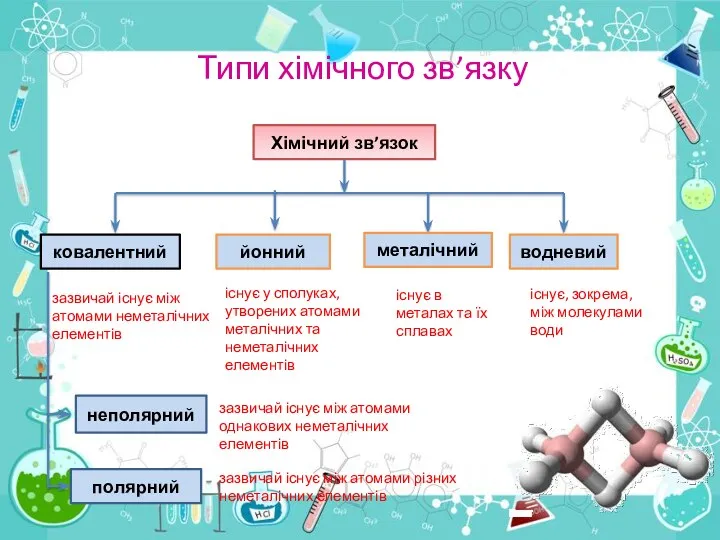
- 7. Типи хімічного зв’язку Хімічний зв’язок ковалентний йонний металічний водневий неполярний полярний зазвичай існує між атомами неметалічних
- 8. Електронегативність це здатність атома притягувати спільні електронні хмари Чим більше електронів на зовнішньому рівні та чим
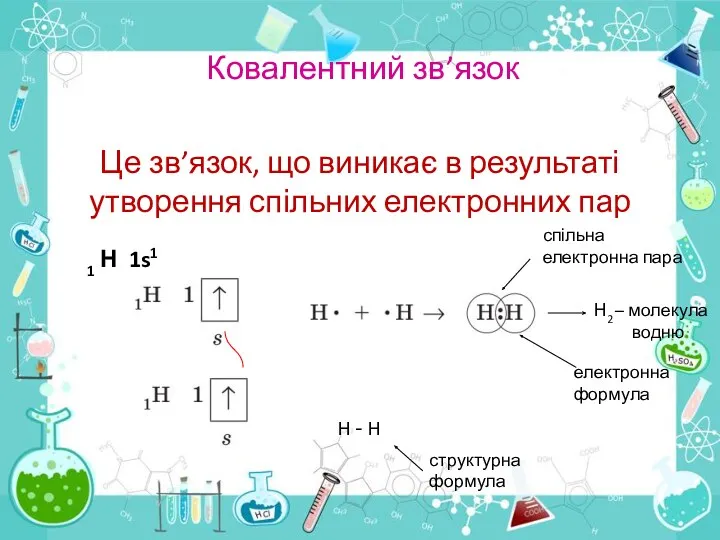
- 9. Ковалентний зв’язок Це зв’язок, що виникає в результаті утворення спільних електронних пар 1 Н 1s1 спільна
- 10. Утворення молекули водню Перекривання s- орбіталей атомів Гідрогену утворює ділянку підвищеної електронної густини, де переважно перебуває
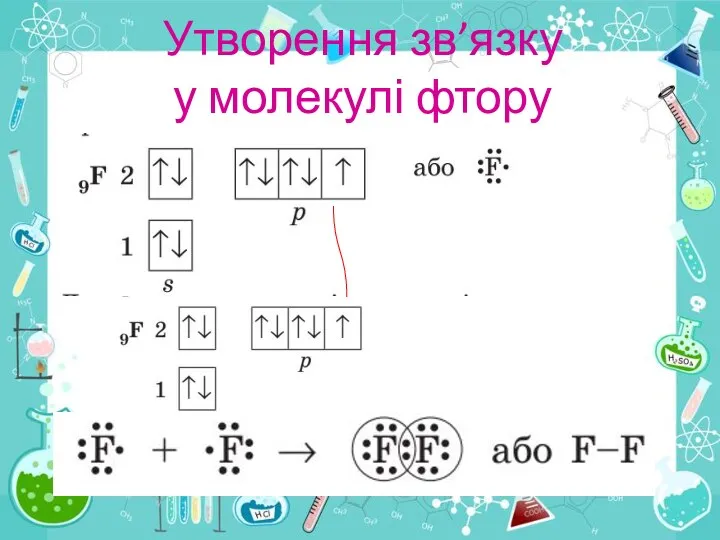
- 11. Утворення зв’язку у молекулі фтору
- 12. Утворення молекули фтору Перекривання р- орбіталей атомів Флуору під часутворення молекули фтору. Інші р- орбіталі ,
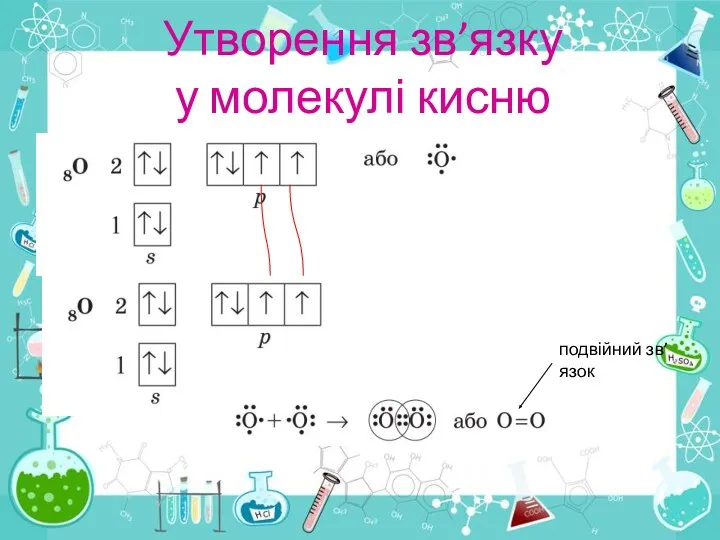
- 13. Утворення зв’язку у молекулі кисню подвійний зв’язок
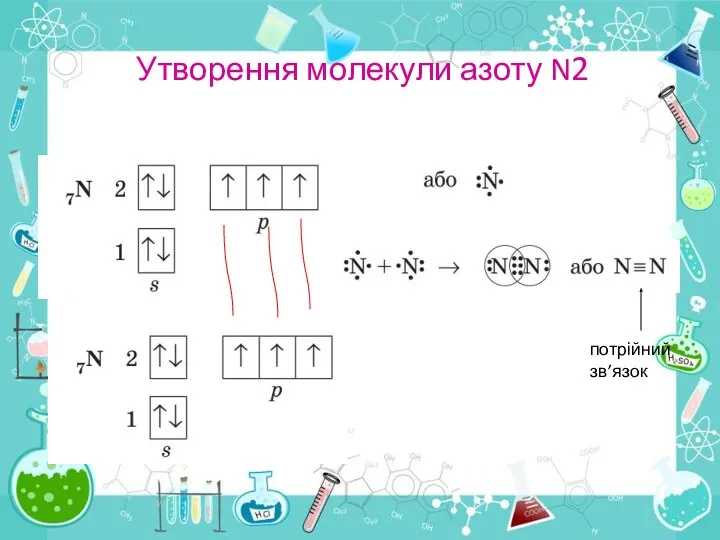
- 14. Утворення молекули азоту N2 потрійний зв’язок
- 15. Йонний зв’язок Йонний зв’язок – це зв’язок, що виникає між катіонами та аніонами речовини
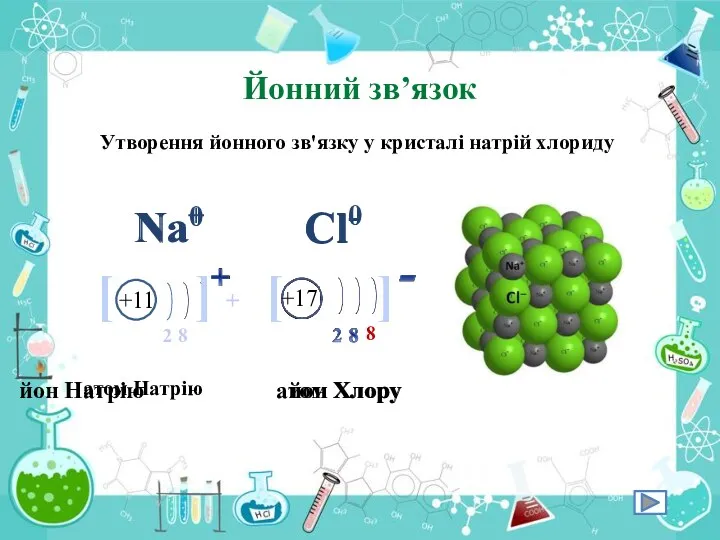
- 16. Йонний зв’язок Утворення йонного зв'язку у кристалі натрій хлориду атом Натрію Na0 +11 8 2 1
- 17. Йонний зв’язок Утворення йонного зв'язку у кристалі натрій хлориду атом Натрію йон Натрію Na0 +11 8
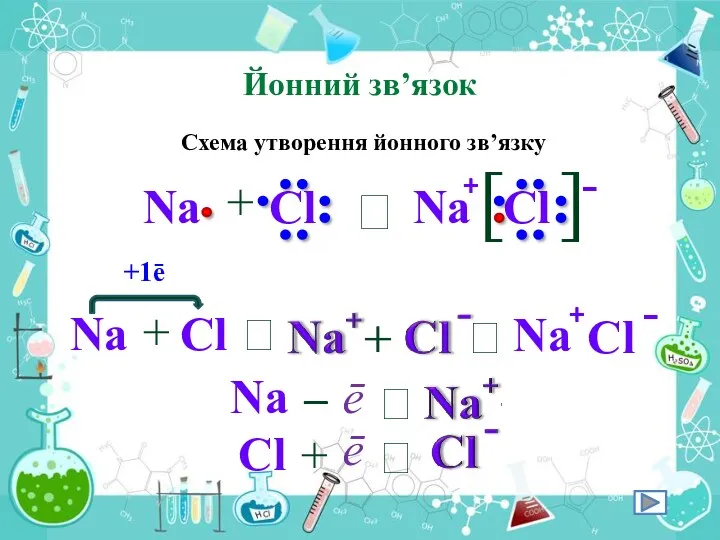
- 18. Йонний зв’язок Схема утворення йонного зв’язку Na + Cl ⭢ + Na Cl [ ] -
- 19. Йонний зв’язок Йони – це заряджені частинки, на які перетворюються атоми і молекули внаслідок приєднання або
- 21. Скачать презентацию









 Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток
Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Рафинирование металлических расплавов
Рафинирование металлических расплавов Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Общая характеристика металлов
Общая характеристика металлов Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері
Алкандар. Метан молекуласының құрылысы Метан және оның гомологтарының қасиеттері Химия сабағындағы өздік жұмыстар
Химия сабағындағы өздік жұмыстар Ископаемые углеводороды
Ископаемые углеводороды Времена алхимиков
Времена алхимиков Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Оксид серы (IV) и серы (VI)
Оксид серы (IV) и серы (VI) Минералы для ИЗБ
Минералы для ИЗБ Химия: классификация химических реакций
Химия: классификация химических реакций Химический элемент углерод
Химический элемент углерод Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Термодинамика химических процессов
Термодинамика химических процессов Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4)
Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4) Осмос. Онкотикалық қысым. Изотоникалық коэффицент. Гипо, гипер изотоникалық ерітінділер
Осмос. Онкотикалық қысым. Изотоникалық коэффицент. Гипо, гипер изотоникалық ерітінділер Химическая кинетика. Тема 2.2
Химическая кинетика. Тема 2.2 Атомы и молекулы. Простые и сложные вещества (8 класс)
Атомы и молекулы. Простые и сложные вещества (8 класс) Растворы. Лекция 7
Растворы. Лекция 7 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Алкадиены (диены)
Алкадиены (диены) Гидролиз солей
Гидролиз солей Галогены
Галогены