Содержание
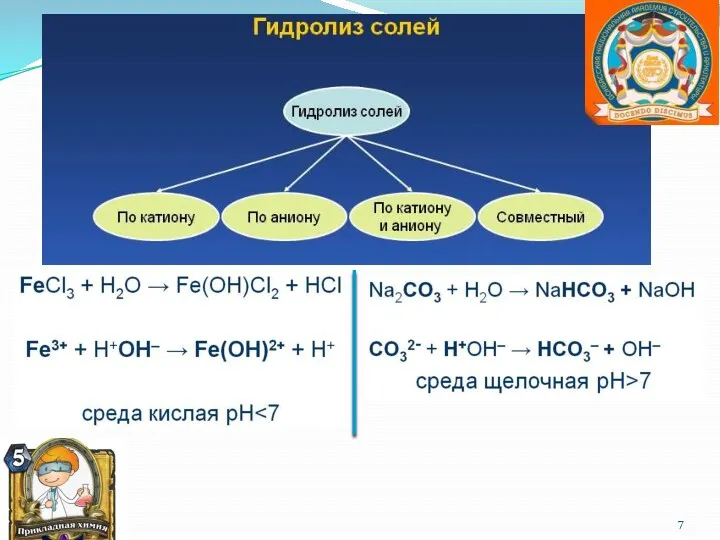
- 6. Гидролиз солей. Гидролиз – это реакция обменного разложения веществ водой. Обратимый процесс
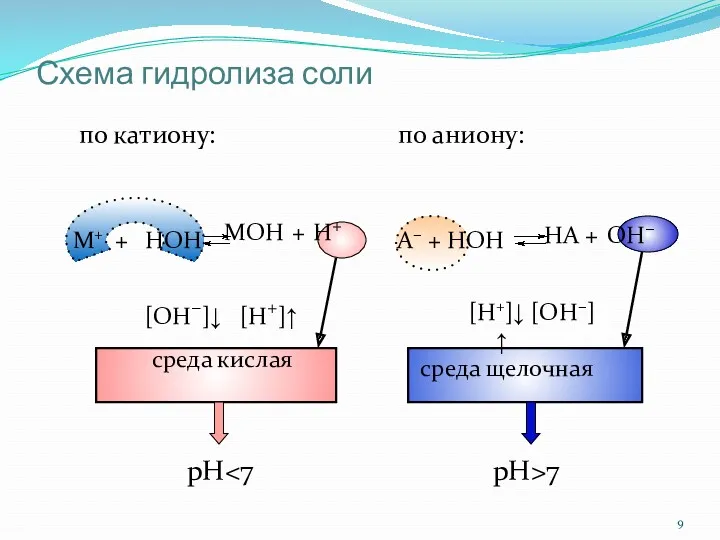
- 9. по аниону: HА + OH− cреда щелочная по катиону: MOH + H+ среда кислая Схема гидролиза
- 13. Соли, образованные слабой кислотой и слабым основанием. Гидролиз по катиону и по аниону. Химическое равновесие смещено
- 14. Гидролиз соли CH3COONH4 Соль образована слабым основанием и слабой одноосновной кислотой CH3COONH4 = NH4+ + CH3COO−
- 15. Гидролиз солей слабых кислот и слабых оснований Соли слабого основания и слабой многоосновной кислоты в растворе
- 17. Гидролиз можно усилить: Добавить воды. Нагреть раствор (увеличится диссоциация воды). Связать один из продуктов гидролиза в
- 18. ФОРМУЛА СОЛИ А) NaNO3 Б) CuF2 В) AlBr3 Г) CH3COONa 1) гидролизуется по катиону 2) гидролизуется
- 19. Необратимый совместный гидролиз - с участием катионов Al3+, Fe3+, Cr3+, NH4+ и анионов проходит с образованием
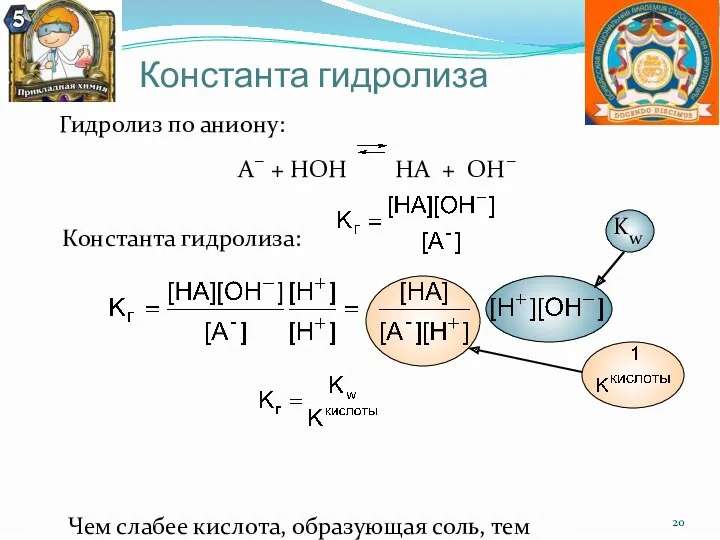
- 20. Константа гидролиза Гидролиз по аниону: А− + НОН НА + ОН− Константа гидролиза: Чем слабее кислота,
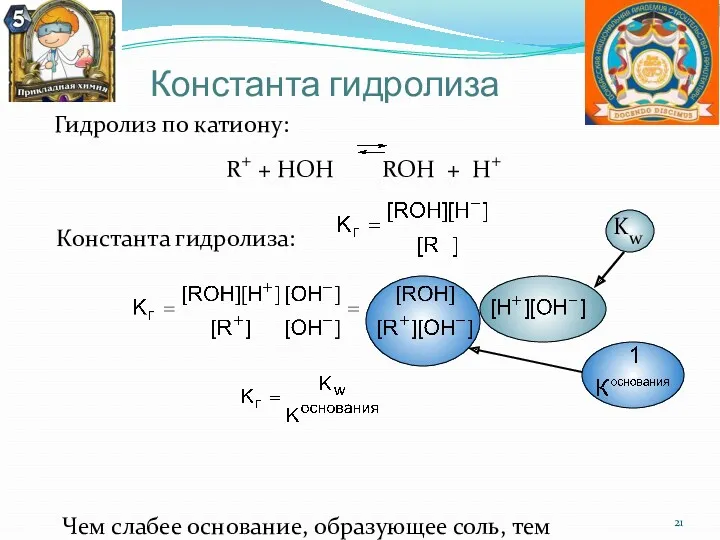
- 21. Константа гидролиза Гидролиз по катиону: R+ + НОН ROН + Н+ Константа гидролиза: Чем слабее основание,
- 22. Степень гидролиза соли - отношение количества вещества (соли), подвергшегося гидролизу, к общему количеству растворенного вещества Размерность
- 23. Ионное уравнение гидролиза СH3COO− + HOH СH3COOH + OH− Степень гидролиза Концентрация ионов Н+ и рН
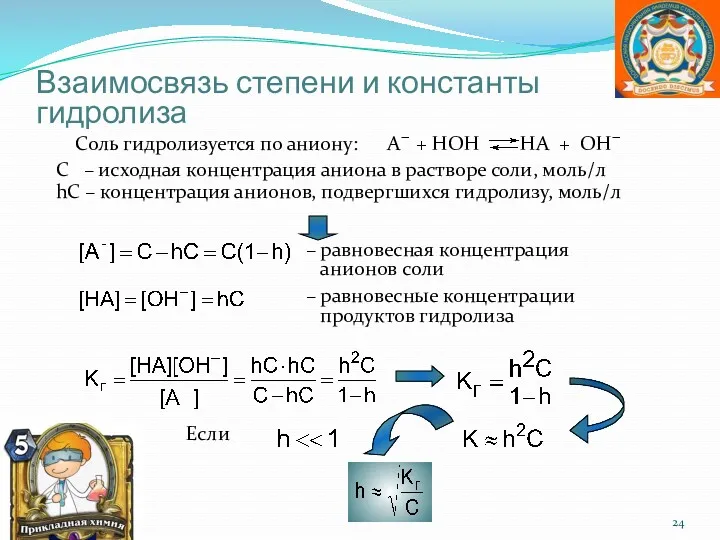
- 24. Взаимосвязь степени и константы гидролиза Соль гидролизуется по аниону: А− + НОН НА + ОН− С
- 26. Смещение равновесия гидролиза Гидролиз по катиону: R++ HOH ROH + H+ Гидролиз по аниону: А− +
- 28. Скачать презентацию



















 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки