Содержание
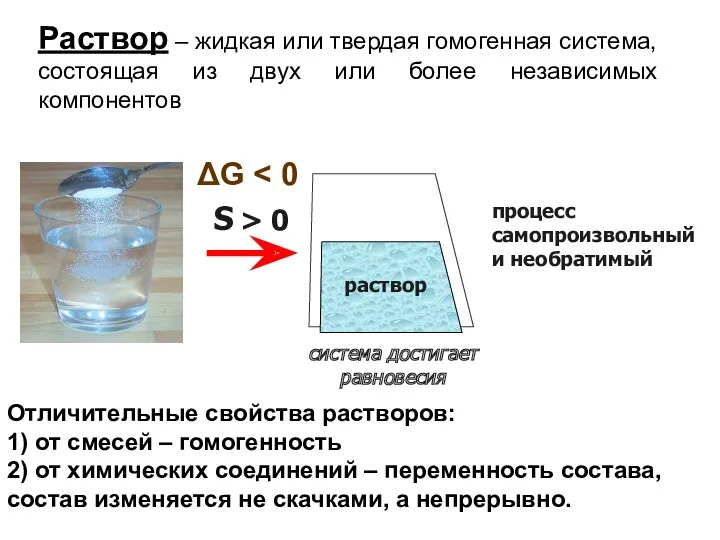
- 2. Раствор – жидкая или твердая гомогенная система, состоящая из двух или более независимых компонентов раствор S
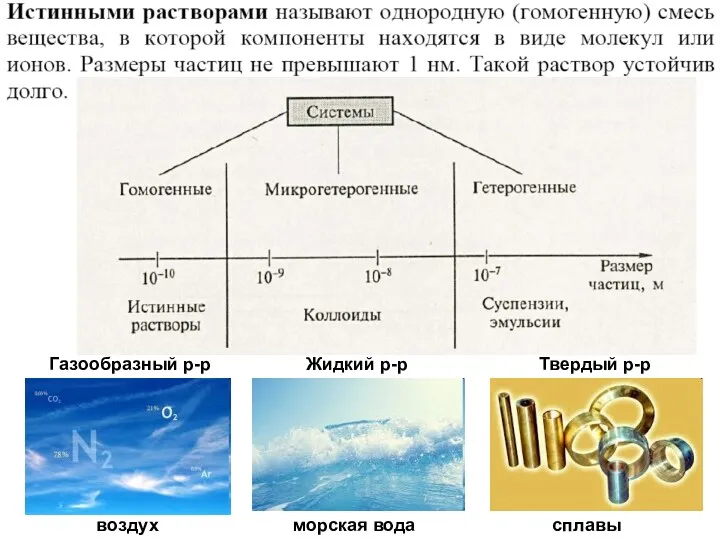
- 3. воздух морская вода сплавы Газообразный р-р Жидкий р-р Твердый р-р
- 4. Раствор = растворитель + растворенное вещество Растворитель – вещество, находящееся в том же агрегатном состоянии ,
- 7. РbI2 в воде КСl в воде ЖИДКИЕ РАСТВОРЫ
- 8. РАСТВОРИМОСТЬ или КОЭФФИЦИЕНТ РАСТВОРИМОСТИ (s) – определяется количеством вещества в граммах, способного растворяться в 100 г
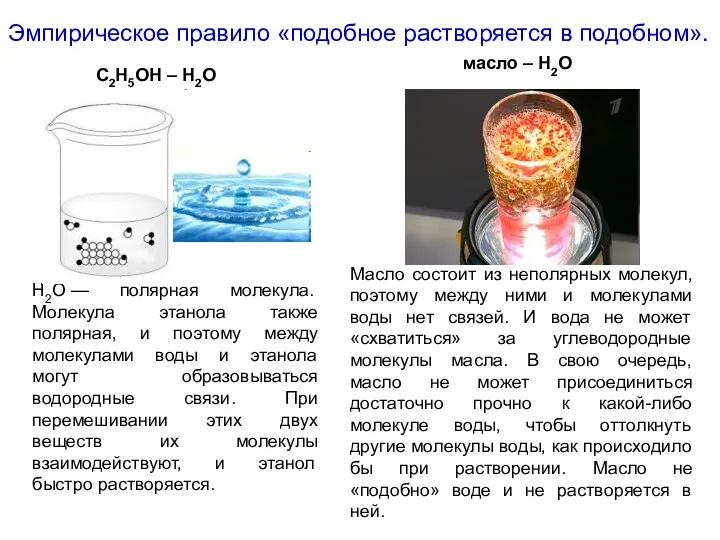
- 9. Растворимость вещества тем выше, чем большим сходством обладают его молекулы с молекулами растворителя: Полярные молекулы веществ
- 10. Масло состоит из неполярных молекул, поэтому между ними и молекулами воды нет связей. И вода не
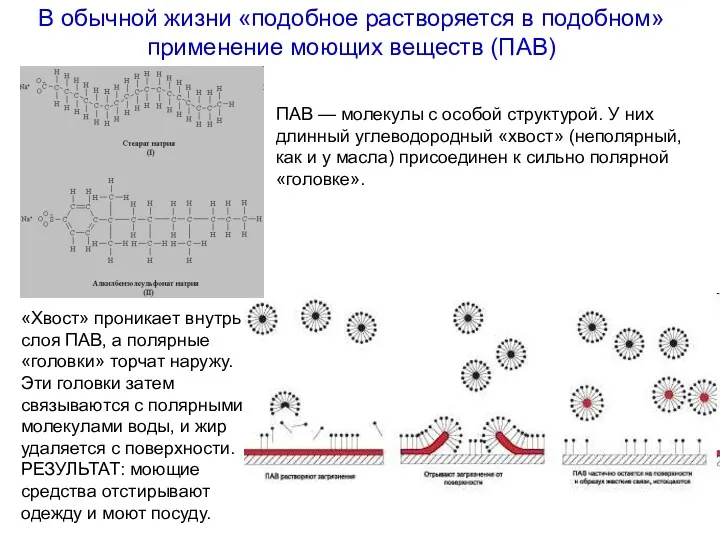
- 11. В обычной жизни «подобное растворяется в подобном» применение моющих веществ (ПАВ) «Хвост» проникает внутрь слоя ПАВ,
- 12. 1.Растворимость жидкостей и твердых веществ обычно увеличивается при повышении температуры, поскольку при этом возрастает энергия движения
- 13. СЛЕДСТВИЕ: при одной и той же температуре Повышение парциального давления газа приводит к поглощению (абсорбции) газа
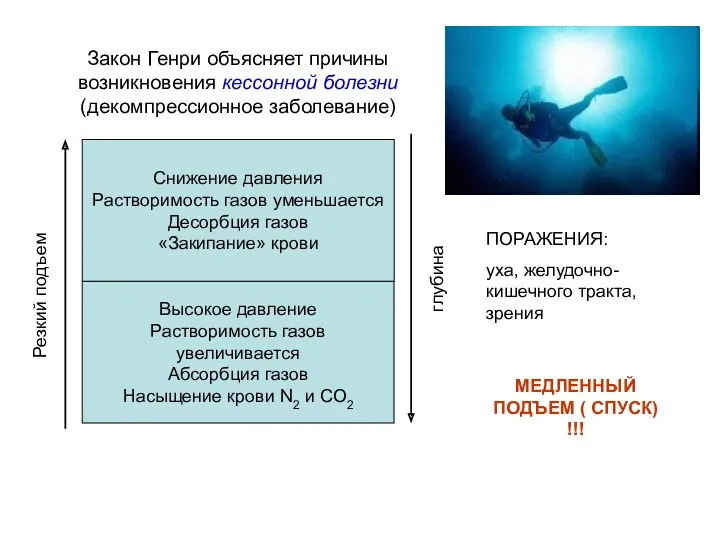
- 14. Закон Генри объясняет причины возникновения кессонной болезни (декомпрессионное заболевание) ПОРАЖЕНИЯ: уха, желудочно-кишечного тракта, зрения МЕДЛЕННЫЙ ПОДЪЕМ
- 15. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ m(X) – масса вещества , г.
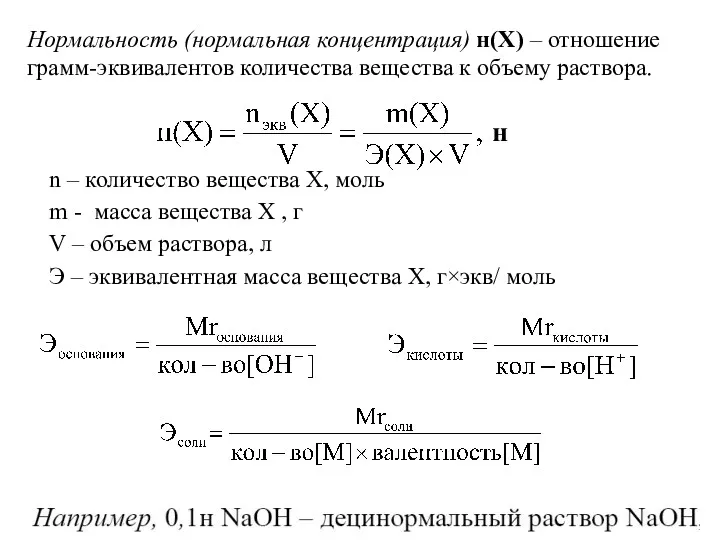
- 17. Нормальность (нормальная концентрация) н(Х) – отношение грамм-эквивалентов количества вещества к объему раствора. н n – количество
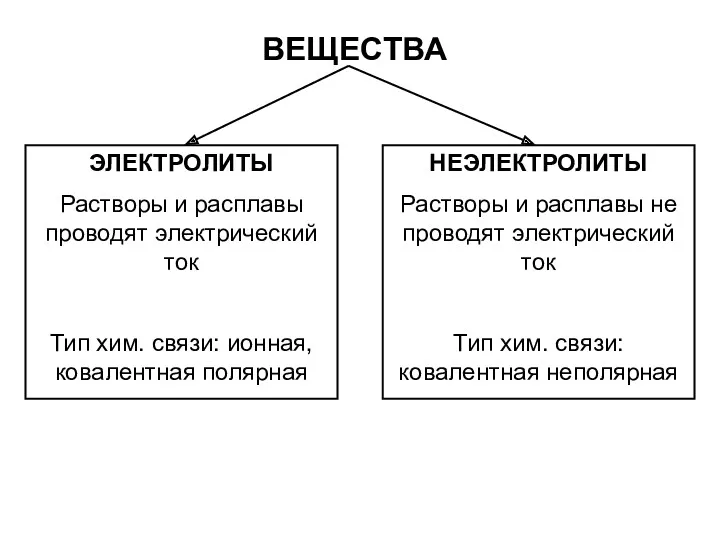
- 19. ВЕЩЕСТВА ЭЛЕКТРОЛИТЫ Растворы и расплавы проводят электрический ток Тип хим. связи: ионная, ковалентная полярная НЕЭЛЕКТРОЛИТЫ Растворы
- 20. РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ
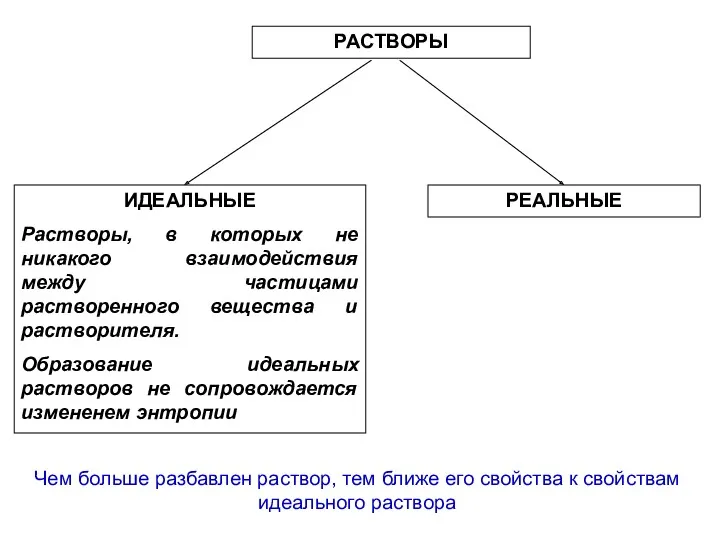
- 21. РАСТВОРЫ ИДЕАЛЬНЫЕ Растворы, в которых не никакого взаимодействия между частицами растворенного вещества и растворителя. Образование идеальных
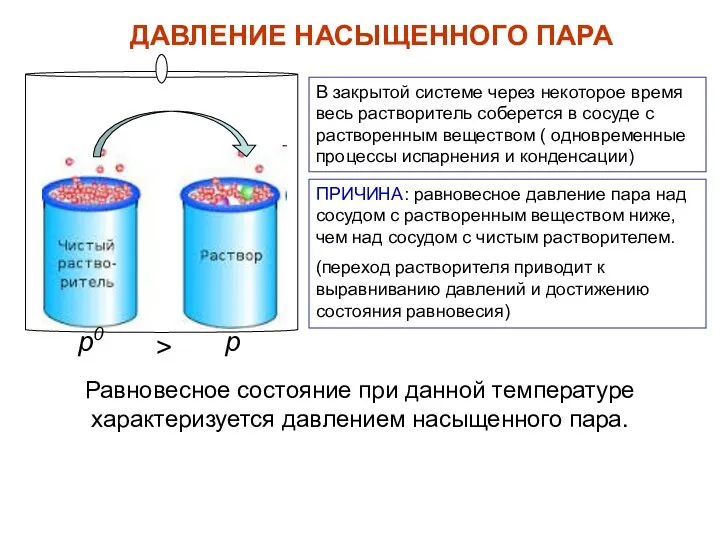
- 22. ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРА р0 р В закрытой системе через некоторое время весь растворитель соберется в сосуде
- 23. Давление насыщенного пара описывается ПЕРВЫМ ЗАКОНОМ Рауля Первый закон Рауля (1882 г.) – относительное понижение давления
- 24. Температура кипения жидкости - это температура, при которой давление насыщенного пара над жидкостью равно внешнему давлению.
- 25. Повышение температуры кипения определяется по ВТОРОМУ ЗАКОНУ Рауля: повышение температуры кипения раствора прямо пропорционально моляльной концентрации
- 26. Температура замерзания жидкости - это температура, при которой давление насыщенного пара над жидкостью равно давлению насыщенного
- 27. понижение температуры замерзания раствора прямо пропорционально моляльной концентрации растворенного вещества, а именно: где К – криоскопическая
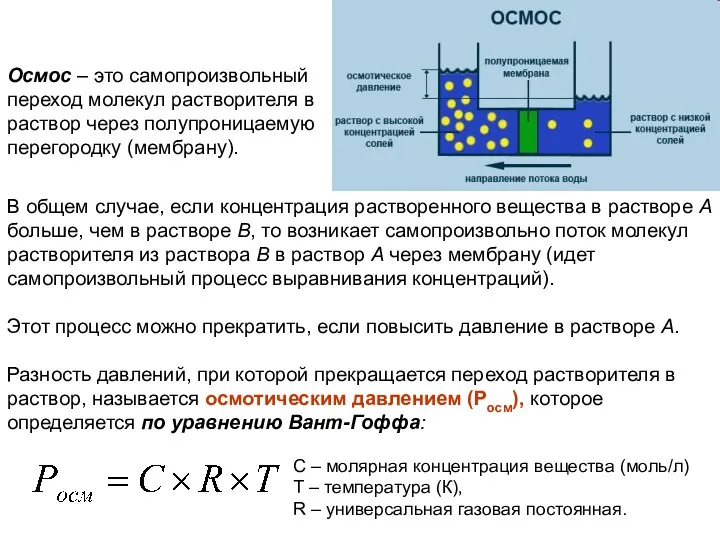
- 28. ОСМОС В емкость налили раствор вещества в растворителе. С течением времени происходит переход растворителя из сосуда
- 29. В общем случае, если концентрация растворенного вещества в растворе А больше, чем в растворе В, то
- 30. РАСТВОРЫ ЭЛЕКТРОЛИТОВ Процесс распада веществ на ионы называется электролитическая диссоциация. В общем виде: КА = К+
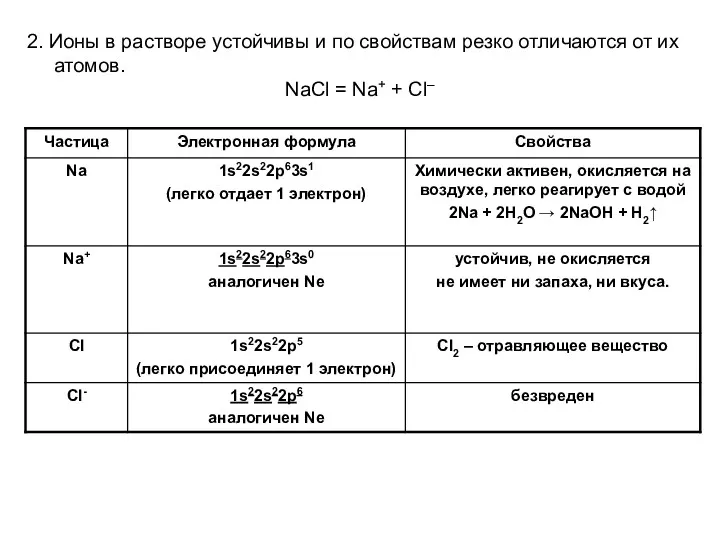
- 31. 2. Ионы в растворе устойчивы и по свойствам резко отличаются от их атомов. NaCl = Na+
- 32. 3. Ионы в растворе перемещаются хаотично. Если в раствор электролита опустить электроды и наложить внешнее электрическое
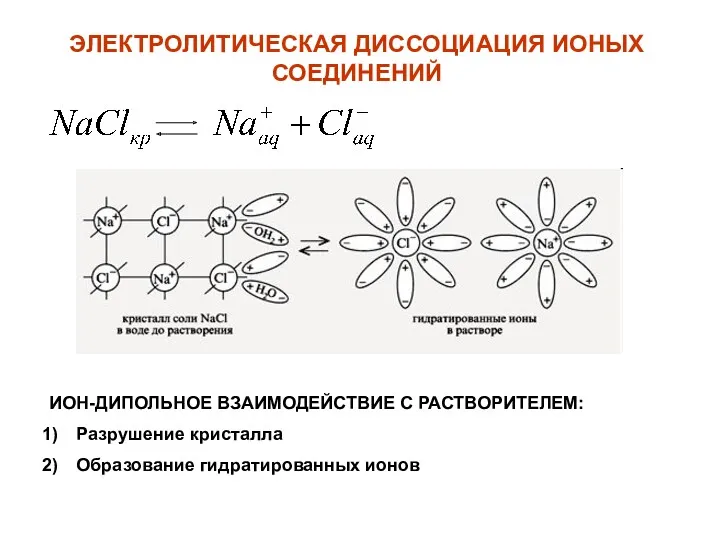
- 34. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ИОНЫХ СОЕДИНЕНИЙ ИОН-ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ С РАСТВОРИТЕЛЕМ: Разрушение кристалла Образование гидратированных ионов
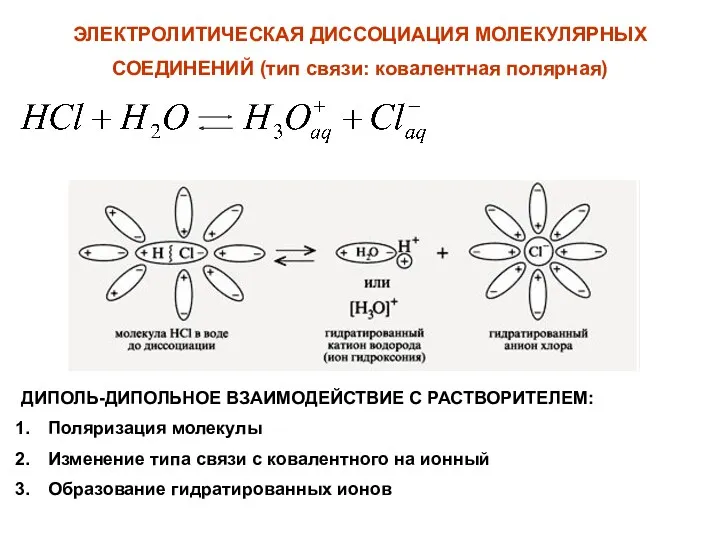
- 35. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ МОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ (тип связи: ковалентная полярная) ДИПОЛЬ-ДИПОЛЬНОЕ ВЗАИМОДЕЙСТВИЕ С РАСТВОРИТЕЛЕМ: Поляризация молекулы Изменение типа
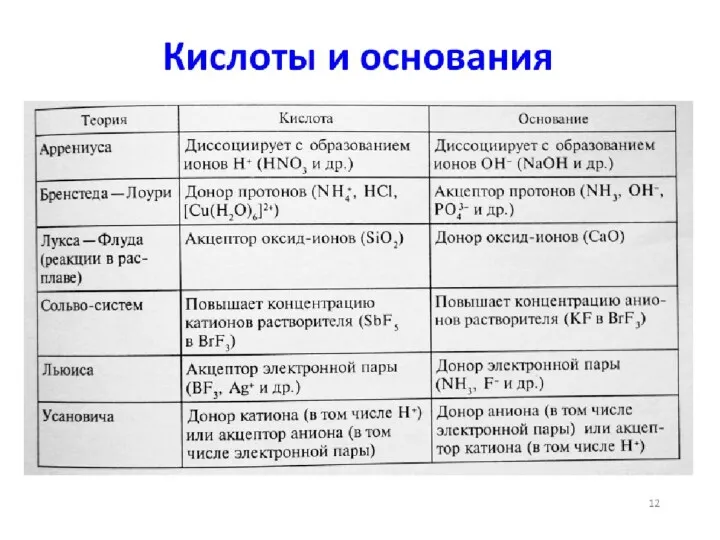
- 36. Характер ионов, образующихся при диссоциации неорганических соединений дает основание для деления соединений на классы
- 37. СТЕПЕНЬ ДИССОЦИАЦИИ Согласно теории Аррениуса, диссоциация электролитов – процесс обратимый, поэтому в растворах электролитов наблюдается равновесие
- 39. ИЗОТОНИЧЕСКИЙ КОЭФФИЦИЕНТ При электролитической диссоциации в растворе увеличивается число частиц растворенного вещества, т.е. увеличивается концентрация частиц:
- 40. КОЛЛИГАТИВНЫЕ СВОЙСТВА растворов электролитов: Для электролитов - α>0, i>1 Для неэлектролитов - α=0, i=1 где k
- 41. В растворах сильных электролитов ɑ ≈30% (ɑ =100% только в разбавленных растворах) ПРИЧИНА: межионные взаимодействия в
- 42. АКТИВНОСТЬ ИОНОВ (а) В сильных электролитах заменяет понятие «концентрация» а – отражает действительное состояние ионов в
- 43. ИОННАЯ СИЛА РАСТВОРА (I) величина, характеризующая силу электростатического взаимодействия ионов в растворе электролита Не зависит от
- 44. КОНСТАНТА ДИССОЦИАЦИИ Константа электролитической диссоциации КД– это константа химического равновесия в растворе электролита КД характеризует способность
- 46. СТУПЕНЧАТАЯ ДИССОЦИАЦИЯ KI > KII > KIII
- 47. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ПОКАЗАТЕЛЬ КОНЦЕНТРАЦИИ ИОНОВ ВОДОРОДА. Вода является очень слабым электролитом. Диссоциация воды протекает условно
- 48. Прологарифмируем уравнение ионного произведения воды: В нейтральном растворе рН = рОН = 7. В щелочной среде
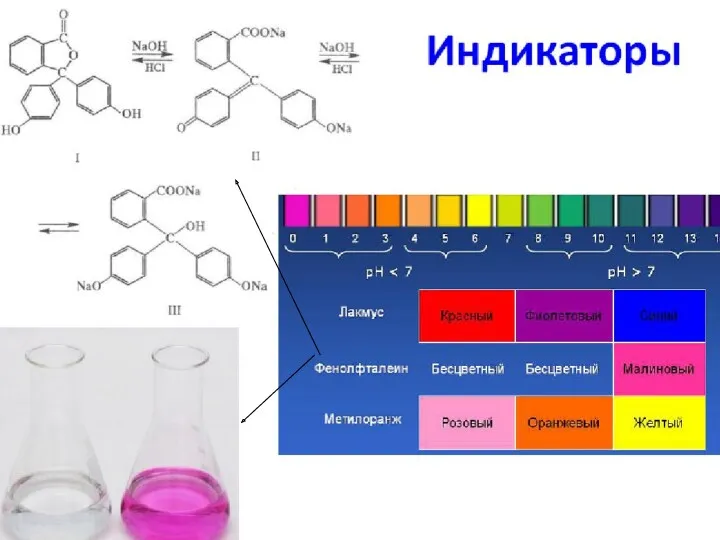
- 50. Слабая кислота+ соль слабой кислоты CH3COOH+CH3COONa Слабое основание и его соль NH4OH + NH4Cl Смесь солей
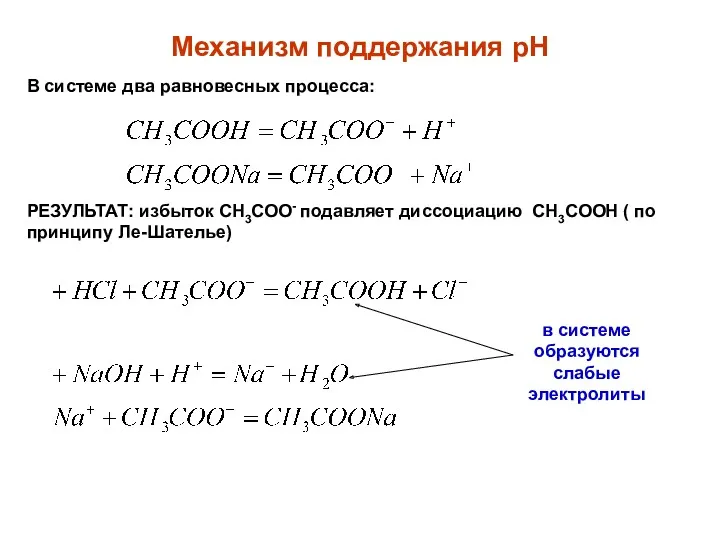
- 51. Механизм поддержания рН В системе два равновесных процесса: РЕЗУЛЬТАТ: избыток CH3COO- подавляет диссоциацию СН3СООН ( по
- 53. ГИДРОЛИЗ взаимодействие соли с водой, в результате, которого образуется молекула или ион слабого электролита и изменяется
- 54. 1. Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются КNО3 + Н2О ≠ 2.
- 55. 3. Соли, в состав которых входит катион слабого основания и анион сильной кислоты гидролизуются по I
- 56. 4. Соли, образованные слабыми основаниями и слабыми кислотами, подвергаются полному гидролизу, реакция водного раствора соли близка
- 57. Гидролиз карбонатов и сульфидов трехвалентных металлов (Fe(III), Al(III)) протекает необратимо:
- 58. Смещение равновесия реакции гидролиза: 1. Ввести в раствор соли кислоту (для связывания ОН-) 2. Ввести в
- 59. СТЕПЕНЬ ГИДРОЛИЗА отношение числа гидролизованных молекул к общему числу молекул в растворе КОНСТАНТА ГИДРОЛИЗА Определяет глубину
- 61. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ СИСТЕМА: насыщенный раствор малорастворимого соединения, находящийся в равновесии с твердой фазой Равновесие характеризует величина
- 63. Скачать презентацию












































 Полимеры. Полимерные материалы
Полимеры. Полимерные материалы Гидролиз солей
Гидролиз солей Атомы химических элементов
Атомы химических элементов Технология производства сложных полиэфиров
Технология производства сложных полиэфиров Каучук и резина
Каучук и резина Окислительно - восстановительные реакции (ОВР) (часть 1)
Окислительно - восстановительные реакции (ОВР) (часть 1) Углеводороды из Башкортостана
Углеводороды из Башкортостана Білки (протеїни)
Білки (протеїни) Р-элементы IV А группы. Углерод и кремний
Р-элементы IV А группы. Углерод и кремний Неорганические вяжущие вещества. (Лекция 6)
Неорганические вяжущие вещества. (Лекция 6) Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Теоретические основы получения полимеров
Теоретические основы получения полимеров Именные реакции в органической химии
Именные реакции в органической химии Низкомолекулярные компоненты сыворотки крови
Низкомолекулярные компоненты сыворотки крови Алканы. Гомологи
Алканы. Гомологи Чипсы: польза или вред. Химия
Чипсы: польза или вред. Химия Получение Н2, О2, щелочей
Получение Н2, О2, щелочей Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса
Растворы. Вычисление массовой доли растворенного вещества в растворе. Урок для 8-го класса Металлы
Металлы Хімічний елемент Літій
Хімічний елемент Літій Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Окислительно-восстановительные реакции. Готовимся к ЕГЭ
Окислительно-восстановительные реакции. Готовимся к ЕГЭ Компоненты, попадающие в продукты питания из минеральных и других удобрений
Компоненты, попадающие в продукты питания из минеральных и других удобрений Пегматитовые месторождения
Пегматитовые месторождения Особая роль углерода в наномире
Особая роль углерода в наномире Ерітіндіден заттарды бөлу әдістері
Ерітіндіден заттарды бөлу әдістері Карбонильные соединения
Карбонильные соединения Неделя химии в МБОУ Андреевская ООШ
Неделя химии в МБОУ Андреевская ООШ