Содержание
- 2. Важнейшие понятия темы «ОВР» степень окисления окисление восстановление окислитель восстановитель электронный баланс
- 3. Правила для определения степеней окисления атомов Металлы во всех сложных соединениях имеют только положительные степени окисления
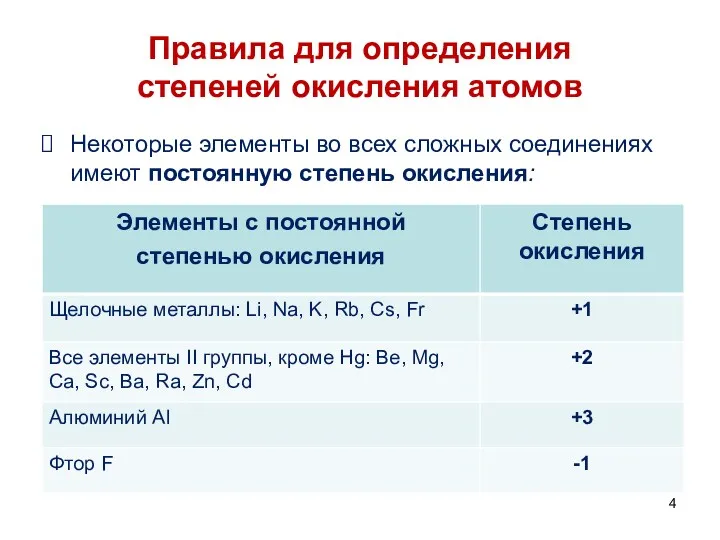
- 4. Правила для определения степеней окисления атомов Некоторые элементы во всех сложных соединениях имеют постоянную степень окисления:
- 5. Правила для определения степеней окисления атомов Водород и кислород в большинстве сложных соединений имеют постоянные степени
- 6. Правила для определения степеней окисления атомов Все остальные элементы имеют в сложных соединениях переменные степени окисления
- 7. Важнейшие окислители и восстановители N-3: NH3 и его производные S-2: H2S и сульфиды Cl-1, Br-1, I-1:
- 8. Важнейшие окислители
- 9. Важнейшие окислители
- 10. Важнейшие окислители
- 11. Важнейшие окислители
- 12. Важнейшие окислители
- 13. Важнейшие окислители с активными металлами (Zn, Mg, Al, Ca и др.) образуется свободная сера S или
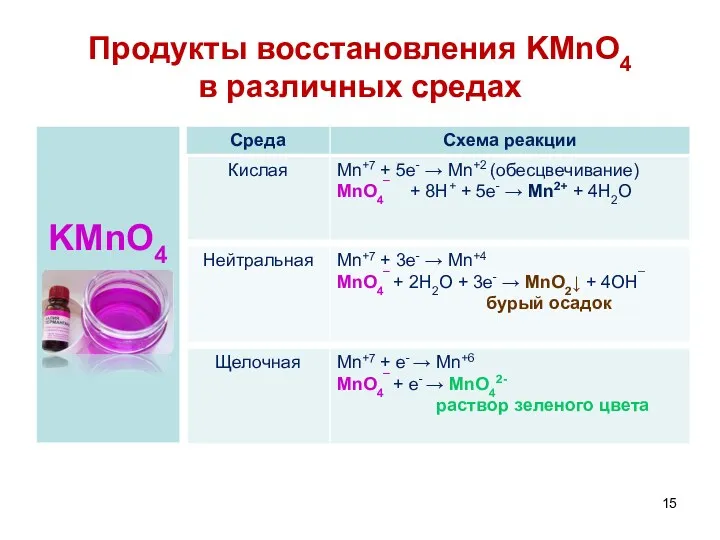
- 14. Важнейшие окислители В нейтральной или слабощелочной среде KMnO4 и K2MnO4 восстанавливаются до MnO2 (бурый осадок): 2KMnO4
- 15. Продукты восстановления KMnO4 в различных средах
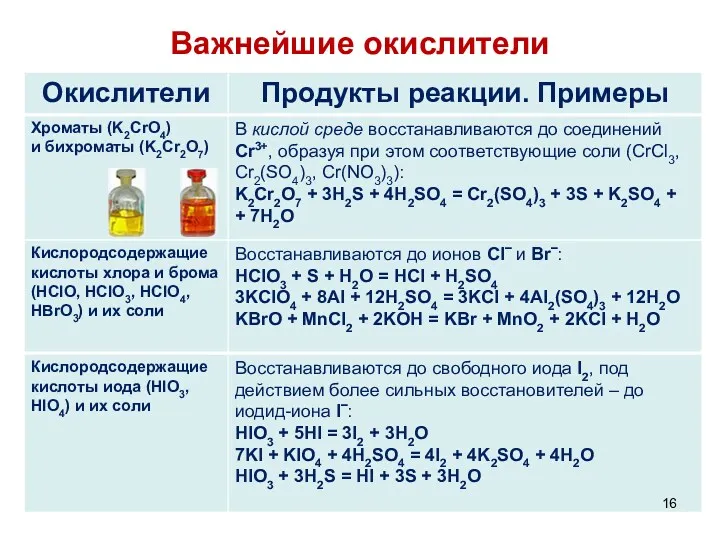
- 16. Важнейшие окислители
- 17. Важнейшие окислители
- 18. Важнейшие восстановители
- 19. Важнейшие восстановители
- 20. Важнейшие восстановители
- 21. Важнейшие восстановители
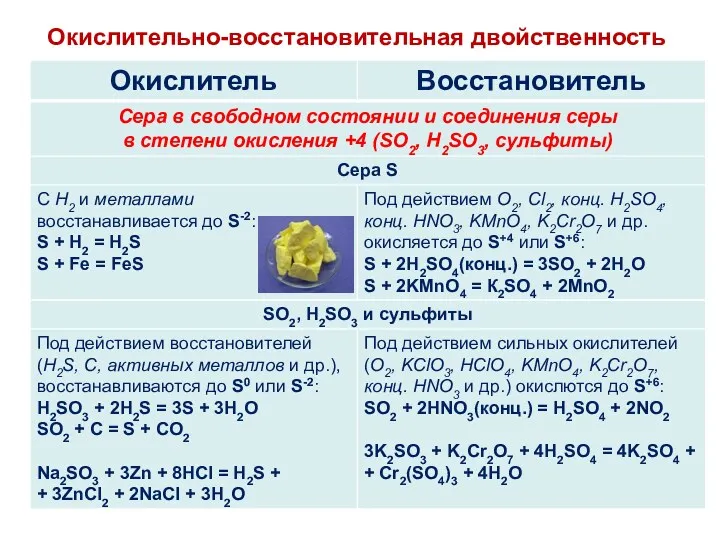
- 22. Окислительно-восстановительная двойственность
- 23. Окислительно-восстановительная двойственность
- 24. Окислительно-восстановительная двойственность
- 25. Типы ОВР
- 26. Типы ОВР Cера S при нагревании диспропорционирует в растворах щелочей с образованием сульфита и сульфида: 3S
- 28. Скачать презентацию





















 Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева
Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева Общая характеристика неметаллов
Общая характеристика неметаллов Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Вода – основа жизни на Земле
Вода – основа жизни на Земле Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії Азот
Азот Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии Соли. Названия солей
Соли. Названия солей Пиролиз углеводородов
Пиролиз углеводородов Минерал чароит. Месторождения
Минерал чароит. Месторождения Магний (Mg)
Магний (Mg) Жоғары молекулалық қосылыстар химиясы
Жоғары молекулалық қосылыстар химиясы Углеводы (сахариды)
Углеводы (сахариды) α-Аминокислоты. Белки
α-Аминокислоты. Белки Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс
Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс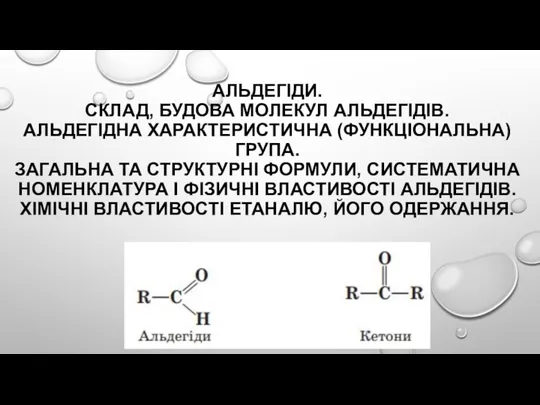 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Химическая кинетика. Раздел 2
Химическая кинетика. Раздел 2 Химические свойства солей
Химические свойства солей Органикалық заттардың ерекшелігі
Органикалық заттардың ерекшелігі Характеристика элементов VIIA-группы (галогены)
Характеристика элементов VIIA-группы (галогены) Соединения водорода
Соединения водорода Кристаллохимия негіздері
Кристаллохимия негіздері Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5)