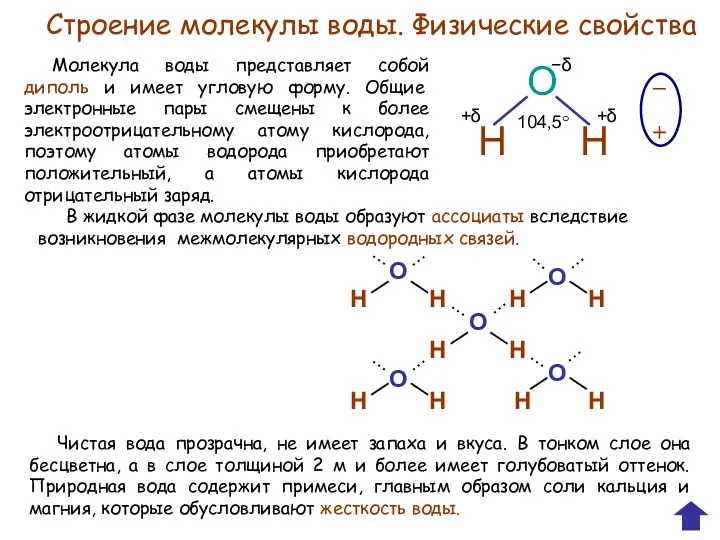
Пероксид водорода
Пероксид водорода – это бесцветная жидкость, представляет собой, так же
как и вода, соединение водорода с кислородом Н2О2
Определите степень окисления и валентность кислорода, водорода:
Н+1 ─ О−1 ─ О−1 ─ Н+1
Степень окисления кислорода −1, валентность II
Степень окисления водорода +1, валентность I
На свету и под действием катализаторов (MnO2) легко разлагается (при нагревании - со взрывом):
2H2O2 = 2H2O + O2
В воде пероксид растворяется неограниченно, его водные растворы более устойчивы. В виде таких растворов пероксиды поступают в продажу: аптечный 3%-ный раствор. Для других целей используют пергидроль – 30%-ный раствор Н2О2.
Применяется пероксид водорода для отбеливания текстильных материалов и бумаги, в парикмахерском деле, в медицине, как окислитель в ракетном топливе, при получении глицерина.







 Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 1) Способи очищення води
Способи очищення води Составление формул молекулярных простых веществ
Составление формул молекулярных простых веществ Обмен жиров
Обмен жиров Молярный объем газов
Молярный объем газов Л3. Учение о растворах (Химия)
Л3. Учение о растворах (Химия) Происхождение нефти
Происхождение нефти Titration and Acid-Base Neutralization
Titration and Acid-Base Neutralization Металлы
Металлы Окисление и восстановление
Окисление и восстановление Хімічні властивості кислот
Хімічні властивості кислот Щелочи
Щелочи Карбоновые кислоты
Карбоновые кислоты Химические источники тока. Электролиз
Химические источники тока. Электролиз Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Реактор получения элементарной серы
Реактор получения элементарной серы Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Неорганические соединения. Основания
Неорганические соединения. Основания Ионные уравнения реакции
Ионные уравнения реакции Изомерия. Виды изомерии
Изомерия. Виды изомерии Предмет и история геохимии
Предмет и история геохимии Коллигативные свойства растворов
Коллигативные свойства растворов Основные положения теории растворов электролитов, используемых в аналитической химии
Основные положения теории растворов электролитов, используемых в аналитической химии Кислоты и их свойства
Кислоты и их свойства Основания
Основания Мыла и синтетические моющие срдства
Мыла и синтетические моющие срдства Гидролиз солей
Гидролиз солей