Содержание
- 2. Электролитическая диссоциация (С. Аррениус, 1887 г.) - процесс распада электролита в водном растворе (или расплаве) на
- 3. Сила кислот (по степени диссоциации) HCl H2SO4 → HNO3 → H2SO3 → H2CO3 → CH3COOH →
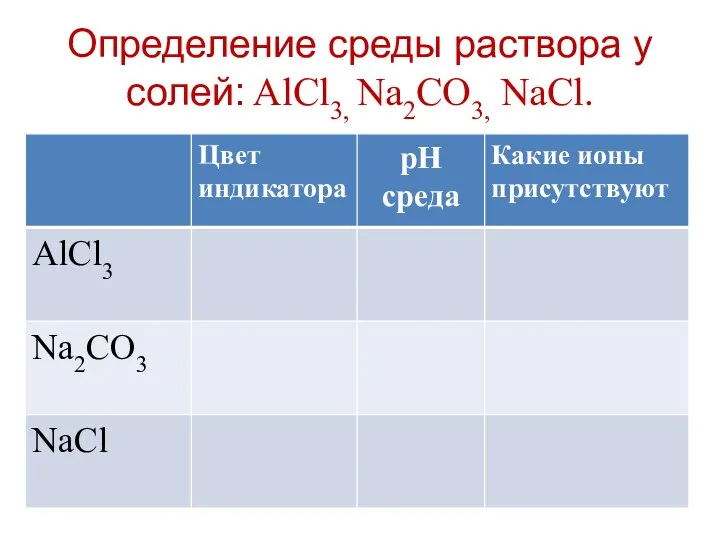
- 4. Определение среды раствора у солей: AlCl3, Na2CO3, NaCl.
- 5. Определение среды раствора у солей: AlCl3, Na2CO3, NaCl.
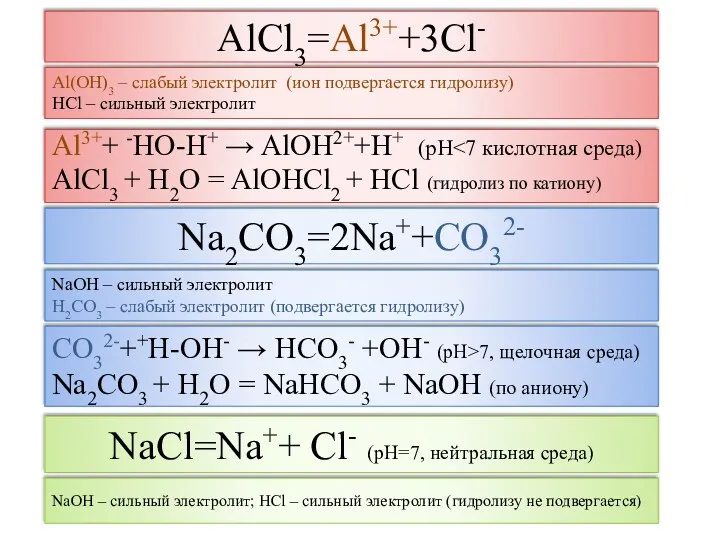
- 6. AlCl3=Al3++3Cl- Al3++ -HO-H+ → AlOH2++H+ (рН AlCl3 + H2O = AlOHCl2 + HCl (гидролиз по катиону)
- 7. Алгоритм составления ионного и молекулярного уравнения гидролиза соли 1. Составляем уравнение электролитической диссоциации соли. 2. Определяем
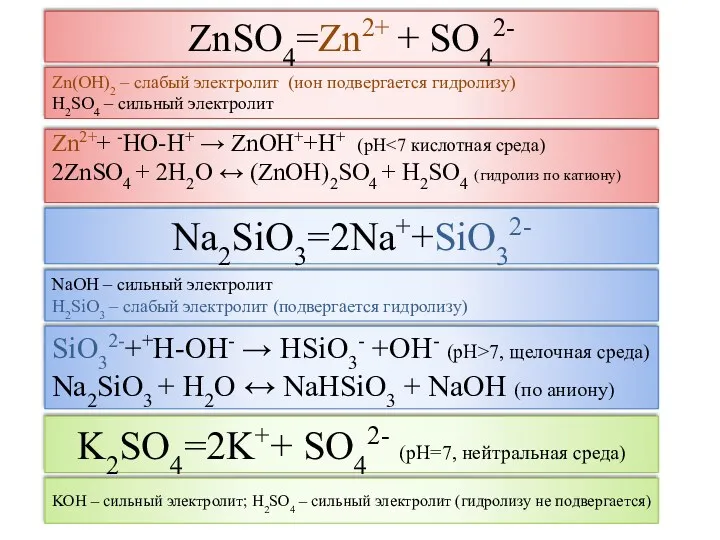
- 8. ZnSO4=Zn2+ + SO42- Zn2++ -HO-H+ → ZnOH++H+ (рН 2ZnSO4 + 2H2O ↔ (ZnOH)2SO4 + H2SO4 (гидролиз
- 9. Что происходит в водных растворах с солями, образованными и слабыми основаниями и слабыми кислотами? Они подвергаются
- 10. Взаимодействие хлорида железа (+3) с карбонатом натрия
- 11. Взаимодействие хлорида железа (+3) с карбонатом натрия 2FeCl3 + 3Na2CO3 = Fe2(CO3)3 + 6NaCl Не правильно,
- 12. Гидролиз –это реакция обмена между некоторыми солями и водой, приводящая к образованию электролита.
- 13. Значение гидролиза С древности – зола – моющее средство (в состав входит поташ – карбонат калия
- 14. Выводы: Гидролиз – процесс взаимодействия ионов соли с ионами воды с изменением рН среды. Обязательное условие
- 15. Дом.задание: выучить теорию и ответить на вопрос: Возможна ли реакция между цинком и хлоридом цинка?
- 17. Скачать презентацию











 Карбоновые кислоты
Карбоновые кислоты Сульфиды. Занятие 7
Сульфиды. Занятие 7 Свойства смесей ПАВ
Свойства смесей ПАВ Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин
Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены
Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод
Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод Типичные реакции органических соединений
Типичные реакции органических соединений Типы химических реакций
Типы химических реакций Лужні метали
Лужні метали Галогенопроизводные углеводородов
Галогенопроизводные углеводородов Методы исследования взаимодействий с участием белков (Co-IP, equilibrium microdialysis, ITC, MST, SPR, BLI, QСM)
Методы исследования взаимодействий с участием белков (Co-IP, equilibrium microdialysis, ITC, MST, SPR, BLI, QСM) Магматические формации
Магматические формации Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Основные понятия химии. Законы стехиометрии
Основные понятия химии. Законы стехиометрии Азотистая кислота
Азотистая кислота Химические волокна
Химические волокна Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Углерод и его соединения
Углерод и его соединения Икаит Ca[CO3]·6 (H2O)
Икаит Ca[CO3]·6 (H2O) Чистые вещества и смеси. Растворы
Чистые вещества и смеси. Растворы Подземное хранение газа и жидкости
Подземное хранение газа и жидкости Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Геохимия
Геохимия