Содержание
- 2. Основания являются одним из классом неорганических веществ: соли, кислоты, основания, оксиды. Главное отличие этого класса неорганических
- 3. Классификация оснований
- 4. Получение оснований Взаимодействие основных оксидов с водой. основный оксид + вода = основание Например, Na2O +
- 5. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных
- 6. При обычных условиях основания (гидроксиды металлов) являются твёрдыми кристаллическими веществами. Нелетучи и не имеют запаха. Физические
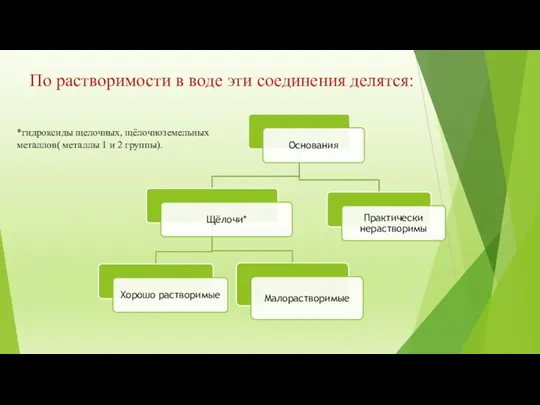
- 7. По растворимости в воде эти соединения делятся: *гидроксиды щелочных, щёлочноземельных металлов( металлы 1 и 2 группы).
- 8. 1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом
- 9. Общие химические свойства щелочей: Изменяют окраску индикатора
- 10. Взаимодействуют с кислотными оксидами Щёлочь + Кислотный оксид = Соль + Вода -реакция обмена: 2KOH +
- 12. Скачать презентацию








 О проекте концепции преподавания химии в РФ
О проекте концепции преподавания химии в РФ Способы выражения состава растворов
Способы выражения состава растворов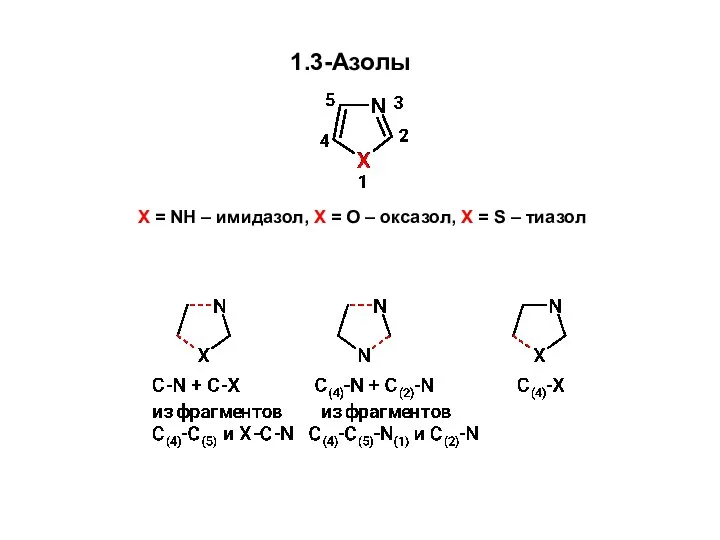 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Характеристика элемента по его положению в периодической системе химических элементов (1)
Характеристика элемента по его положению в периодической системе химических элементов (1) Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Оксиды и гидроксиды
Оксиды и гидроксиды Органическая химия – химия соединений углерода
Органическая химия – химия соединений углерода Алкани
Алкани Углеводы. Урок №9. 9 класс
Углеводы. Урок №9. 9 класс Протекание ОВР зависит от рН среды
Протекание ОВР зависит от рН среды Кривые титрования: построение и анализ (лекция 6)
Кривые титрования: построение и анализ (лекция 6) Основные и опасные свойства природного газа
Основные и опасные свойства природного газа Литий. Общая характеристика элементов подгруппы 1А
Литий. Общая характеристика элементов подгруппы 1А Строение атома. Периодический закон Д. И. Менделеева
Строение атома. Периодический закон Д. И. Менделеева Химические фундаментные болты
Химические фундаментные болты Характер затвердевания
Характер затвердевания Понятие Химический элемент
Понятие Химический элемент Хімічний зв'язок і будова речовини
Хімічний зв'язок і будова речовини Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9)
Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9) Кристаллохимия негіздері
Кристаллохимия негіздері Алюминий и его свойства
Алюминий и его свойства Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Глины каолиновые и каолино-гидрослюдистые
Глины каолиновые и каолино-гидрослюдистые Сульфур. Характеристика елемента та утворених ним сполук, кругообіг елемента в природі
Сульфур. Характеристика елемента та утворених ним сполук, кругообіг елемента в природі Единство химической организации живых организмов
Единство химической организации живых организмов Альдегиды и кетоны
Альдегиды и кетоны Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии