Содержание
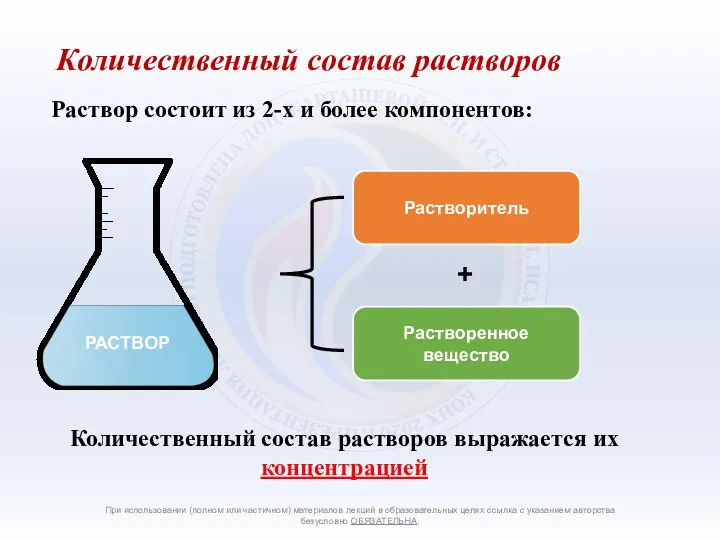
- 2. Количественный состав растворов выражается их концентрацией Количественный состав растворов При использовании (полном или частичном) материалов лекций
- 3. Концентрация Содержание определенной порции вещества в растворе или в растворителе называется концентрацией. При использовании (полном или
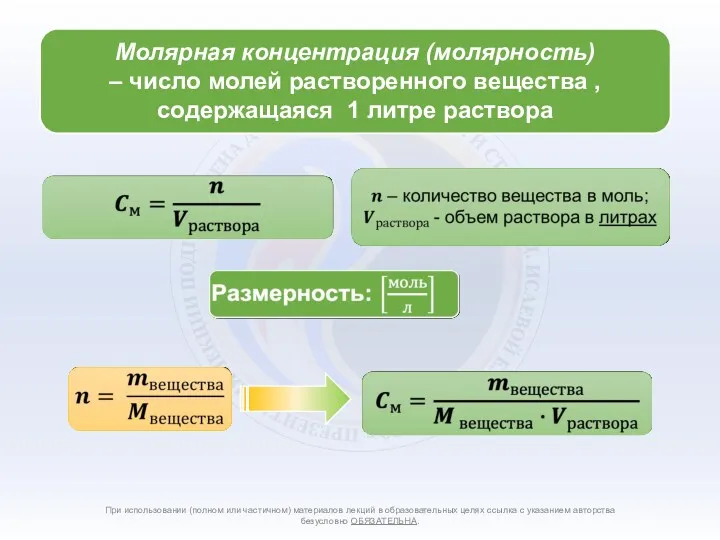
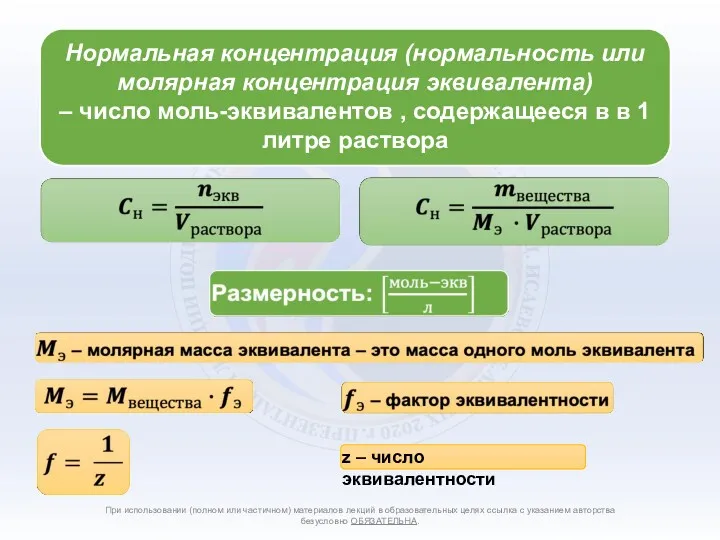
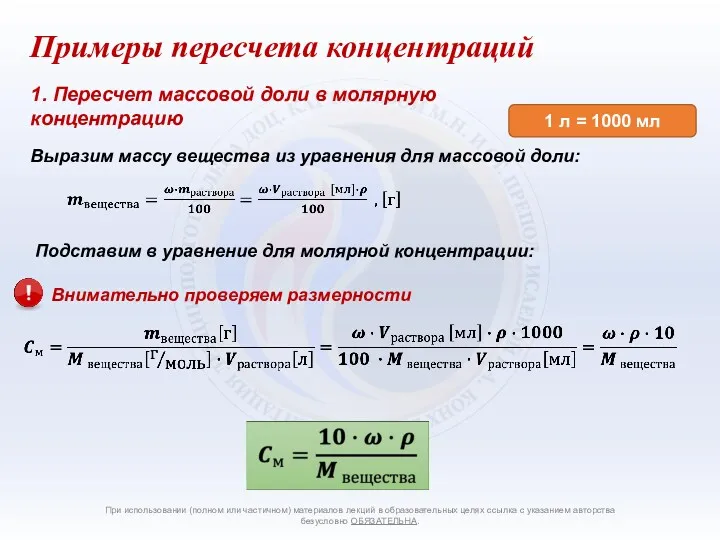
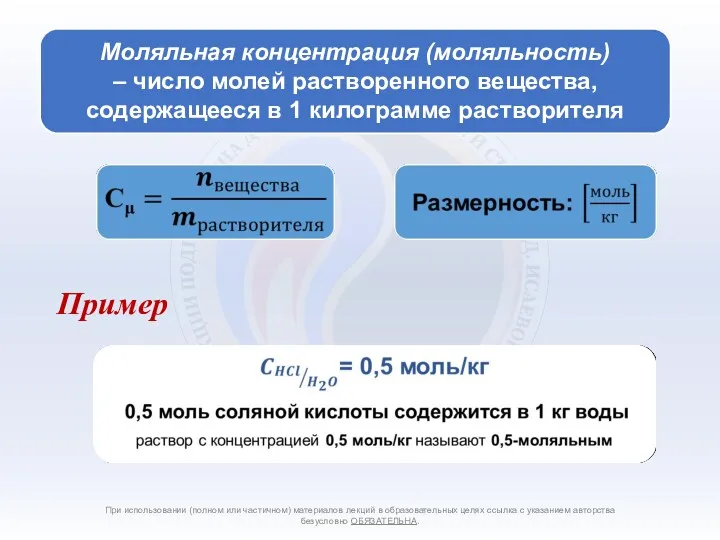
- 4. Способы количественного выражения состава растворов При использовании (полном или частичном) материалов лекций в образовательных целях ссылка
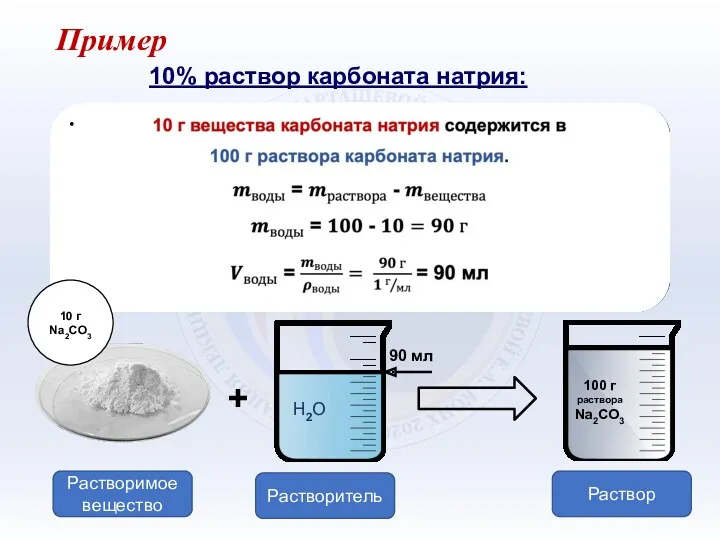
- 5. 10% раствор карбоната натрия: Пример Растворимое вещество Растворитель Раствор 10 г Na2CO3 Н2О 90 мл +
- 6. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 7. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 8. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 9. Объем и масса раствора связаны через плотность: При использовании (полном или частичном) материалов лекций в образовательных
- 10. АРЕОМЕТР - это прибор в виде стеклянного поплавка с измерительной шкалой и грузом (внизу). Ареометр представляет
- 11. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 12. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 13. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 14. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 15. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 16. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 17. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 18. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
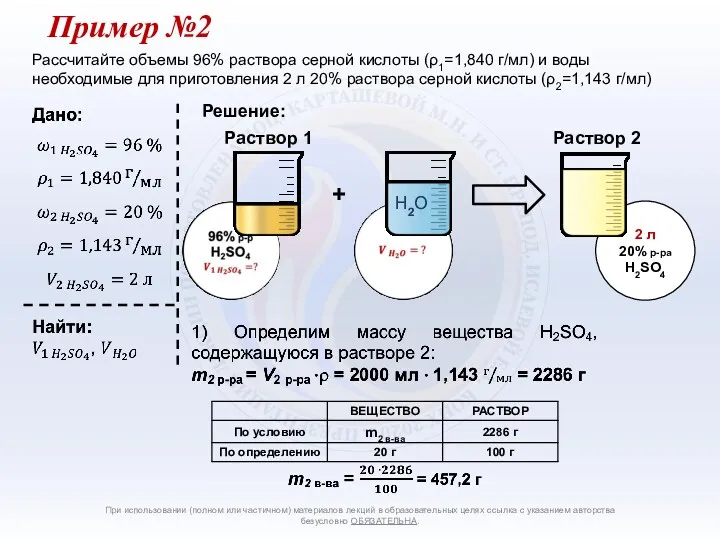
- 19. продолжение m1 в-ва = m2 в-ва 2) Определим массу раствора 1, содержащего 457,2 г вещества серной
- 20. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 21. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 22. Пример №4 Решение: Ответ: масса кристаллогидрата 135 г, объём воды 948,5 мл Рассчитайте объем воды и
- 23. 0,2 л 30% р-р NaOH При использовании (полном или частичном) материалов лекций в образовательных целях ссылка
- 24. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 25. Пример №6 Решение: Рассчитайте объемы 2М и 6М растворов соляной кислоты необходимые для приготовления 500 мл
- 26. При использовании (полном или частичном) материалов лекций в образовательных целях ссылка с указанием авторства безусловно ОБЯЗАТЕЛЬНА.
- 28. Скачать презентацию


















 Чистые вещества и смеси
Чистые вещества и смеси Щелочи
Щелочи Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Дисперсные системы
Дисперсные системы Морфология тел полезных ископаемых
Морфология тел полезных ископаемых λ-MnO2 as material with pseudocapacitive properties
λ-MnO2 as material with pseudocapacitive properties Происхождение названий минералов
Происхождение названий минералов Химия вокруг нас
Химия вокруг нас Углерод и его свойства
Углерод и его свойства Химиялық реакция белгілерін атаңыз
Химиялық реакция белгілерін атаңыз Металдардыњ механикалыќ ќасиеттері-алюминий
Металдардыњ механикалыќ ќасиеттері-алюминий Взаємодія кисню зі складними та простими речовинами. Урок 31. 7 клас
Взаємодія кисню зі складними та простими речовинами. Урок 31. 7 клас Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть
Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть Кристаллические решетки
Кристаллические решетки Попутные нефтяные газы
Попутные нефтяные газы А.М. Бутлеровтың химиялык кұрылыс теориясы
А.М. Бутлеровтың химиялык кұрылыс теориясы Лабораторная №5. Карбоновые кислоты
Лабораторная №5. Карбоновые кислоты Соли, их классификация и свойства
Соли, их классификация и свойства Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Кислоты. 8 класс
Кислоты. 8 класс Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Обмен липидов
Обмен липидов Многоатомные спирты (10 класс)
Многоатомные спирты (10 класс) Открытие хлора
Открытие хлора Кислородные соединения азота
Кислородные соединения азота Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов