Содержание
- 2. Цель : сформировать представления о свойствах углерода, уметь составлять схемы строения атома, аллотропии и его биологической
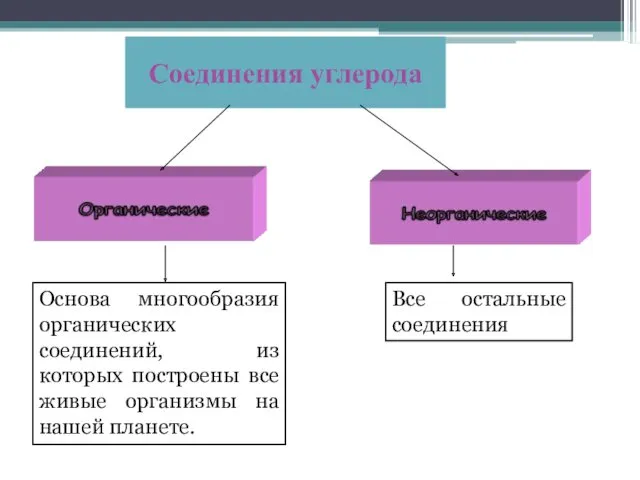
- 3. Соединения углерода Основа многообразия органических соединений, из которых построены все живые организмы на нашей планете. Все
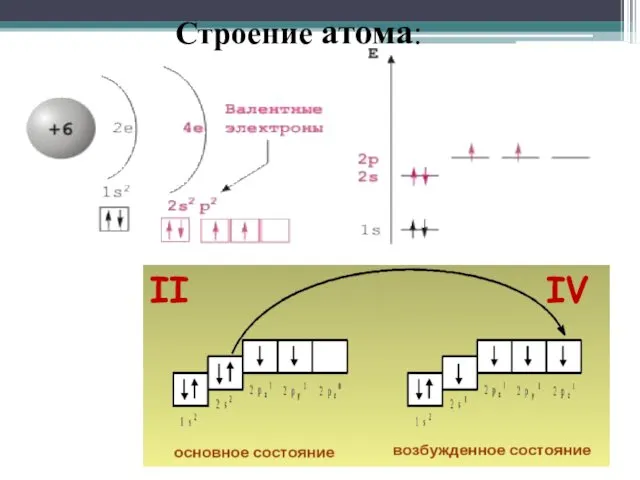
- 4. Строение атома Углерод (Carboneum-рождающий уголь) Химический элемент IV группы периодической системы Менделеева-неметалл Атомный номер 6 На
- 5. Строение атома: II IV
- 6. Степени окисления атома углерода в соединениях: -4 (SiC, CH4, Al4C3) +2 (CO) +4 (CO2 , CCl4
- 7. Нахождение углерода в природе. 11 место по распространенности в природе. 4 место на Солнце ( Н2,
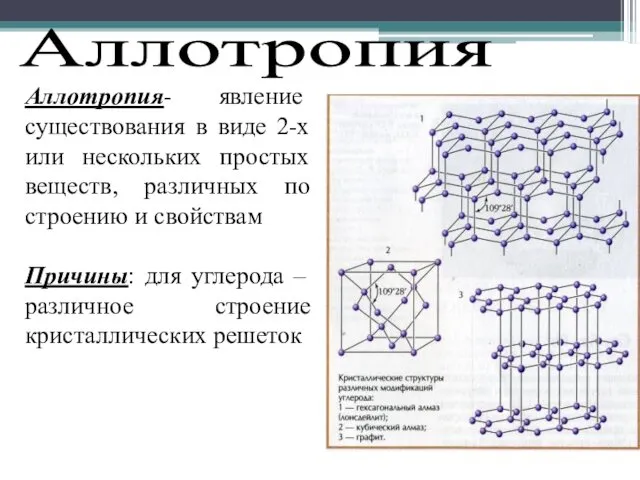
- 8. АЛЛОТРОПИЯ - способность атомов одного химического элемента образовывать несколько простых веществ. ?
- 9. Аллотропия Аллотропия- явление существования в виде 2-х или нескольких простых веществ, различных по строению и свойствам
- 10. Простое вещество углерод. Аллотропные модификации углерода: алмаз графит лонсдейлит карбин фуллерены графен
- 11. Алмаз (adamas – непреклонный, твердый) кристаллическая решетка – атомная; каждый атом находится в вершинах тетраэдра; прозрачный,
- 12. Алмаз – бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ, но
- 13. Графит (grapho – пишу) кристаллическая решетка - атомная серо-черная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая
- 14. Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск, кажется
- 15. Взаимные превращения аллотропных модификаций углерода. уголь ⭢ графит (2600˚С, давление⭡) графит ⭢ алмаз (1200МПа, 1500˚С) алмаз
- 16. Карбин мелкокристаллический порошок черного цвета; по твердости между алмазом и графитом; длинные цепочки атомов углерода, уложенные
- 17. Фуллерены получают испарением графита при высокой температуре при действии лазерного излучения в атмосфере гелия; построены из
- 18. Аморфный углерод Каменный и древесный уголь, кокс, сажа. плотность, теплоемкость, теплопроводность и электропроводность выше, чем графита.
- 19. Аморфный углерод Активированный уголь - пористое вещество, которое получают из различных углеродсодержащих материалов органического происхождения: древесный
- 20. Адсорбция (ad — на, при; sorbeo — поглощаю) Это свойство углерода удерживать на пористой поверхности растворенные
- 21. Адсорбция Так же адсорбция применяется в медицине, химической, фармацевтической и пищевой промышленностях
- 22. Химические свойства углерода Восстановительные свойства. Записать уравнения реакций взаимодействия углерода 1) с фтором , 2) с
- 23. Химические свойства углерода Углерод вступает в реакции с солями кислородсодержащих кислот, связывая кислород: BaSO4 + C
- 24. Химические свойства углерода Окислительные свойства. Записать реакции взаимодействия углерода 1) с металлами (Аl), 2) с водородом
- 25. Реакции диспропорционирования: При нагревании с оксидами активных металлов: СаО + 3С = СаС2 + СО 2Аl2О3
- 26. Химические свойства углерода При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ:
- 27. Химические свойства углерода Углерод — сильный восстановитель. При нагревании с водяным паром он вытесняет из воды
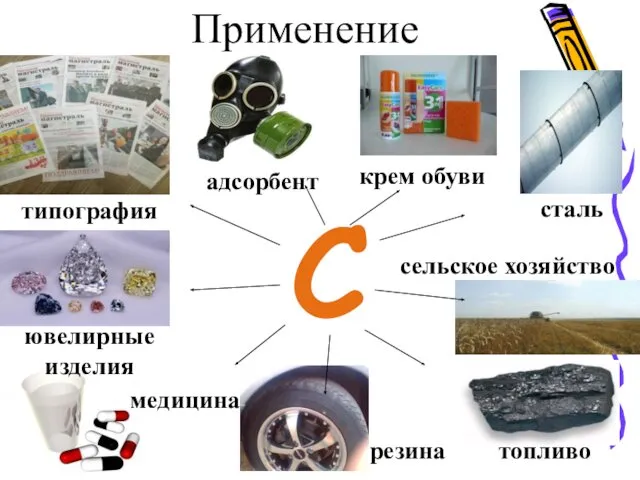
- 28. С сталь сельское хозяйство топливо медицина типография ювелирные изделия адсорбент резина крем обуви Применение
- 30. Домашняя работа Составить схемы электронного баланса следующих реакций: Ca + 2C = CaC2 4A1 + 3C
- 31. Какие утверждения верны: Углерод содержится и в воздухе, и в земной коре, в болоте и в
- 33. Скачать презентацию


























 Закономерности процессов нитрования НЦ
Закономерности процессов нитрования НЦ Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Решение задач. Органическая химия
Решение задач. Органическая химия Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Химическая наука и промышленность в годы Великой Отечественной войны
Химическая наука и промышленность в годы Великой Отечественной войны Метал конструкциялық материалдар
Метал конструкциялық материалдар Гетероциклические соединения. Классификация, номенклатура, строение и значение гетероциклов
Гетероциклические соединения. Классификация, номенклатура, строение и значение гетероциклов Solutions and solubilities
Solutions and solubilities Геохимия изотопов стабильных элементов
Геохимия изотопов стабильных элементов p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Супрамолекулярные системы – мост между неживой и живой материей
Супрамолекулярные системы – мост между неживой и живой материей Комплексные соединения
Комплексные соединения Углеводы (сахариды)
Углеводы (сахариды) Амфотерные соединения
Амфотерные соединения Предмет органической химии
Предмет органической химии Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Водород. Н2
Водород. Н2 Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры
Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры Минералы и формы существования марганца
Минералы и формы существования марганца Жидкостная хроматография
Жидкостная хроматография Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химия - тұрмыста
Химия - тұрмыста Строение и физические свойства металлов
Строение и физические свойства металлов Натуральный каучук
Натуральный каучук Классификация и свойства оксидов
Классификация и свойства оксидов Липиды 2. Тканевой обмен
Липиды 2. Тканевой обмен Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання