Содержание
- 2. К кислорородсодержащим производным углеводородов относятся: спирты (R-OH), фенолы (Ar-OH), простые эфиры (R-O-R’), альдегиды (R-CHO), кетоны (R-CO-R’),
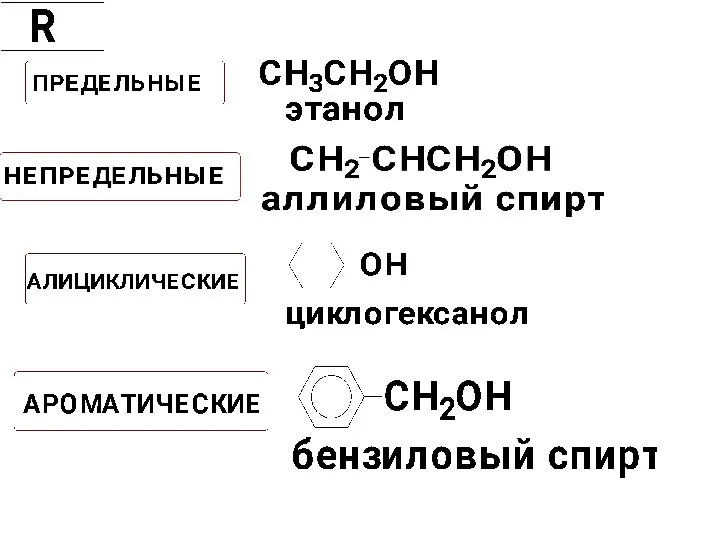
- 3. Гидроксилсодержащие производные углеводородов такие производные, у которых один или несколько Н-атомов замещены на гидроксильную группу –
- 4. Общее название – алканолы. Это производные углеводородов, у которых гидроксильная группa связана с sp3 гибридным атомом
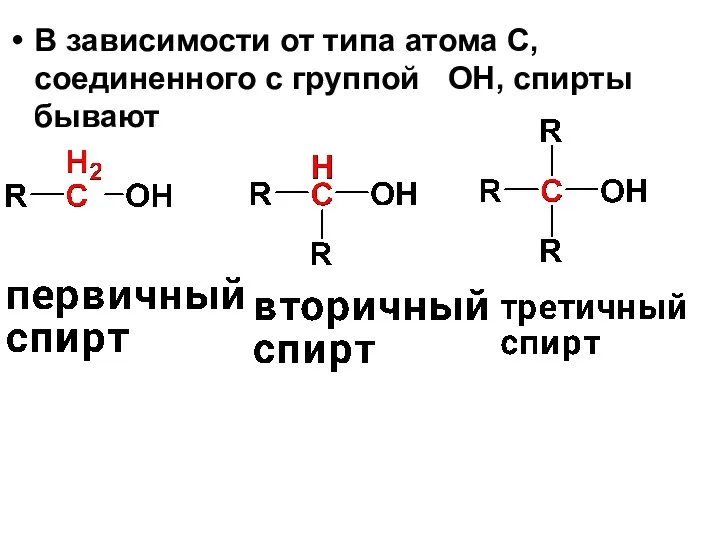
- 6. В зависимости от типа атома С, соединенного с группой ОН, спирты бывают
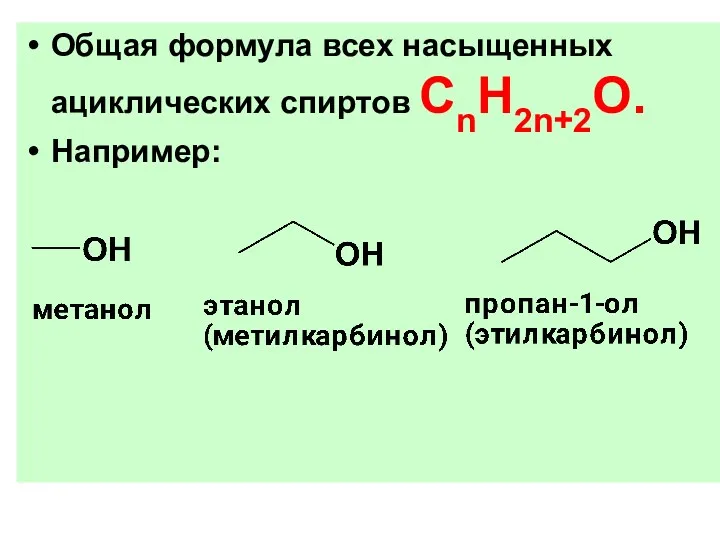
- 7. Общая формула всех насыщенных ациклических спиртов СnH2n+2O. Например:
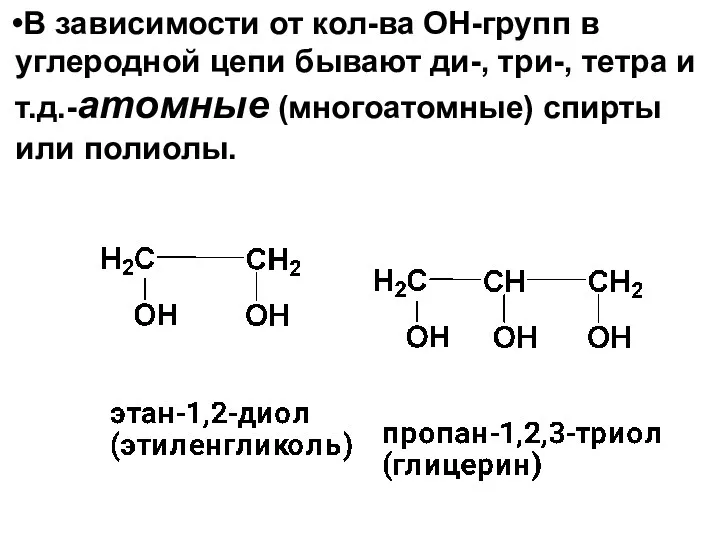
- 9. В зависимости от кол-ва ОН-групп в углеродной цепи бывают ди-, три-, тетра и т.д.-атомные (многоатомные) спирты
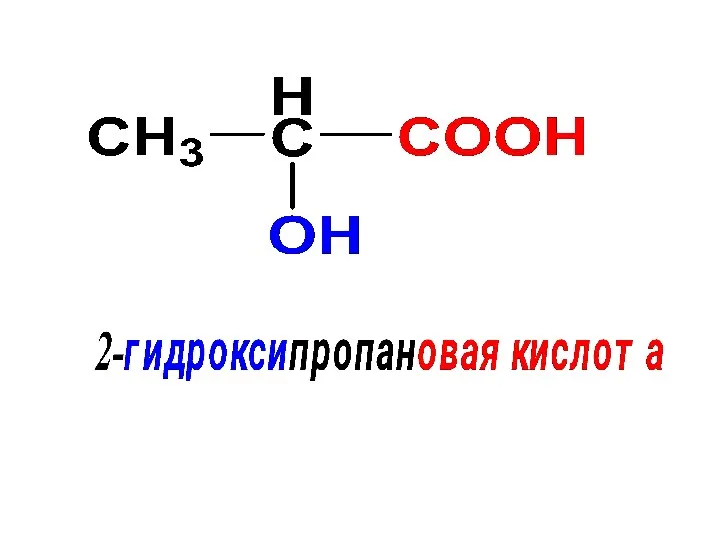
- 10. Номенклатура ИЮПАК Гидроксильная группа спиртов указывается при помощи суффикса ОЛ Если в соединении присутствуют более старшие
- 12. ИЗОМЕРИЯ C- скелета; Положения ОН-гр.; Оптическая изомерия.
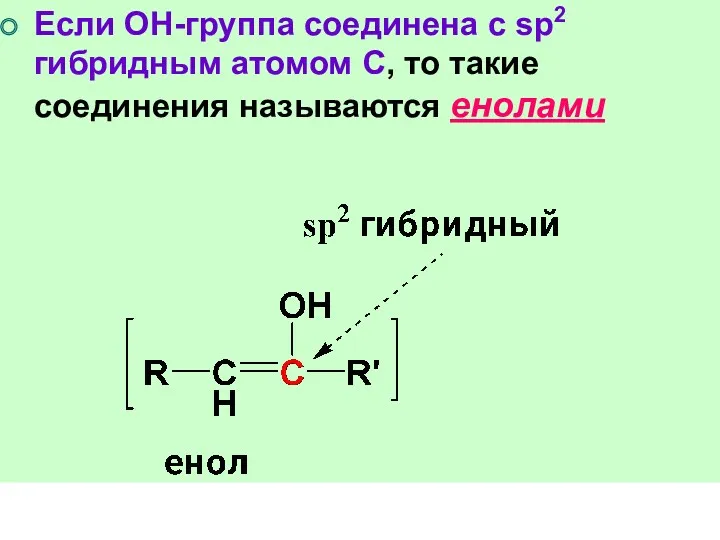
- 13. Если ОН-группа соединена с sp2 гибридным атомом С, то такие соединения называются енолами
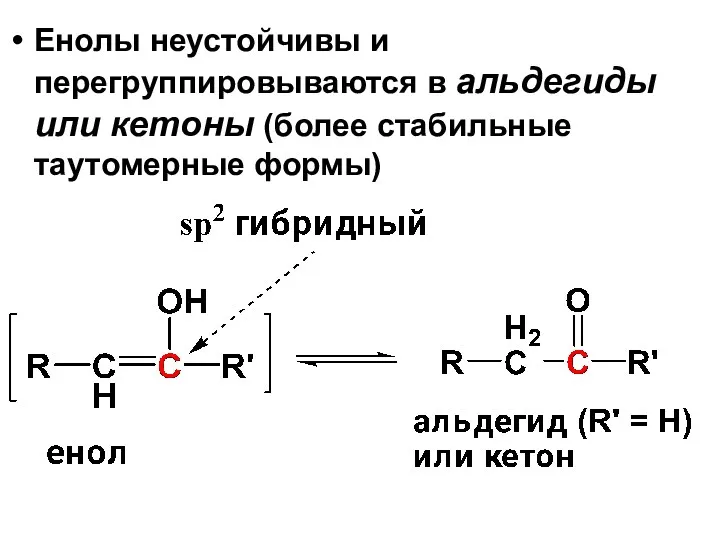
- 14. Енолы неустойчивы и перегруппировываются в альдегиды или кетоны (более стабильные таутомерные формы)
- 15. ФЕНОЛЫ Фенолы это производные ароматических углеводородов, в молекулах которых группа OH непосредственно связана с sp2-гибридным атомом
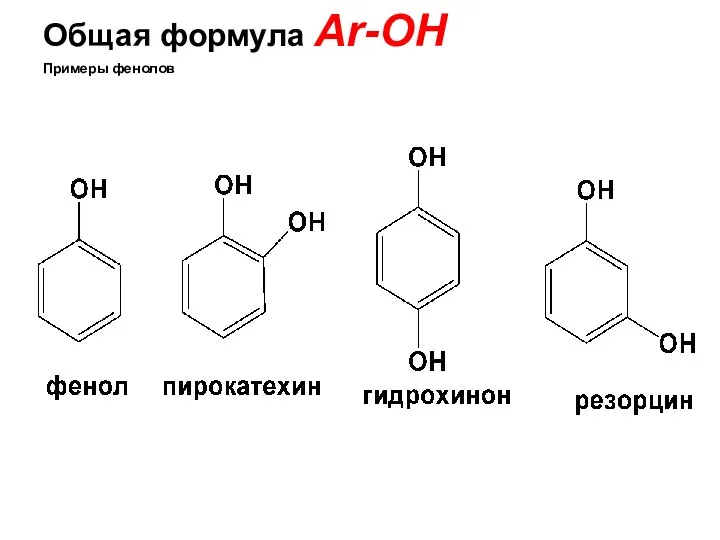
- 16. Общая формула Ar-OH Примеры фенолов
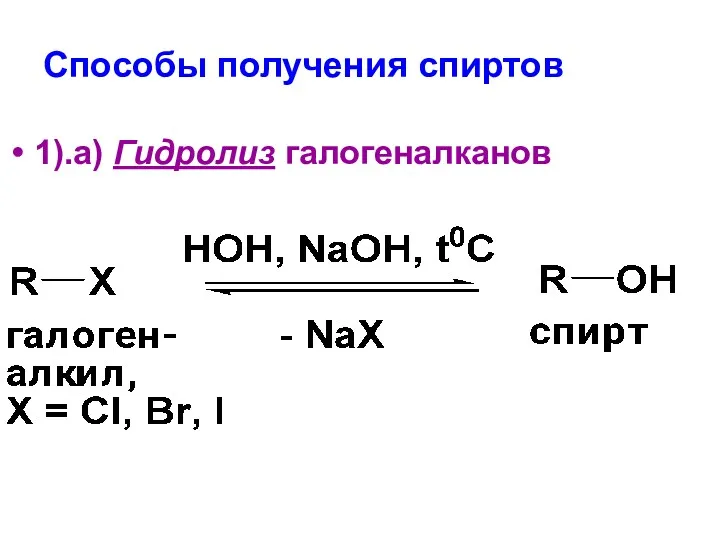
- 19. Способы получения спиртов 1).а) Гидролиз галогеналканов
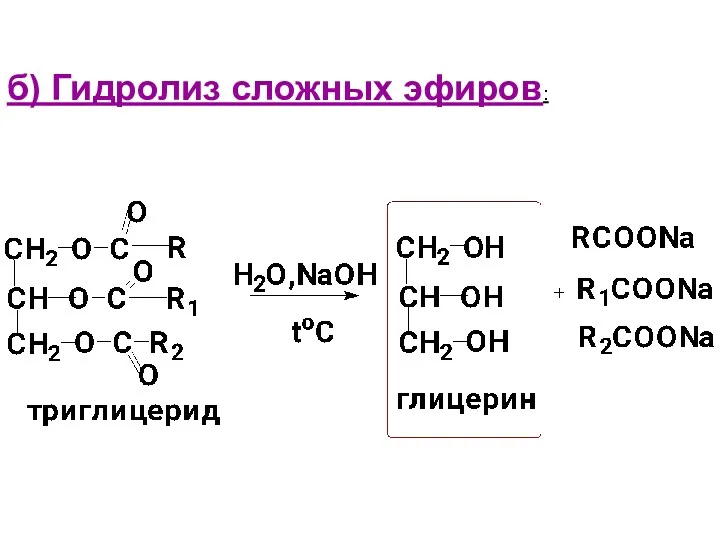
- 20. б) Гидролиз сложных эфиров:
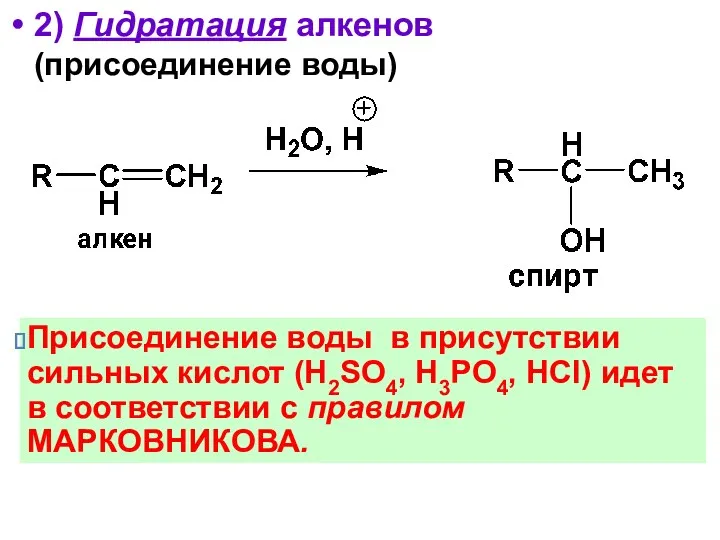
- 21. 2) Гидратация алкенов (присоединение воды) Присоединение воды в присутствии сильных кислот (H2SO4, H3PO4, HCl) идет в
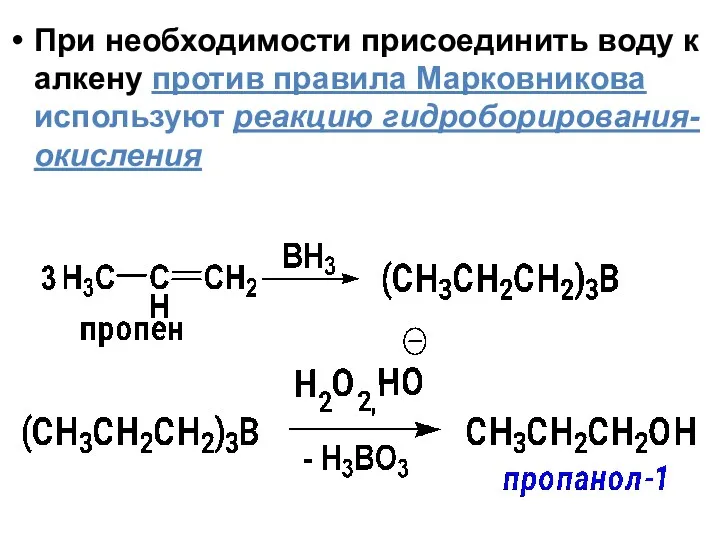
- 22. При необходимости присоединить воду к алкену против правила Марковникова используют реакцию гидроборирования-окисления
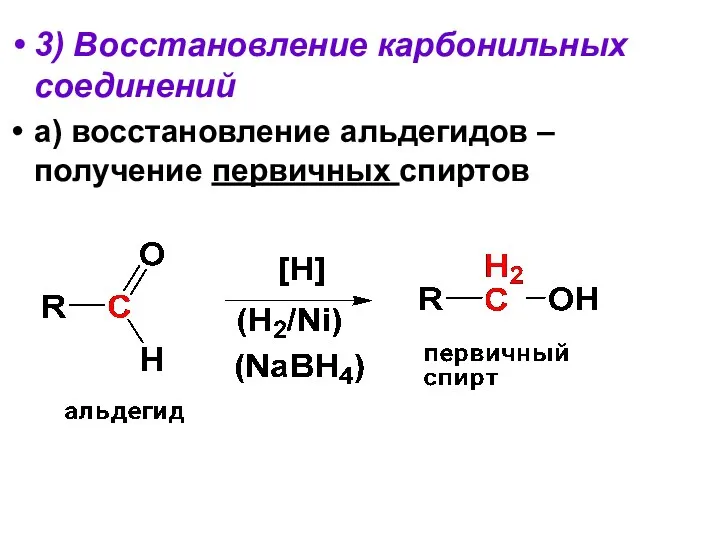
- 23. 3) Восстановление карбонильных соединений а) восстановление альдегидов – получение первичных спиртов
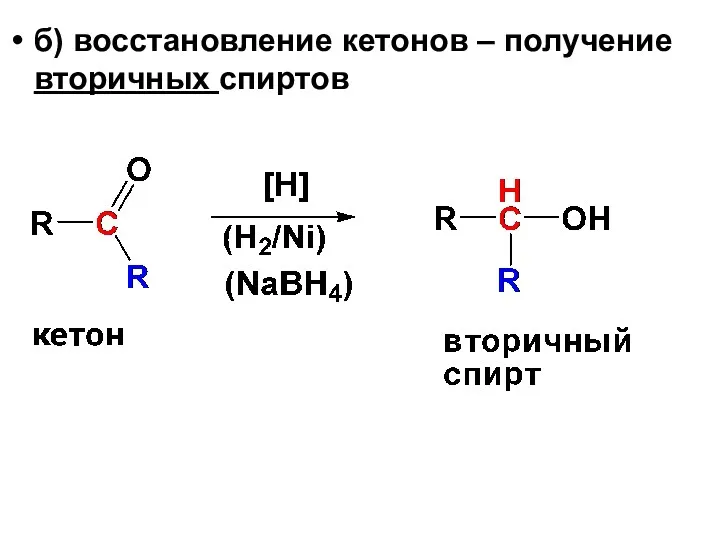
- 24. б) восстановление кетонов – получение вторичных спиртов
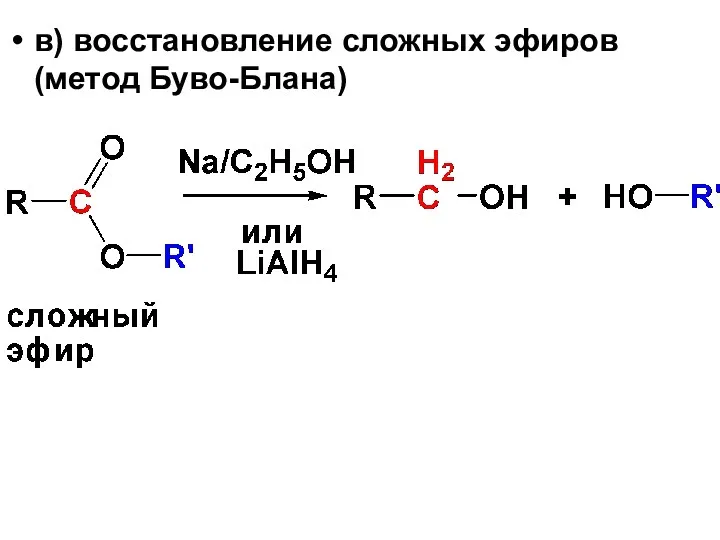
- 25. в) восстановление сложных эфиров (метод Буво-Блана)
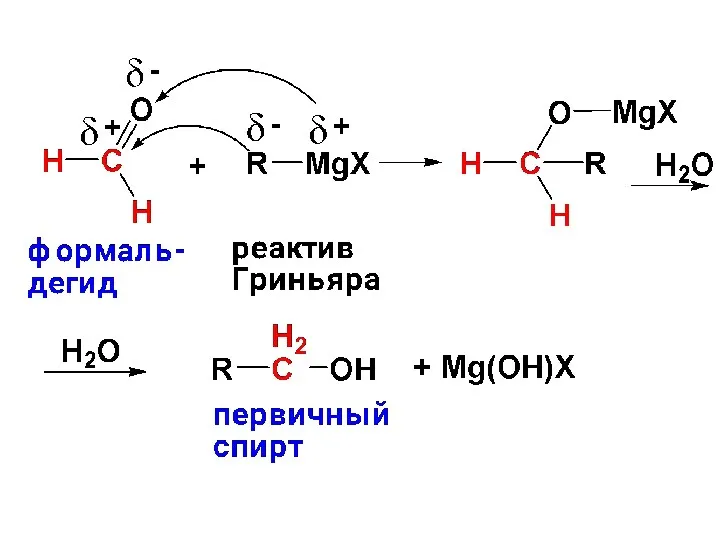
- 26. 4. Получение спиртов из карбонильных соединений с помощью реактивов Гриньяра: а) получение первичных спиртов. Для этого
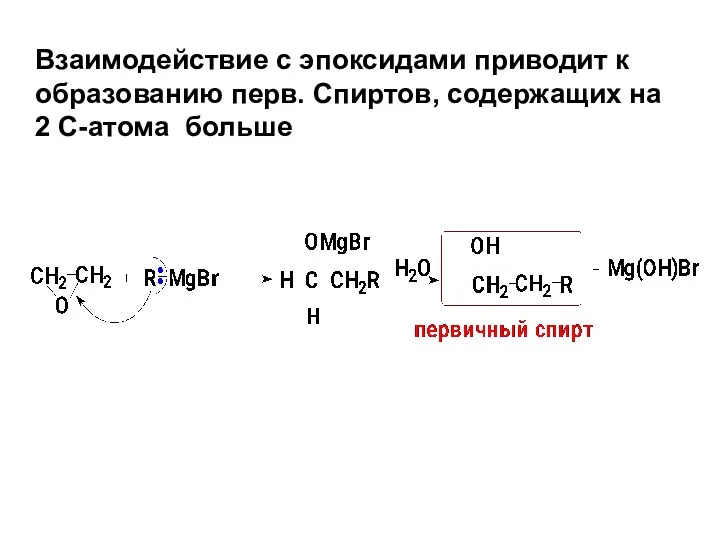
- 28. Взаимодействие с эпоксидами приводит к образованию перв. Спиртов, содержащих на 2 С-атома больше
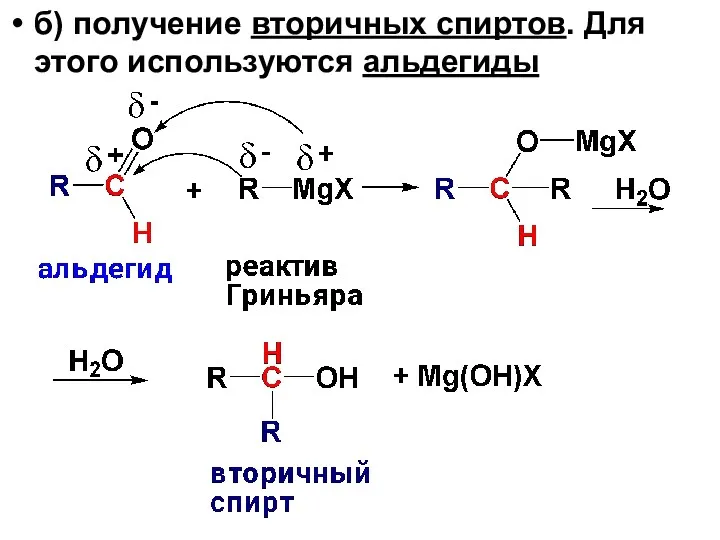
- 29. б) получение вторичных спиртов. Для этого используются альдегиды
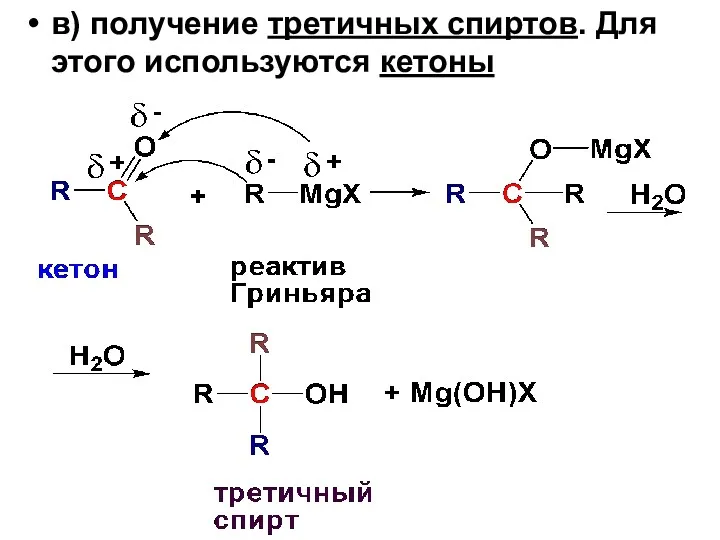
- 30. в) получение третичных спиртов. Для этого используются кетоны
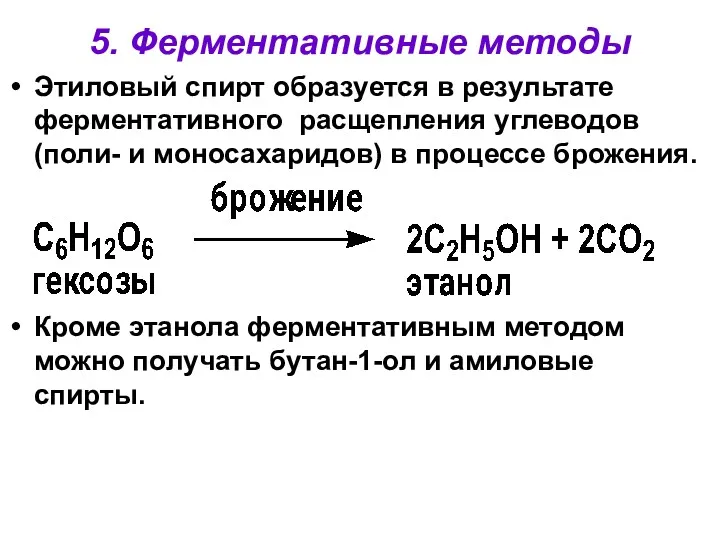
- 31. 5. Ферментативные методы Этиловый спирт образуется в результате ферментативного расщепления углеводов (поли- и моносахаридов) в процессе
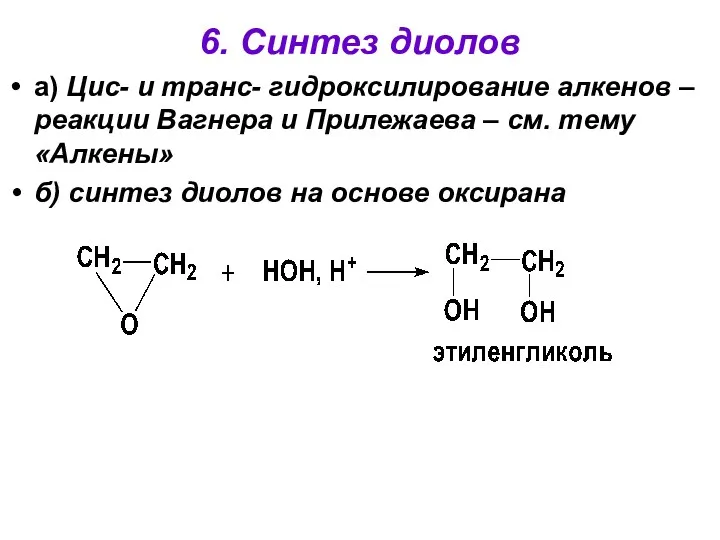
- 32. 6. Синтез диолов а) Цис- и транс- гидроксилирование алкенов – реакции Вагнера и Прилежаева – см.
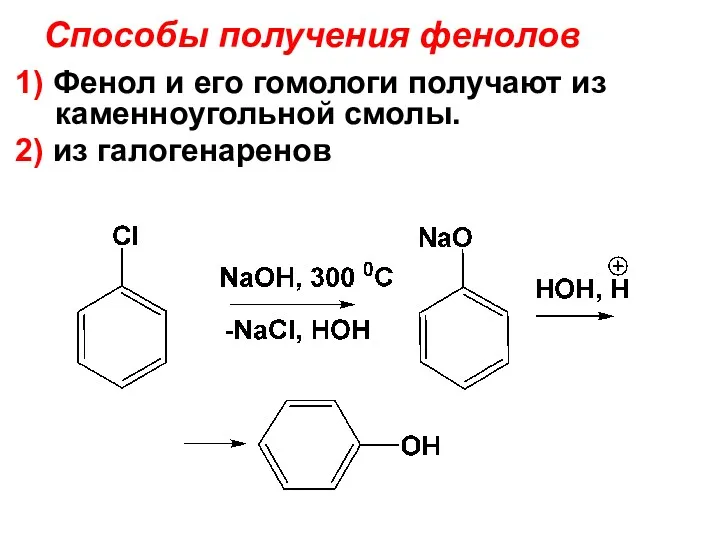
- 33. Способы получения фенолов 1) Фенол и его гомологи получают из каменноугольной смолы. 2) из галогенаренов
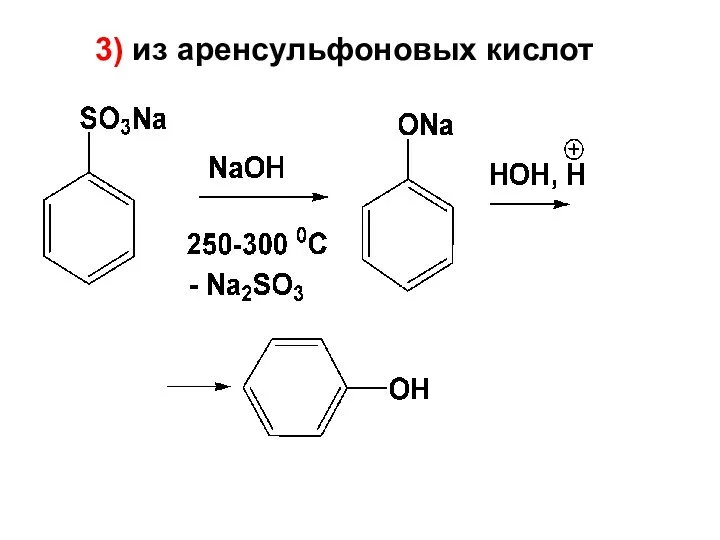
- 34. 3) из аренсульфоновых кислот
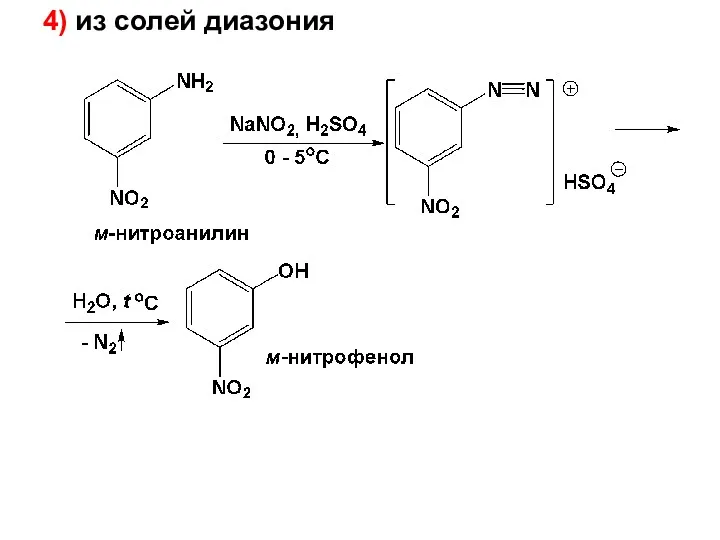
- 35. 4) из солей диазония
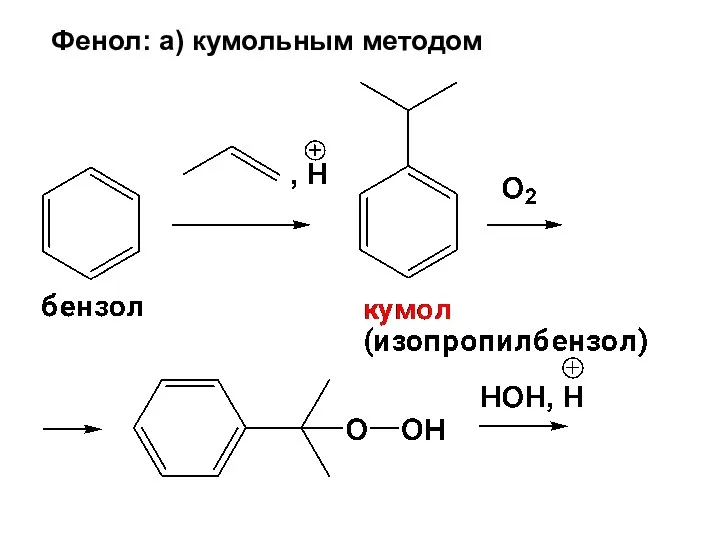
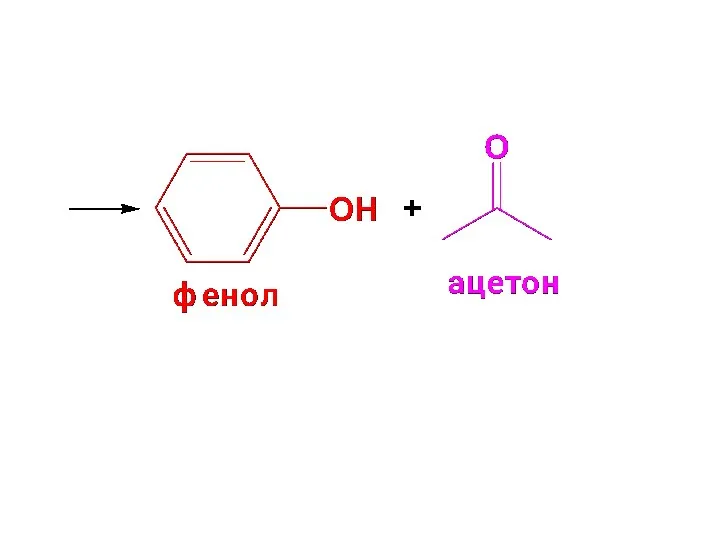
- 36. Фенол: а) кумольным методом
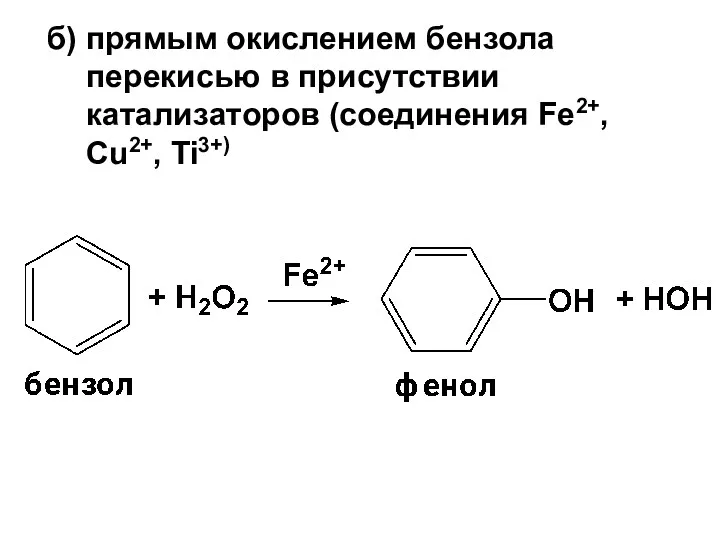
- 38. б) прямым окислением бензола перекисью в присутствии катализаторов (соединения Fe2+, Cu2+, Ti3+)
- 39. Строение и физические свойства спиртов Спирты представляют собой ж. или тв. в-ва со своеобразным запахом. Низшие
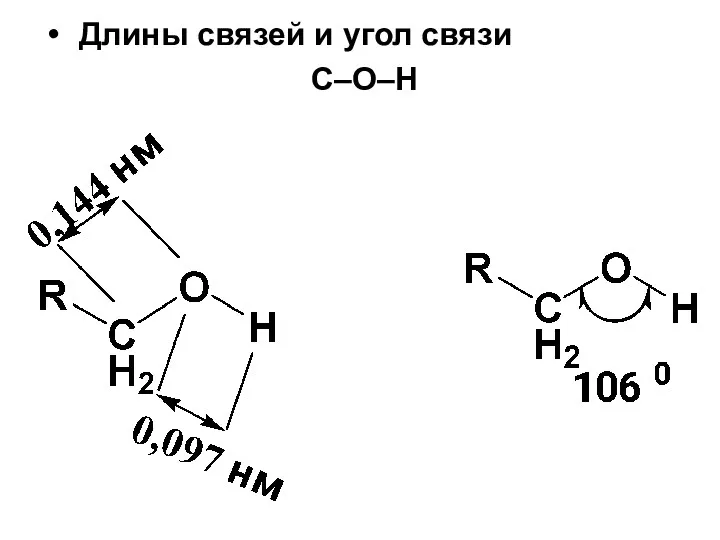
- 40. Длины связей и угол связи С–О–Н
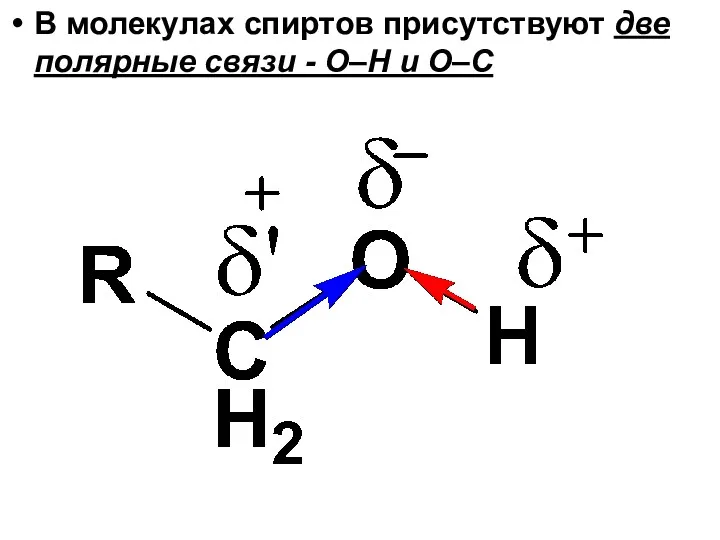
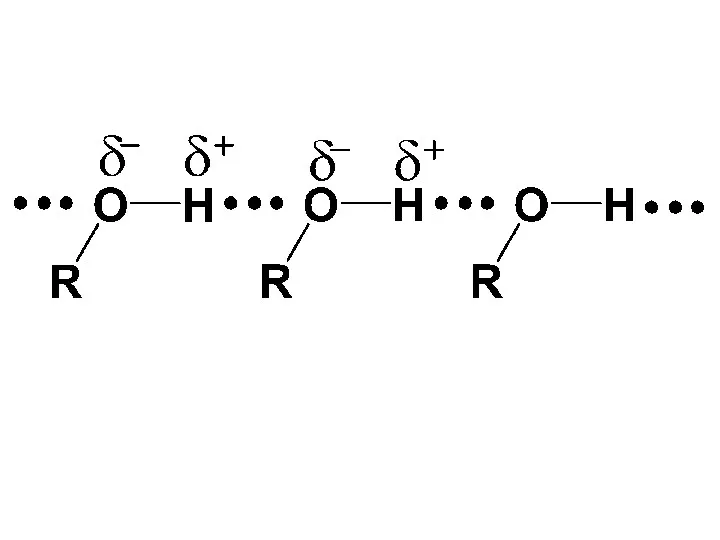
- 41. В молекулах спиртов присутствуют две полярные связи - О–Н и О–С
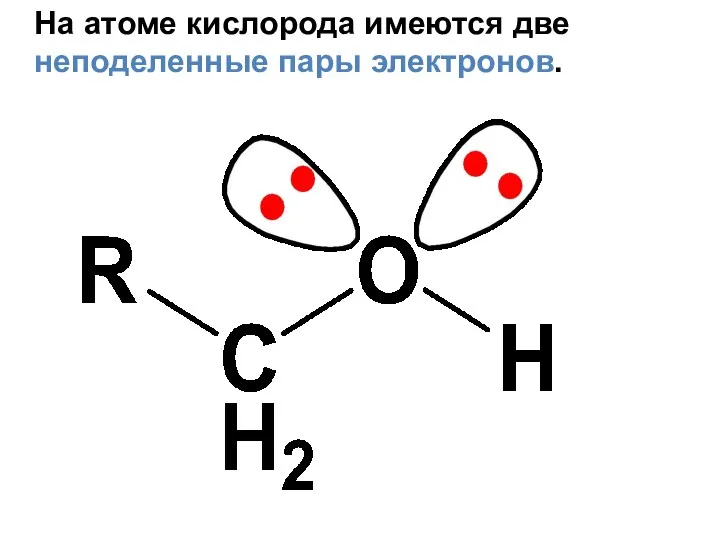
- 42. На атоме кислорода имеются две неподеленные пары электронов.
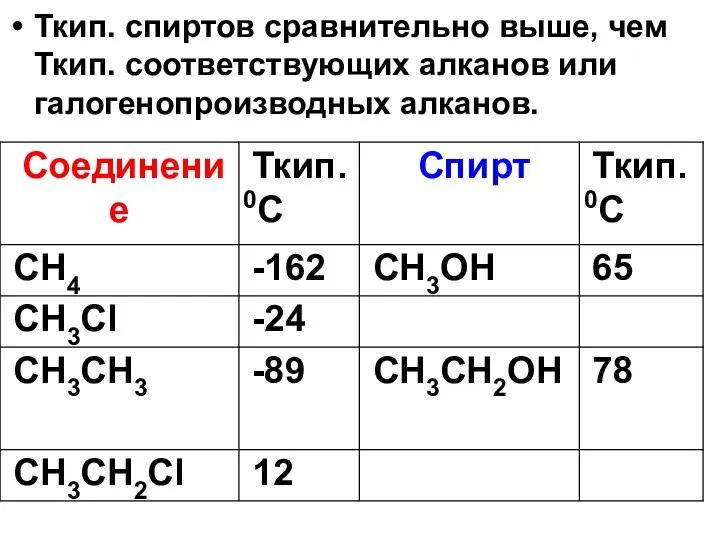
- 43. Ткип. спиртов сравнительно выше, чем Ткип. соответствующих алканов или галогенопроизводных алканов.
- 44. Это связано со значительной ассо-циацией молекул спиртов за счет об-разования межмолекулярных водородных связей, которые возникают в
- 46. Строение и физические свойства фенолов Фенолы, как правило тв. в-ва. Сам фенол крист. бесц. в-во, розовеющее
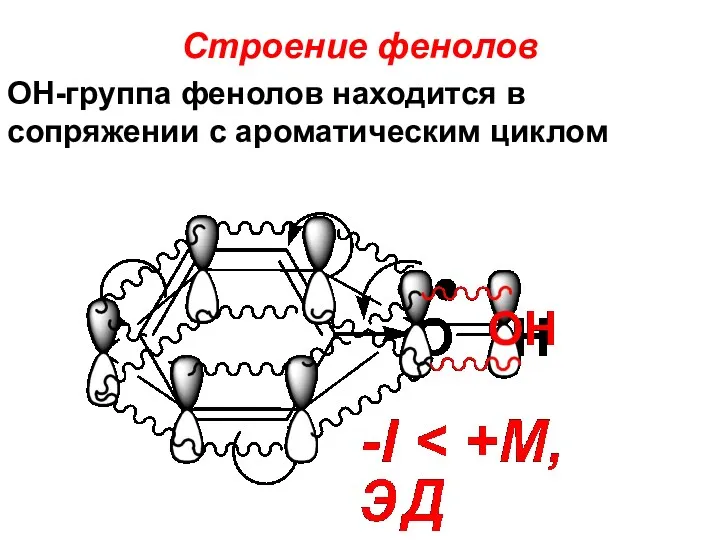
- 47. Строение фенолов ОН-группа фенолов находится в сопряжении с ароматическим циклом
- 48. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ И ФЕНОЛОВ
- 49. Определяются наличием полярных связей О–Н, О–С и неподеленных электронных пар на О-атоме - реакции по связи
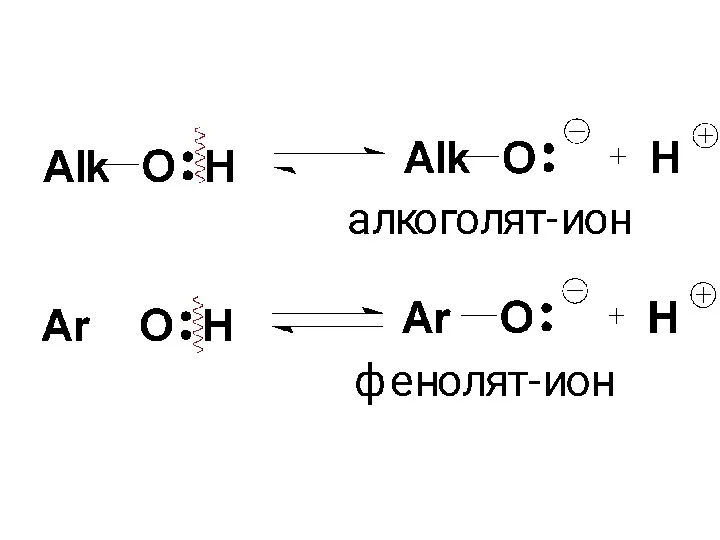
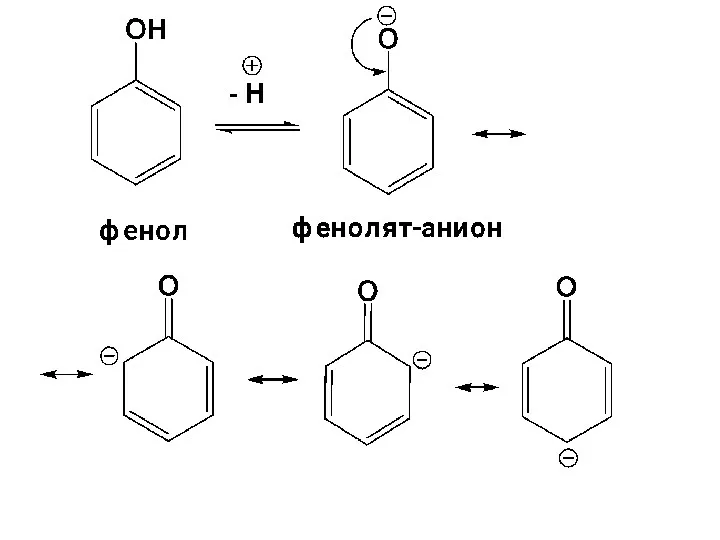
- 50. I. Кислотность и основность. а) Кислотные свойства – образование алкоголятов и фенолятов. Очевидно, что ОН-содержащие в
- 52. Кислотные св-ва соединения определяются - полярностью связи ; - стабильностью аниона, образующегося в результате отдачи протона
- 53. Поэтому природа углеводородного остатка влияет на кислотные св-ва, сила кислоты тем больше: чем выше полярность связи
- 54. ЭА заместители в углеводородном радикале увеличивают полярность связи и способствуют стабилизации аниона, благодаря чему кислотность увеличивается
- 55. Поэтому спирты, в молекулах которых с ОН-группой связан алкильный R, обладающий +I –эффектом, явл-ся слабыми кислотами,
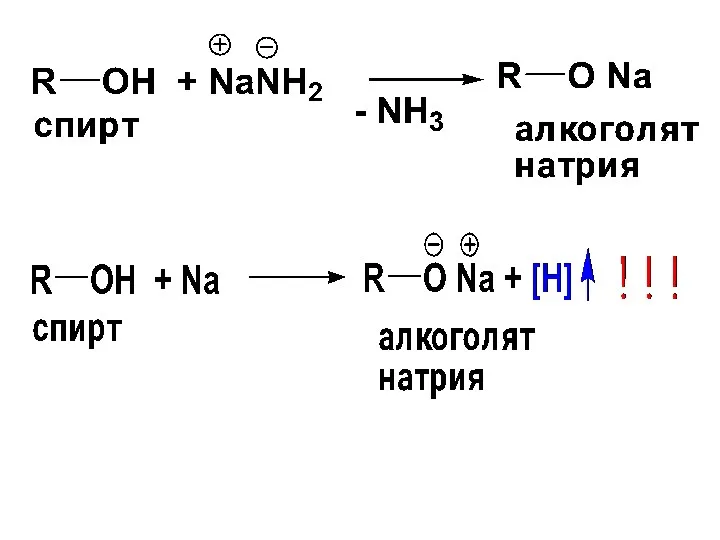
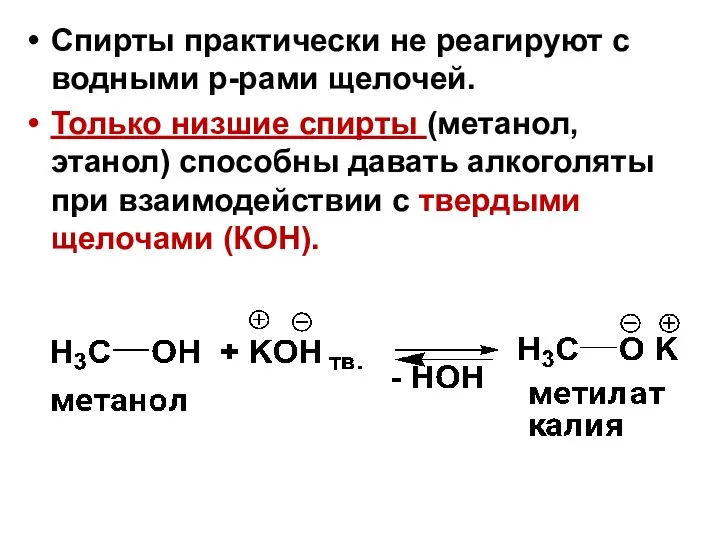
- 57. Спирты практически не реагируют с водными р-рами щелочей. Только низшие спирты (метанол, этанол) способны давать алкоголяты
- 58. Спирты являются слабыми кислотами, а алкоголят-анионы (R–О−) напротив представляют собой очень сильные основания. (вспомним, напр. их
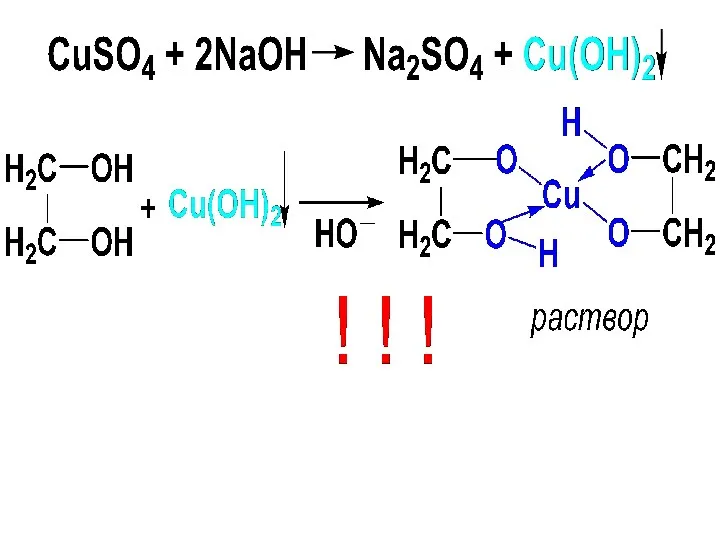
- 59. Кислотность многоатомных спиртов возрастает, особенно в случае виц-расположения ОН-групп. Поэтому 1,2-диолы (α-гликоли) реагируют с гидроксидами тяжелых
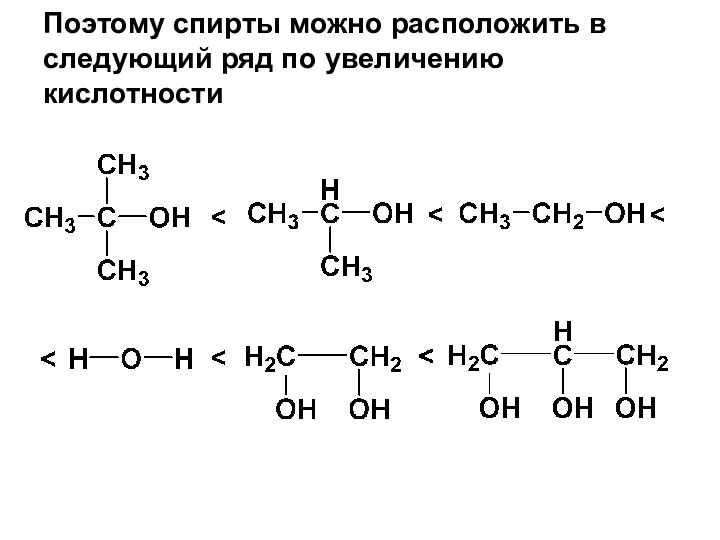
- 61. Поэтому спирты можно расположить в следующий ряд по увеличению кислотности
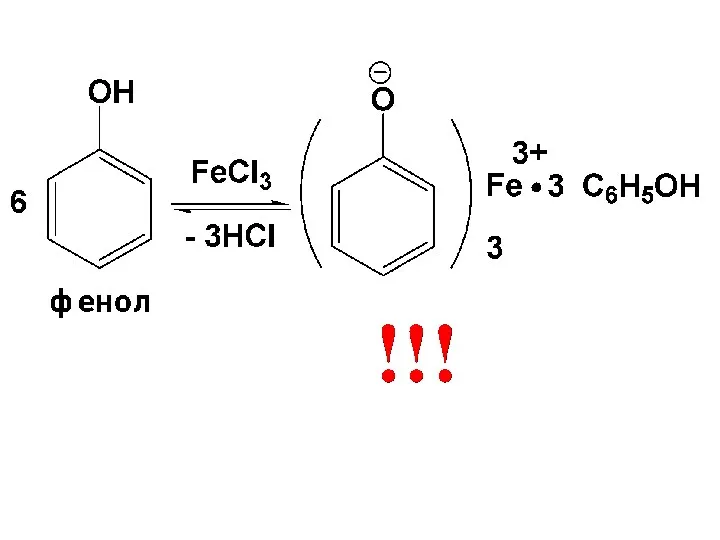
- 62. По сравнению со спиртами фенолы являются более сильными кислотами т.к.
- 63. - связь О-Н у фенолов более полярная (способствует сопряжение НЭП кислорода с ароматическим циклом); - фенолят-анион,
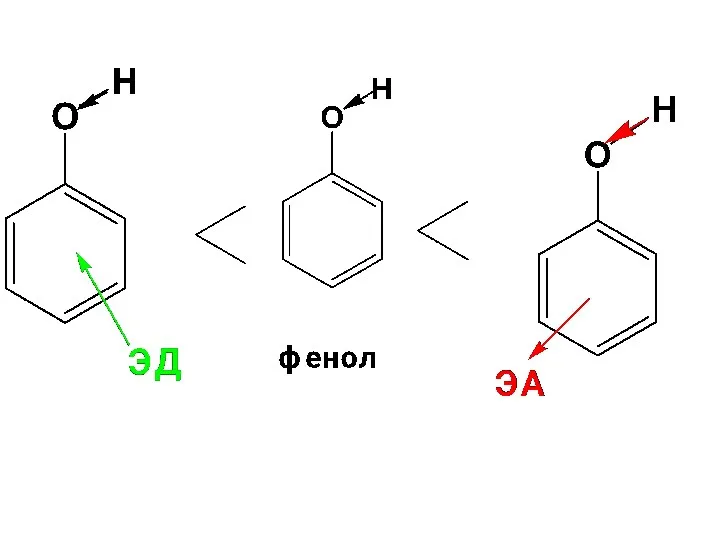
- 65. Наличие ЭА заместителей в ароматическом кольце фенолов повышает их кислотность. Если в ароматическом кольце присутствует ЭД
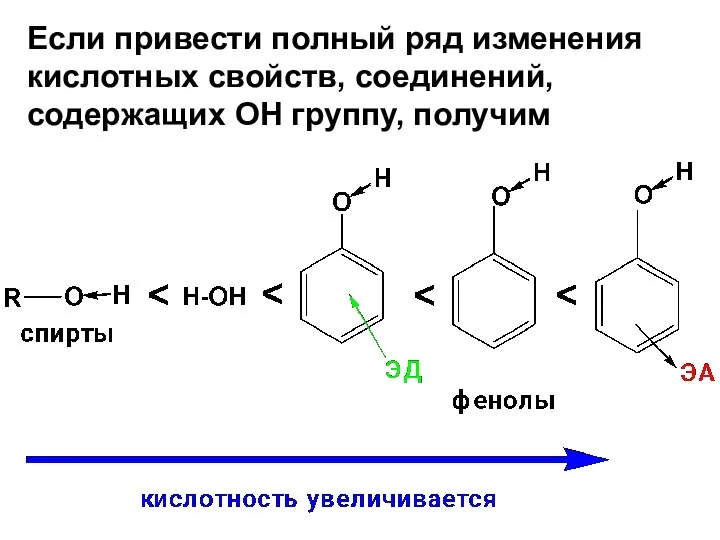
- 67. Если привести полный ряд изменения кислотных свойств, соединений, содержащих ОН группу, получим
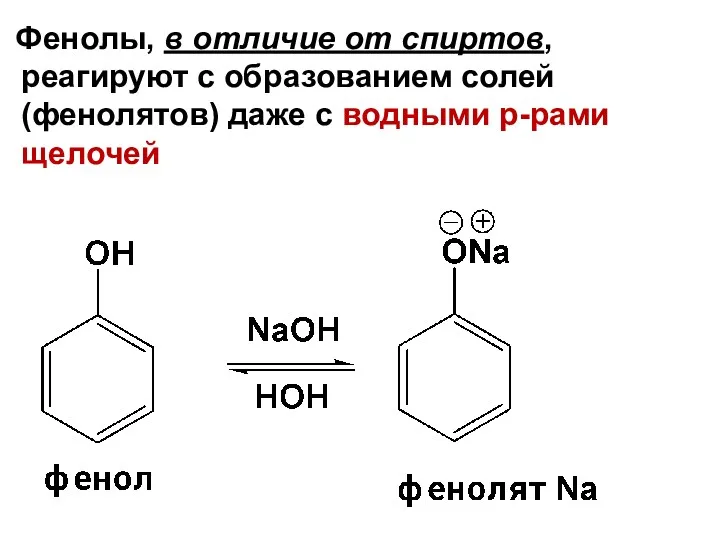
- 68. Фенолы, в отличие от спиртов, реагируют с образованием солей (фенолятов) даже с водными р-рами щелочей
- 69. Обладая кислотными свойствами фенолы растворяются в водных растворах щелочей. Эта реакция может быть использована для разделения
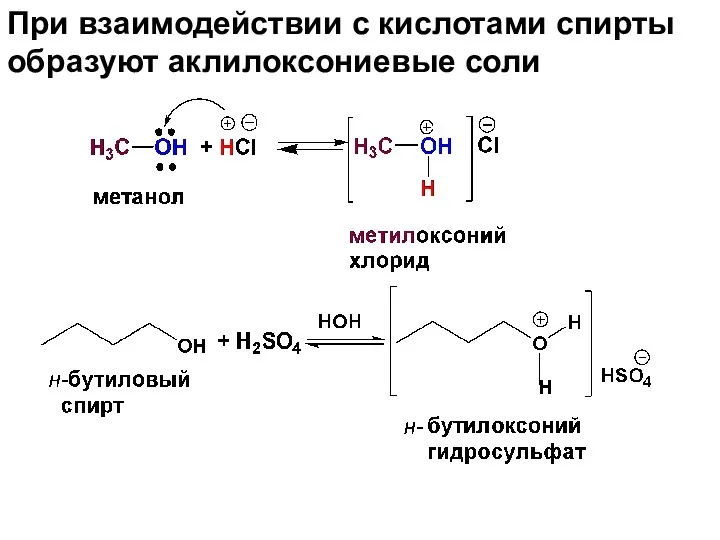
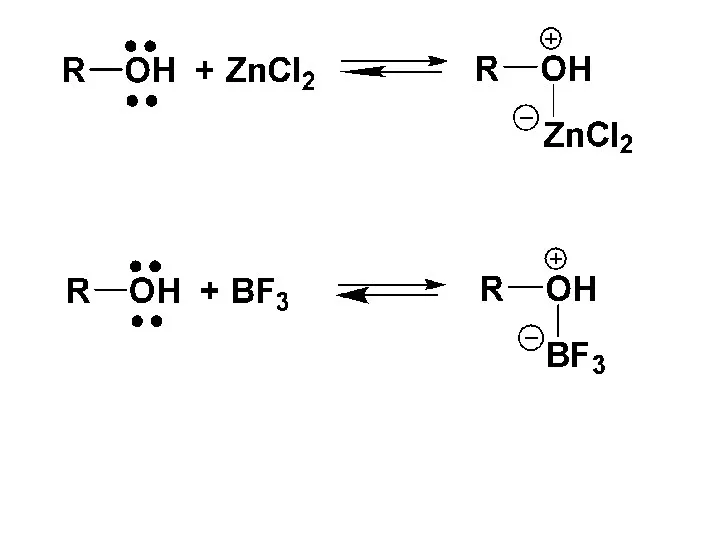
- 71. б) Основные свойства спиртов – образование алкилоксониевых солей Благодаря наличию на атоме кислорода, неподеленных электронных пар,
- 72. При взаимодействии с кислотами спирты образуют аклилоксониевые соли
- 74. Основность фенолов понижена из-за понижения электронной плотности на О-атоме вследствие М-эффекта: с кислотами оксониевых солей не
- 75. II.Спирты и фенолы, как нуклеофильные реагенты Благодаря наличию е-пары на О-атоме ОН- производные явл-ся нуклеофилами. Вследствие
- 76. а) Алкилирование - образование простых эфиров (реакция Вильямсона) Вследствие низкой нуклеофильности непосредственное алкилирование спиртов и фенолов
- 77. Ряд алкилирующих средств: R-OSO2O-R > R-I > R-Br > R-Cl
- 78. Следует отметить, что простые диалкиловые эфиры образуются также в р-ции межмолекулярной дегидратации, которая будет рассмотрена ниже.
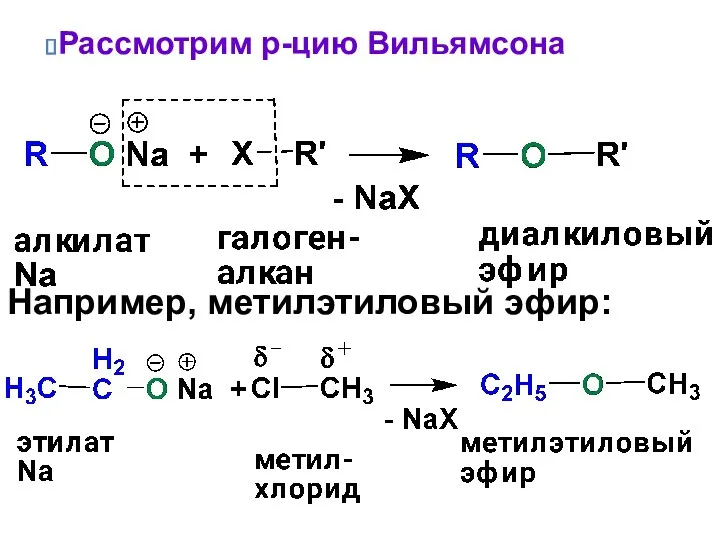
- 79. Например, метилэтиловый эфир: Рассмотрим р-цию Вильямсона
- 80. Очевидно, что данная реакция является типичной реакцией нуклеофильного замещения SN (SN2 или SN1). Поэтому необходимо учитывать,
- 81. Значит для получения простых эфиров реакцией Вильямсона следует правильно выбрать исходные вещества (алкоголят и галогеналкан), чтобы
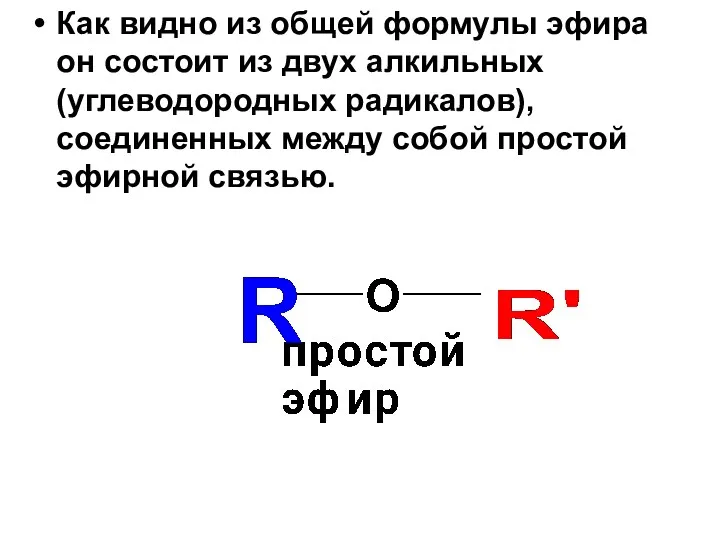
- 82. Как видно из общей формулы эфира он состоит из двух алкильных (углеводородных радикалов), соединенных между собой
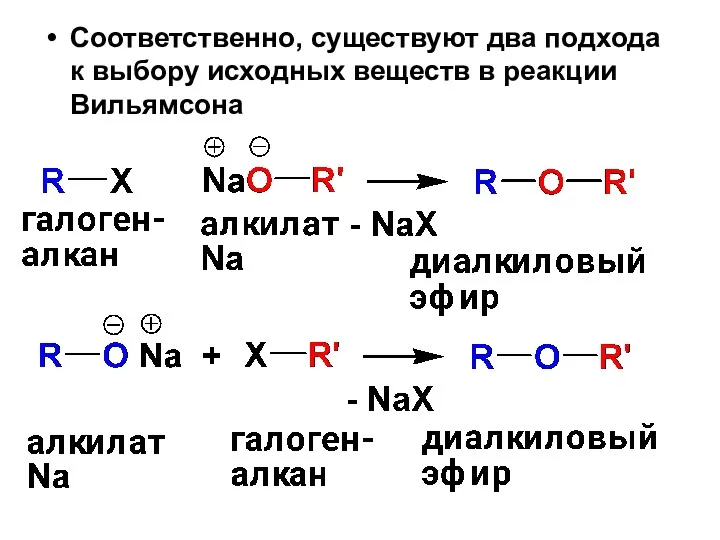
- 83. Соответственно, существуют два подхода к выбору исходных веществ в реакции Вильямсона
- 84. Чтобы минимизировать возможность образования алкена следует, по возможности, использовать в реакции первичный галогеналкан, который менее склонен
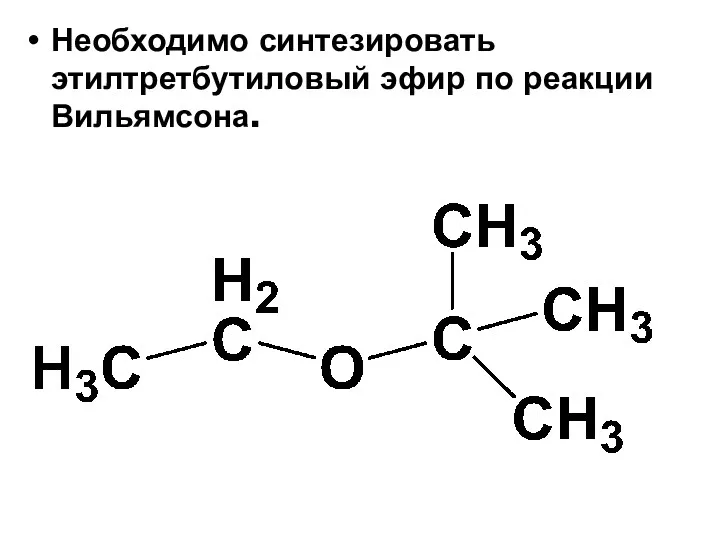
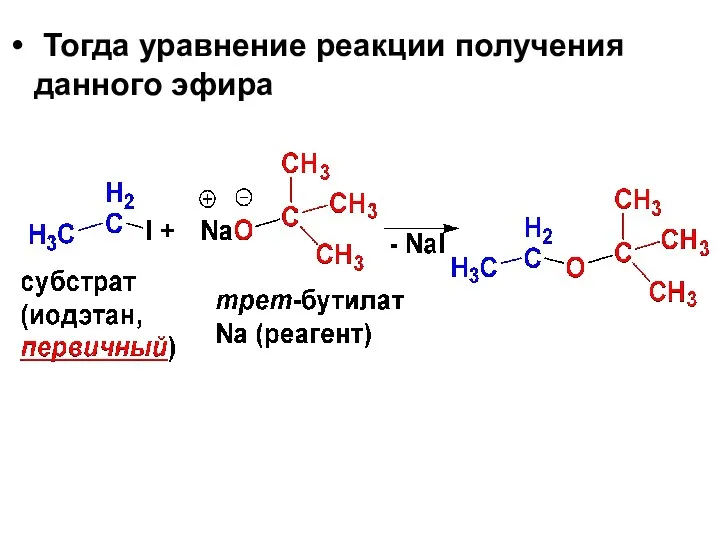
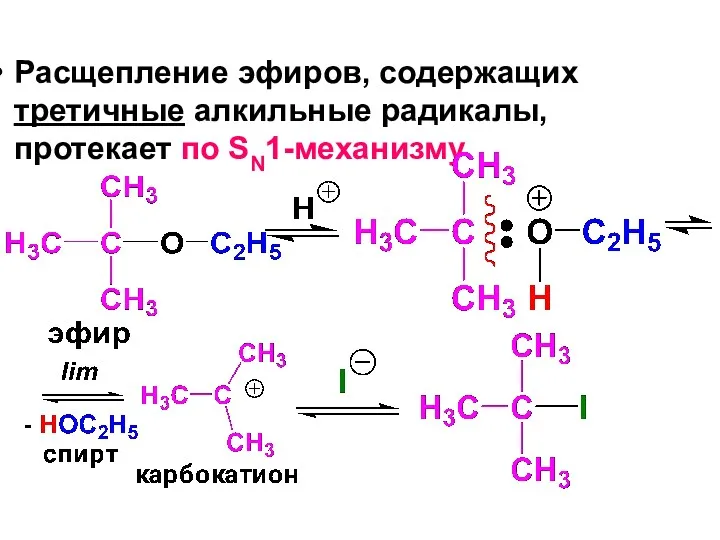
- 85. Необходимо синтезировать этилтретбутиловый эфир по реакции Вильямсона.
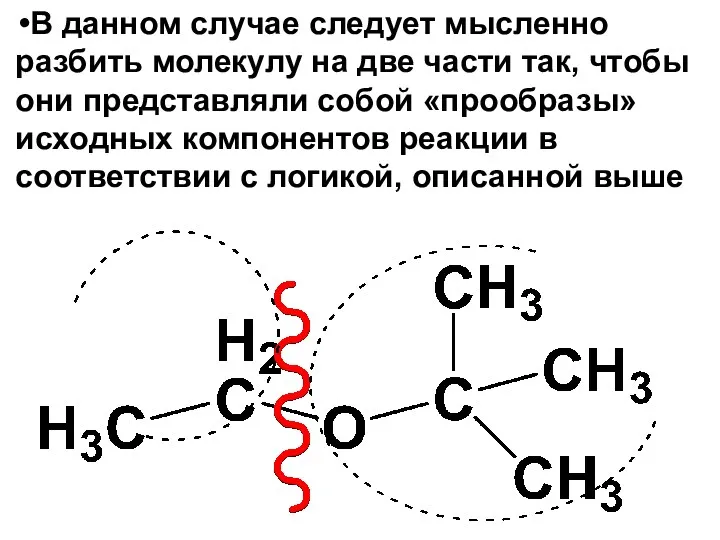
- 86. В данном случае следует мысленно разбить молекулу на две части так, чтобы они представляли собой «прообразы»
- 87. Тогда уравнение реакции получения данного эфира
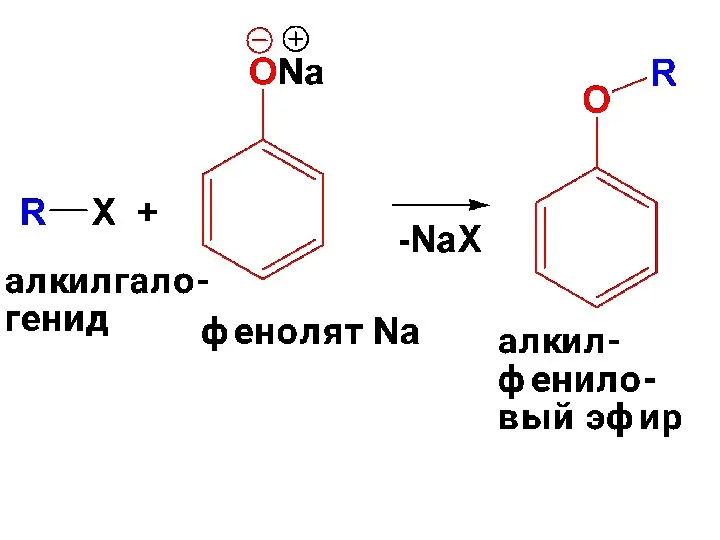
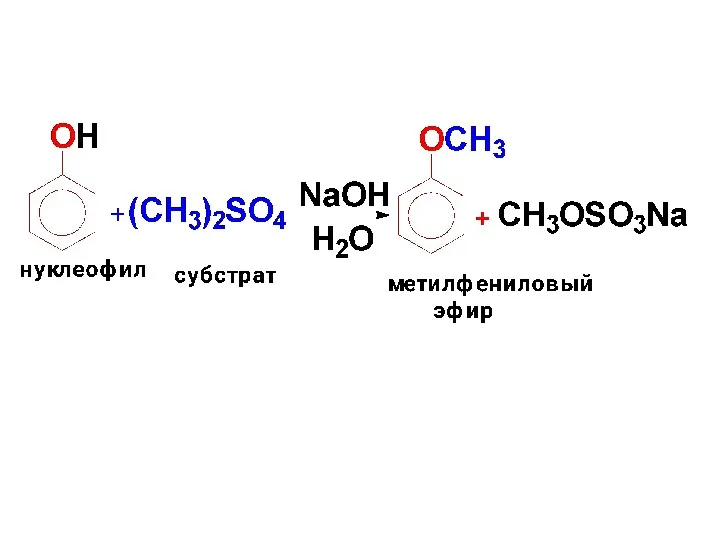
- 88. Получение простых фениловых эфиров Алкилирование фенолятов щелочных металлов галогенопроизводными углеводородов (реакция SN) Алкилирование фенолов диметилсульфатом в
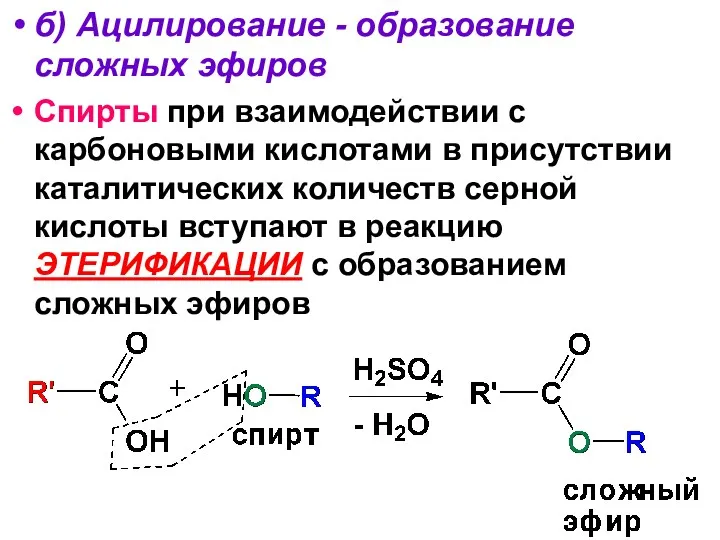
- 91. б) Ацилирование - образование сложных эфиров Спирты при взаимодействии с карбоновыми кислотами в присутствии каталитических количеств
- 92. Для получения сложных эфиров можно использовать реакцию ацилирования спиртов или алкоголятов щелочных металлов ангидридами или галогенангидридами
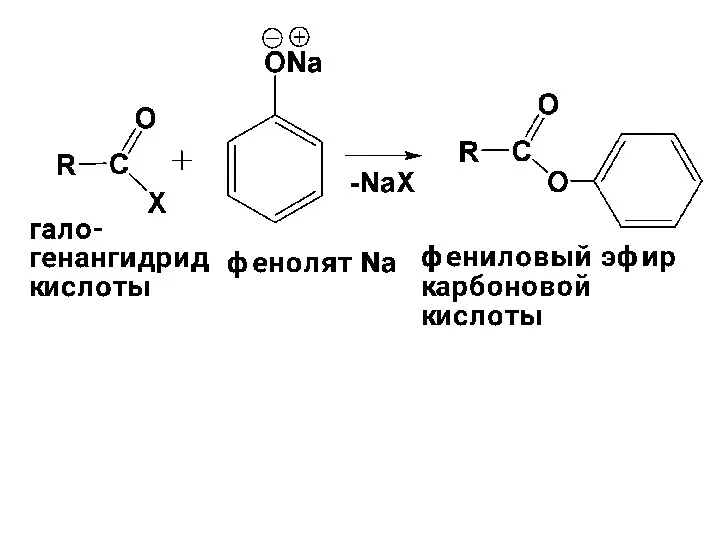
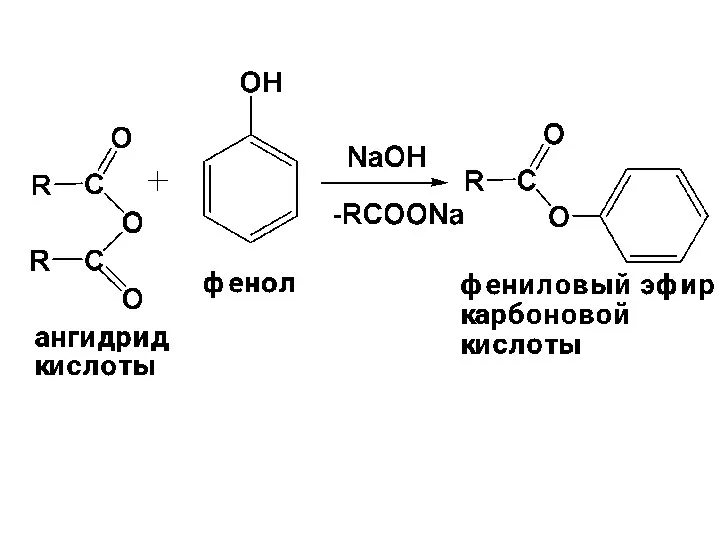
- 93. Фенолы – слабые нуклеофилы, не вступают в реакцию этерификации! Сложные эфиры фенолов получают взаимодействием ацилирующих агентов
- 96. III. Реакции, протекающие с разрывом связи С–О (отщепление ОН-группы) В результате этих реакций образуются производные алканов
- 98. Гидроксид-анион (ОН-) является очень энергетически невыгодной уходящей группой. Р-ция в отсутствие кислоты (Н+) практически не идет.
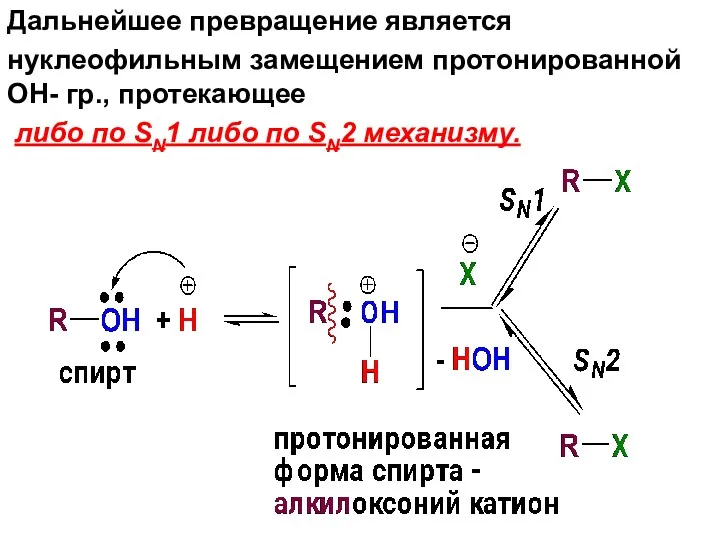
- 99. Дальнейшее превращение является нуклеофильным замещением протонированной OH- гр., протекающее либо по SN1 либо по SN2 механизму.
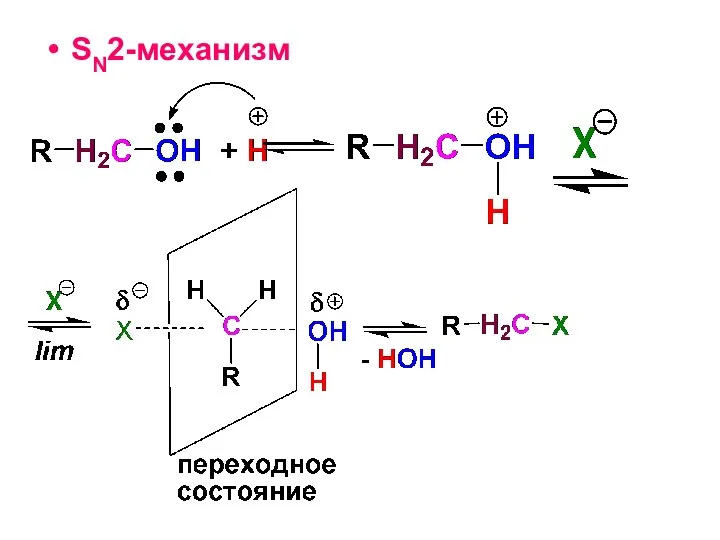
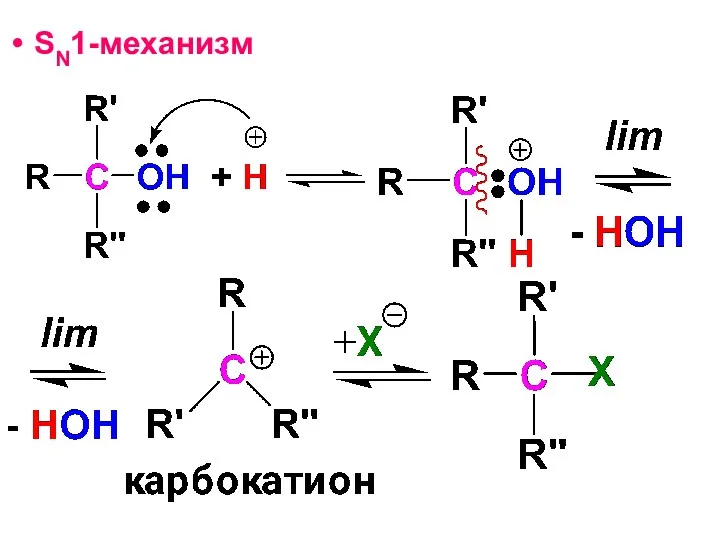
- 100. Mеханизм р-ции определяется в первую очередь cтроением углеводородного радикала Для первичных спиртов реализуется SN2 механизм, для
- 101. SN2-механизм
- 102. SN1-механизм
- 103. В качестве источника НХ часто используют соли NaX в присутствии сильной минеральной к-ты (серной) Образование галогеналкилов
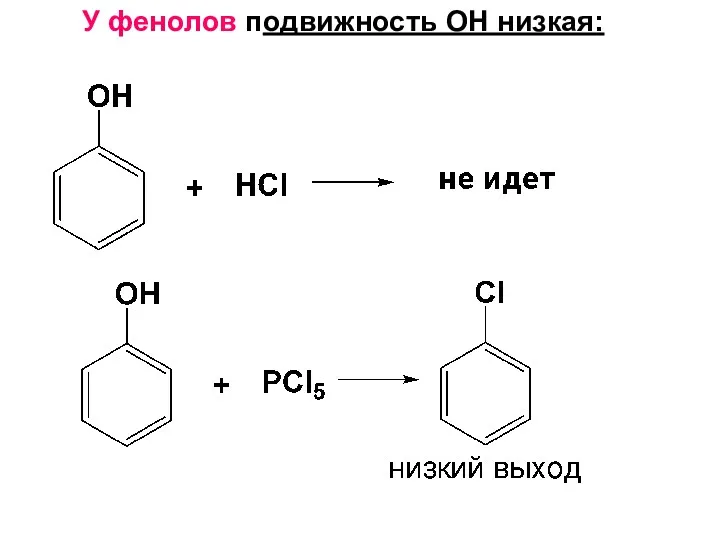
- 105. У фенолов подвижность ОН низкая:
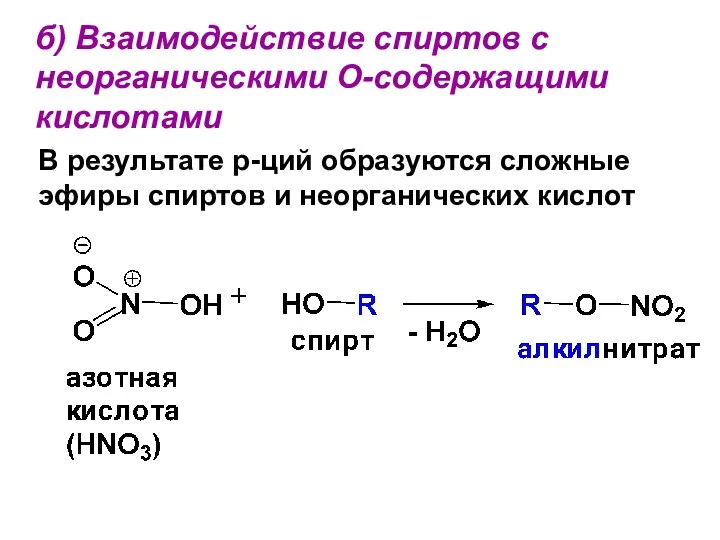
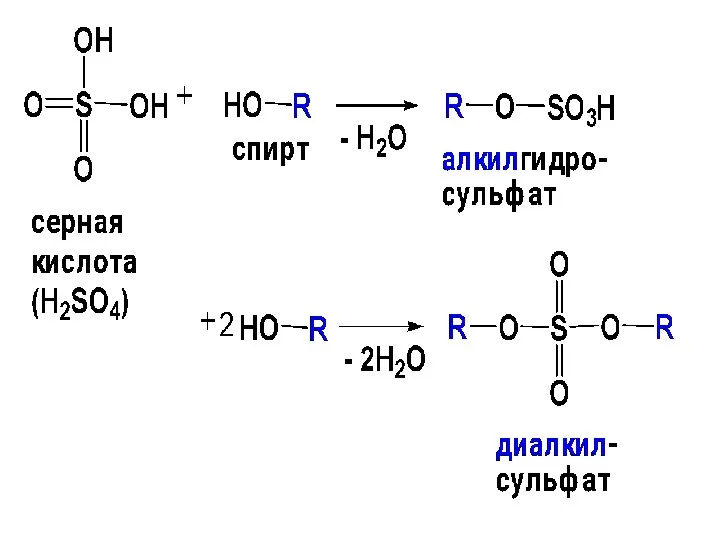
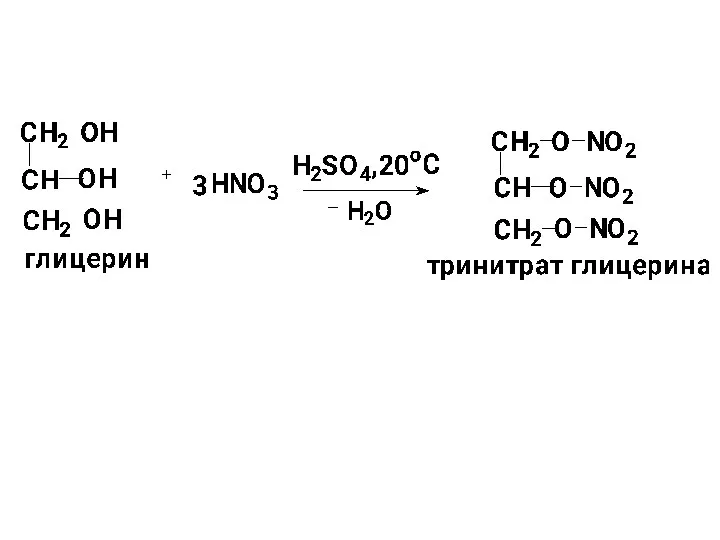
- 106. б) Взаимодействие спиртов с неорганическими О-содержащими кислотами В результате р-ций образуются сложные эфиры спиртов и неорганических
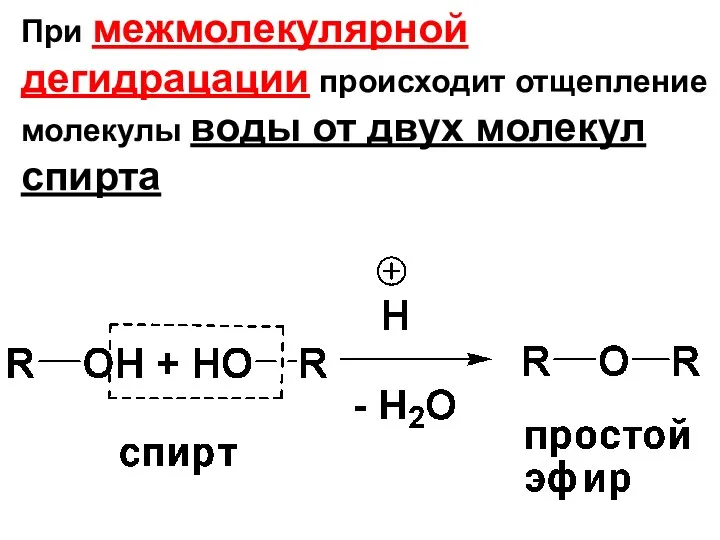
- 109. в) Межмолекулярная дегидратация спиртов – образование простых эфиров Внутримолекулярная дегидратация спиртов – способ получения алкенов (у
- 110. При межмолекулярной дегидрацации происходит отщепление молекулы воды от двух молекул спирта
- 111. Для р-ции требуется кислотный катализ (обычно H2SO4) и сравнительно невысокие т-ры (~130oC) Лучше всего реакция идет
- 112. Механизм реакции – нуклеофильное замещение протонированной ОН-группы (1 молекула – субстрат, другая – нуклеофил) Активация первичного
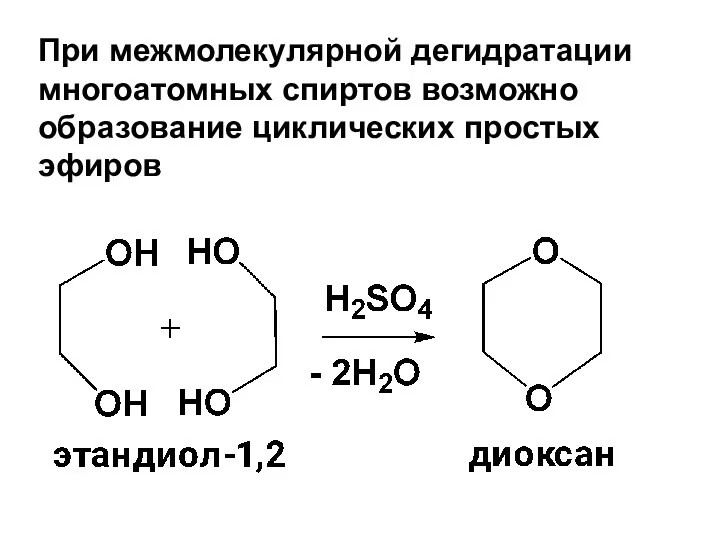
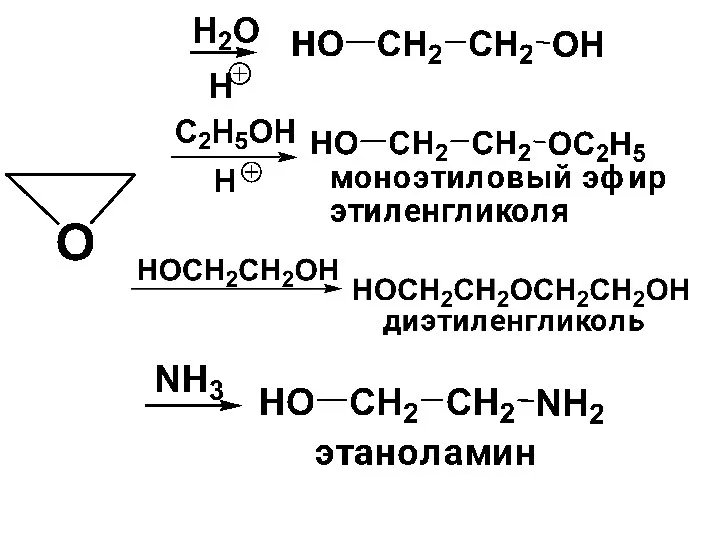
- 114. При межмолекулярной дегидратации многоатомных спиртов возможно образование циклических простых эфиров
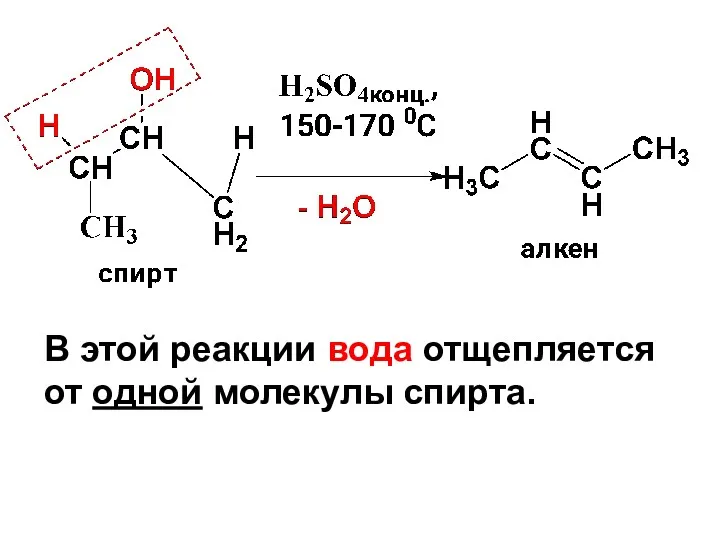
- 115. Внутримолекулярная дегидратация – получение алкенов Протекает как в жидкой так и в паровой фазе. При этом
- 116. В этой реакции вода отщепляется от одной молекулы спирта.
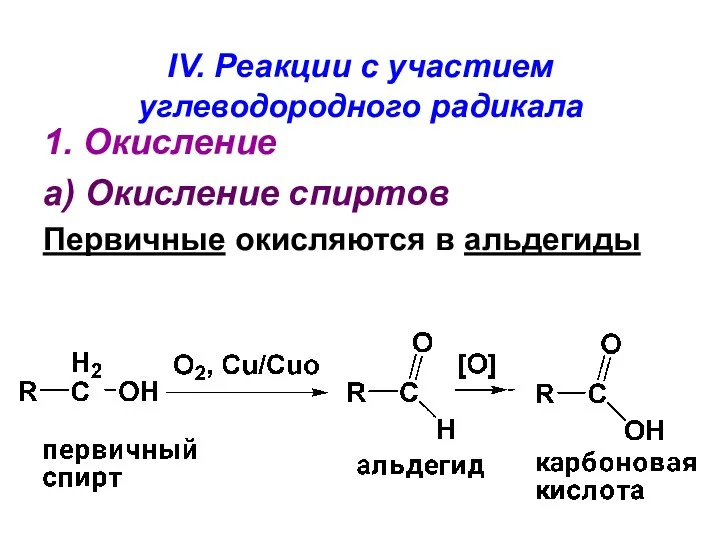
- 117. IV. Реакции с участием углеводородного радикала 1. Окисление а) Окисление спиртов Первичные окисляются в альдегиды
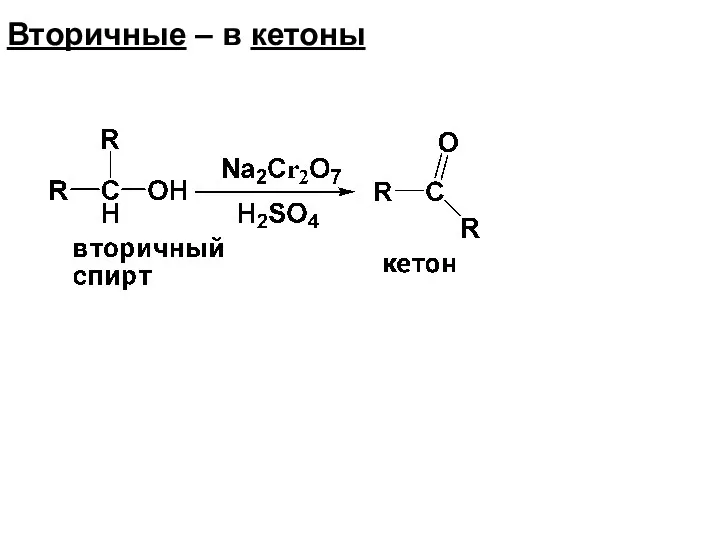
- 118. Вторичные – в кетоны
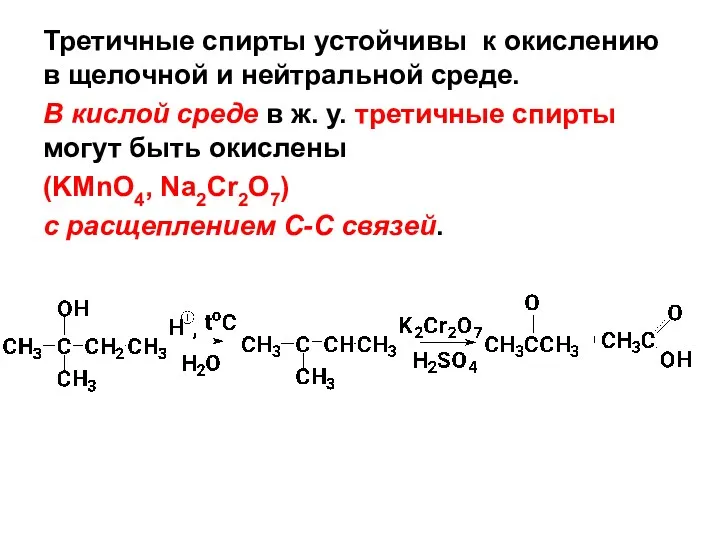
- 119. Третичные спирты устойчивы к окислению в щелочной и нейтральной среде. В кислой среде в ж. у.
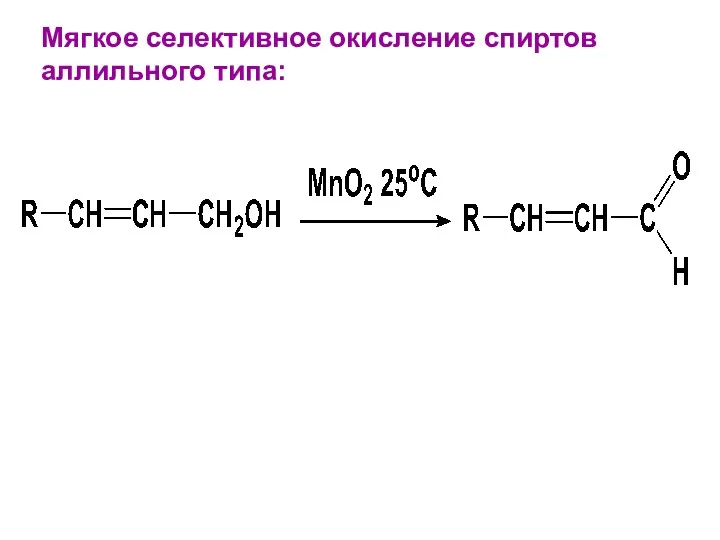
- 120. Мягкое селективное окисление спиртов аллильного типа:
- 121. Альдегиды и кетоны могут быть получены и в результате дегидрирования спиртов
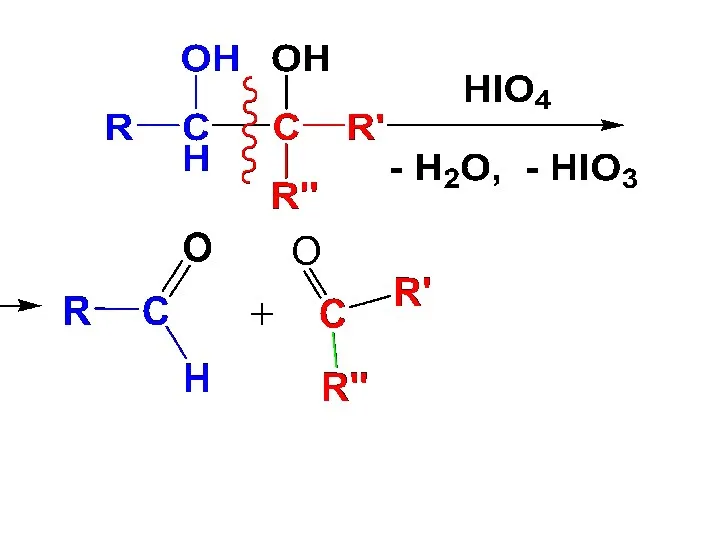
- 122. С увеличением числа ОН-групп легкость окисления возрастает Так, 1,2-диолы (α-гликоли) подвергаются окислению иодной кислотой. Реакция используется
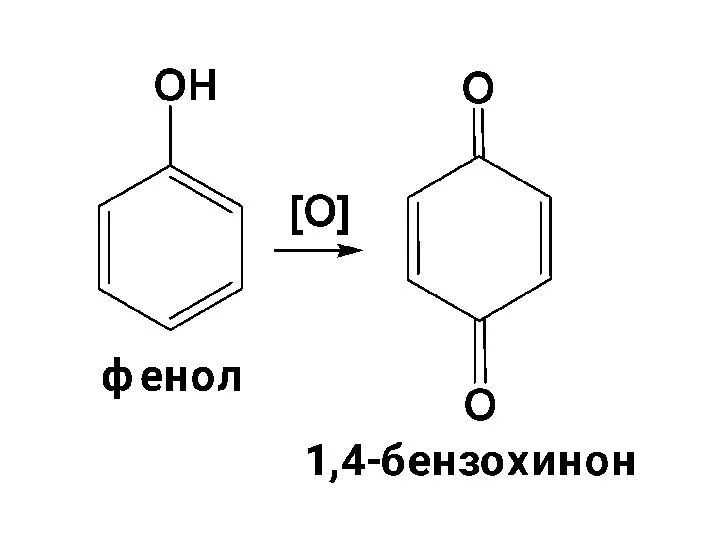
- 124. б) Окисление фенолов Фенолы сильно подвержены окислению. Первоначально образуется феноксильный радикал. Продуктами окисления фенолов являются хиноны.
- 126. Фенолы, содержащие в ароматическом цикле объемные заместители, представляют собой ловушки свободных R и используются в качестве
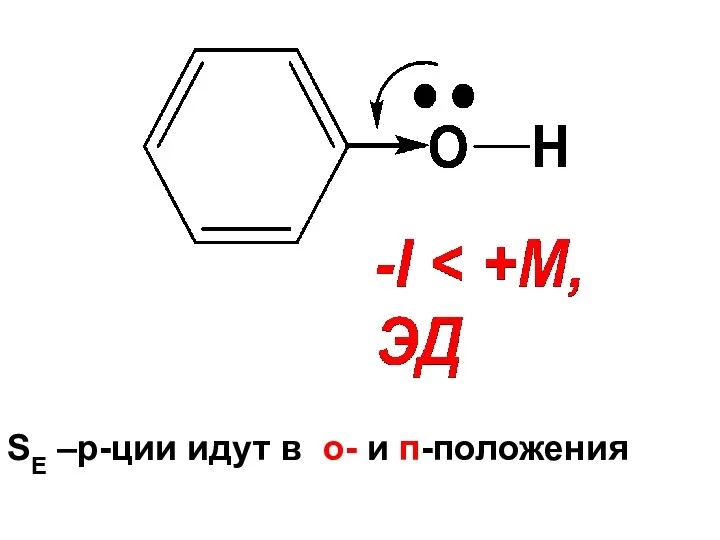
- 127. 2. SE –реакции бензольного кольца фенолов ОН-группа сильно активирует кольцо фенолов в реакциях SE, благодаря +М
- 128. SE –р-ции идут в о- и п-положения
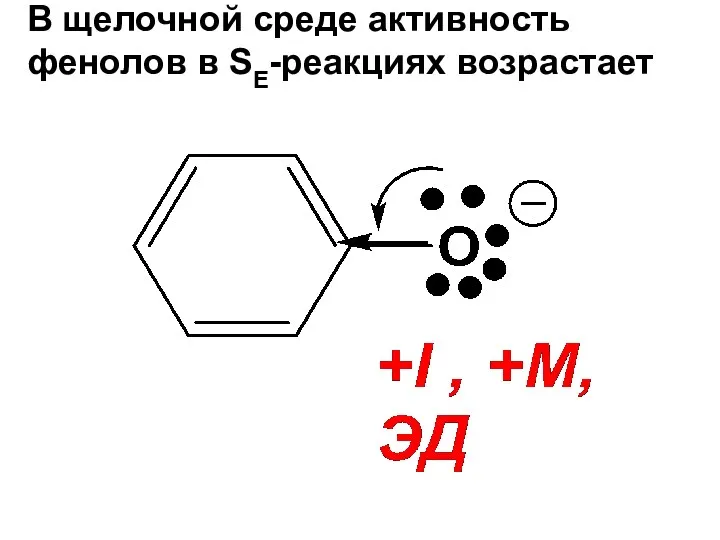
- 129. В щелочной среде активность фенолов в SE-реакциях возрастает
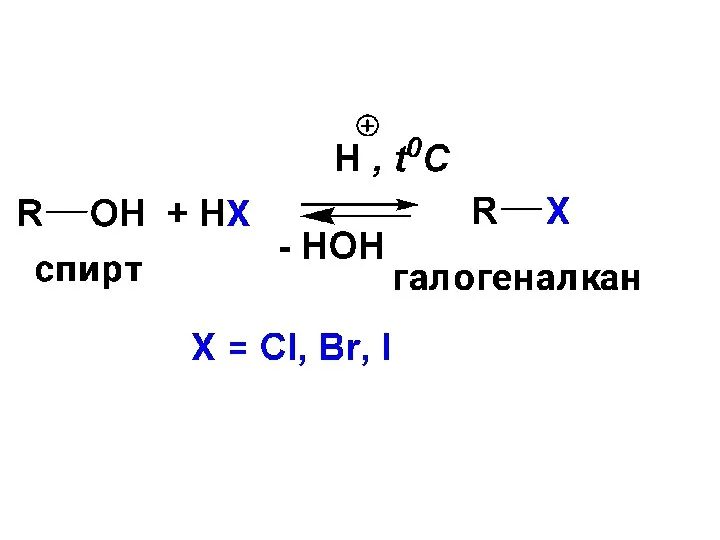
- 130. Характерны реакции: -галогенирования; - нитрования; - сульфирования; - ацилирования; - алкилирования; - нитрозирования; - азосочетания; -формиилирования;
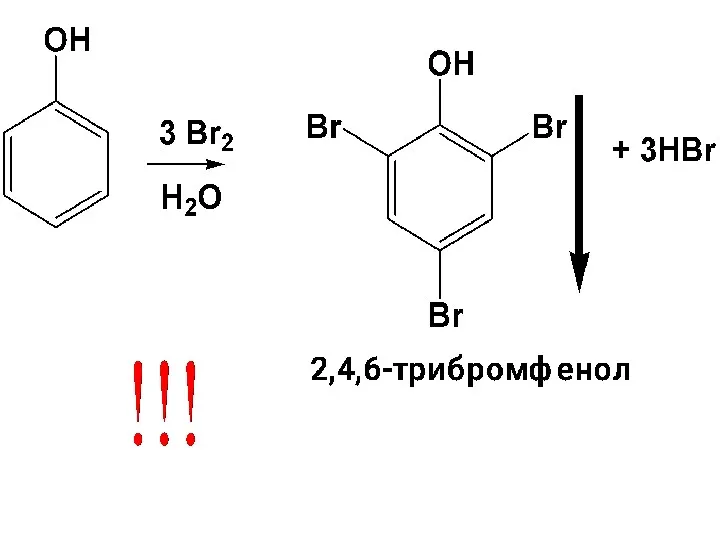
- 131. а) Галогенирование Протекает очень легко и не требует катализатора. Бромирование фенола в водных р-рах дает белый
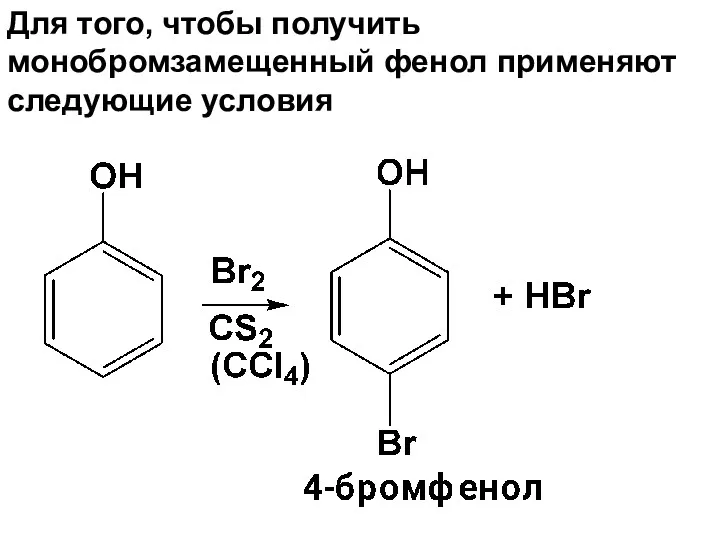
- 133. Для того, чтобы получить монобромзамещенный фенол применяют следующие условия
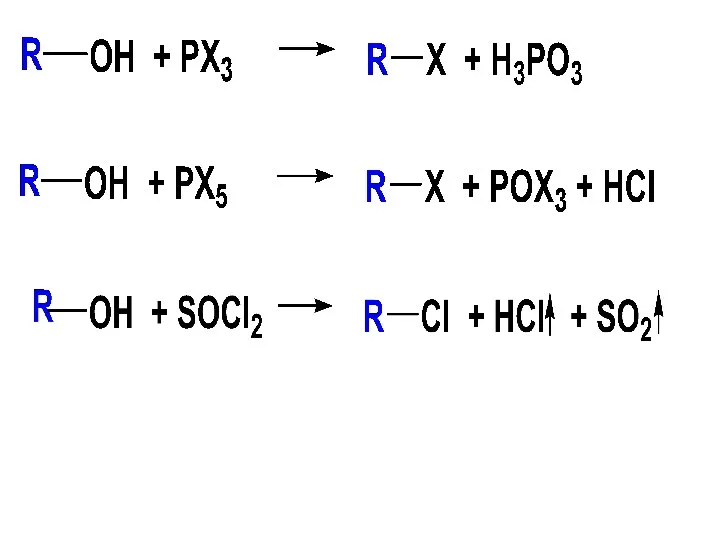
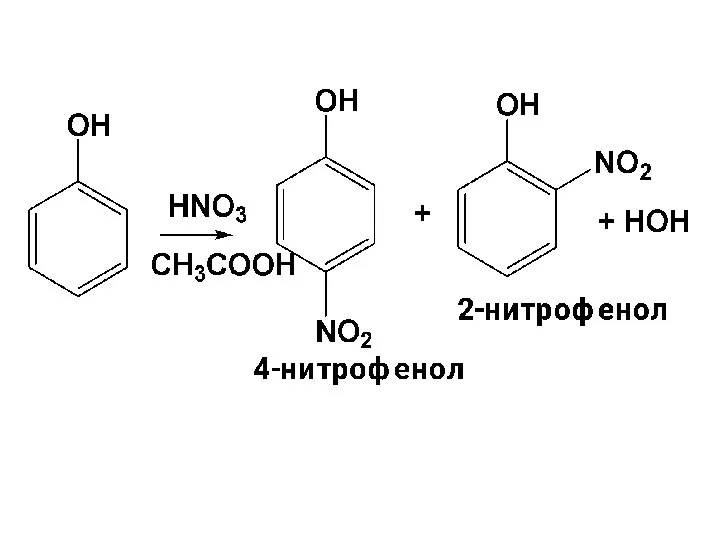
- 134. б) Нитрование Протекает легко. Не требуется H2SO4. Для нитрования применяют либо разб. (~ 20%) водный р-р
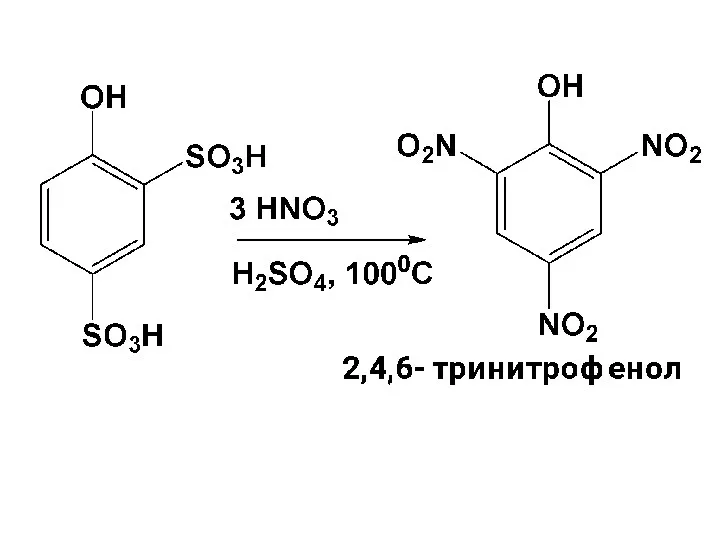
- 136. Конечным продуктом нитрования фенола является 2,4,6-тринитрофенол (пикриновая кислота). Однако прямым нитрованием фенола её не получают, т.к.
- 137. Поэтому фенол сначала сульфируют, что повышает его устойчивость к окислению и SE –реакциям. Затем осуществляют нитрование
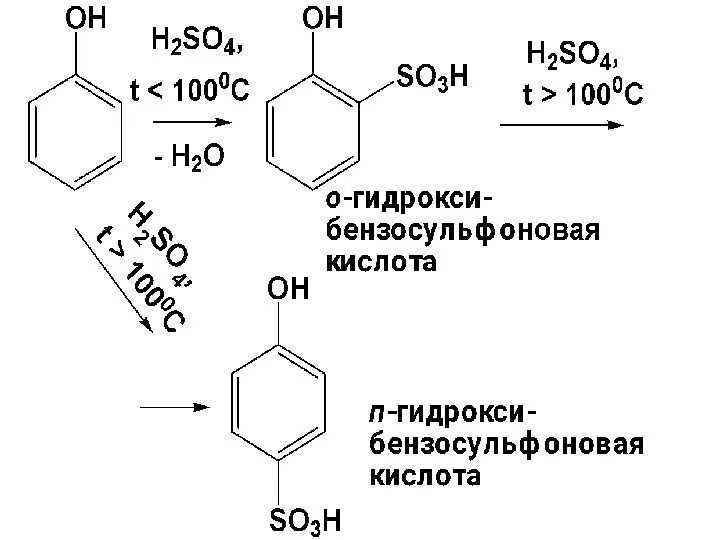
- 139. в) Сульфирование Приводит к образованию о- и п- фенолсульфоновых кислот. Соотношение изомеров определяется температурой проведения сульфирования
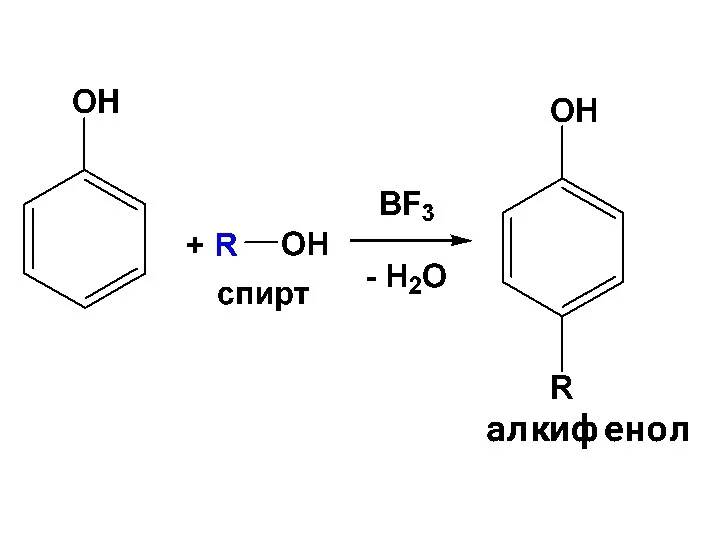
- 141. г) Алкилирование фенолов Для проведения р-ции по бензольному кольцу в качестве алкилирующих средств используются спирты или
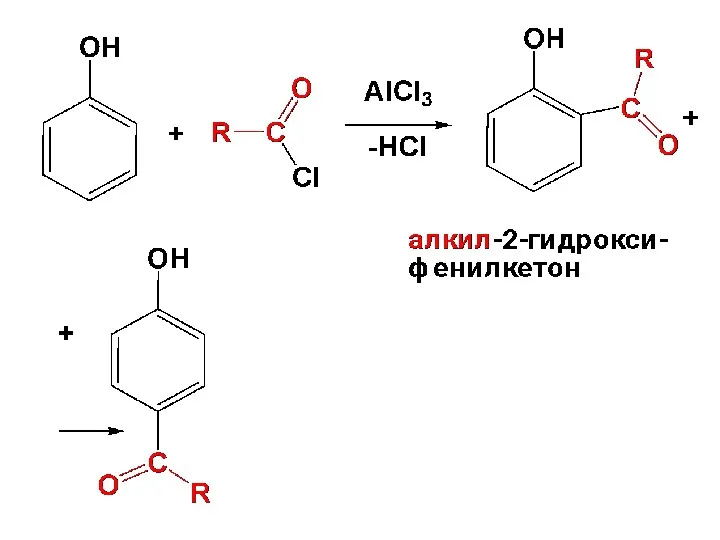
- 143. д) Ацилирование (по ароматическому кольцу) Взаимодействие фенолов С ангидридами и галогенангидридами карбоновых кислот в присутствии кислот
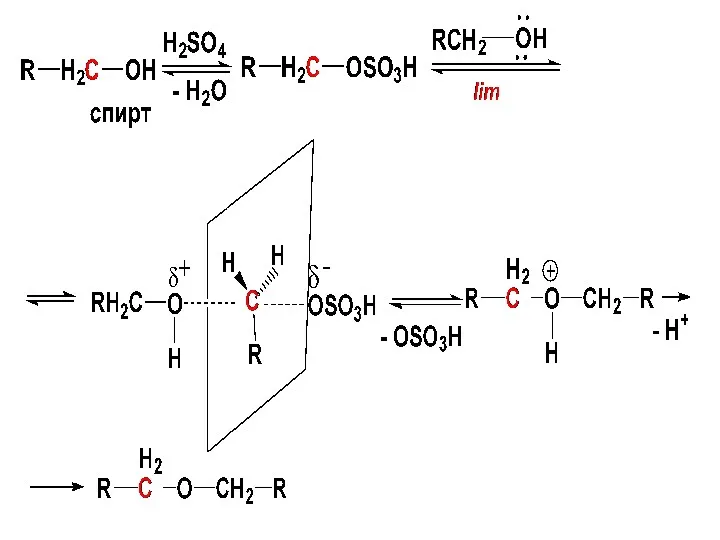
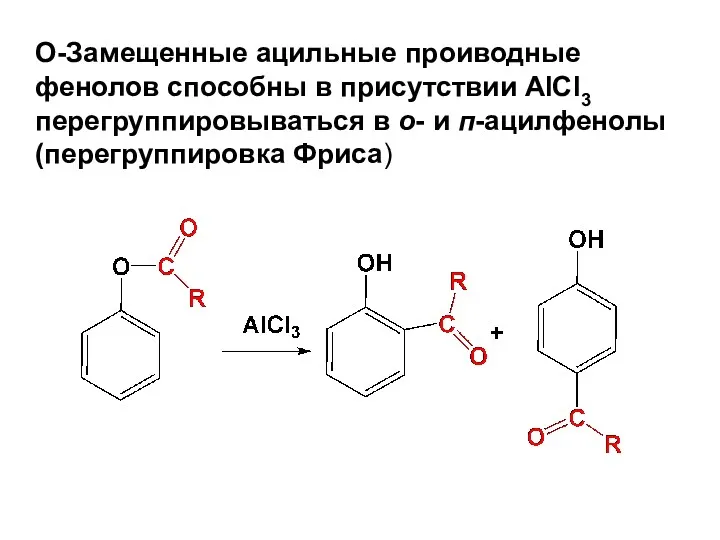
- 145. О-Замещенные ацильные проиводные фенолов способны в присутствии AlCl3 перегруппировываться в о- и п-ацилфенолы (перегруппировка Фриса)
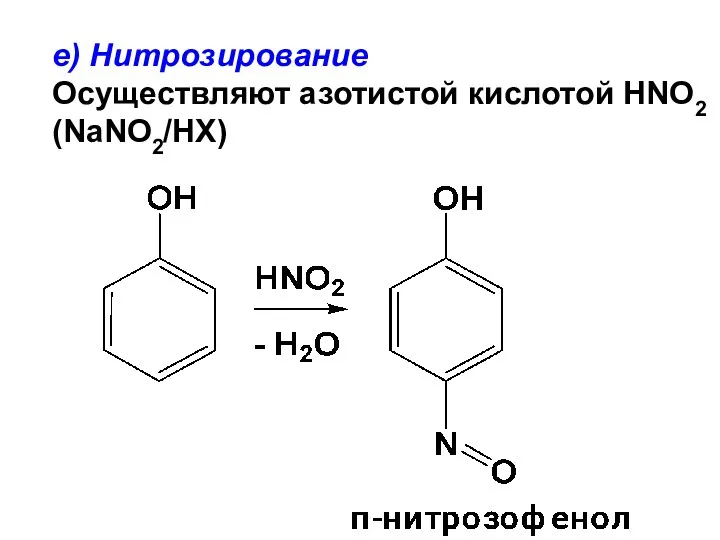
- 146. е) Нитрозирование Осуществляют азотистой кислотой HNO2 (NaNO2/HX)
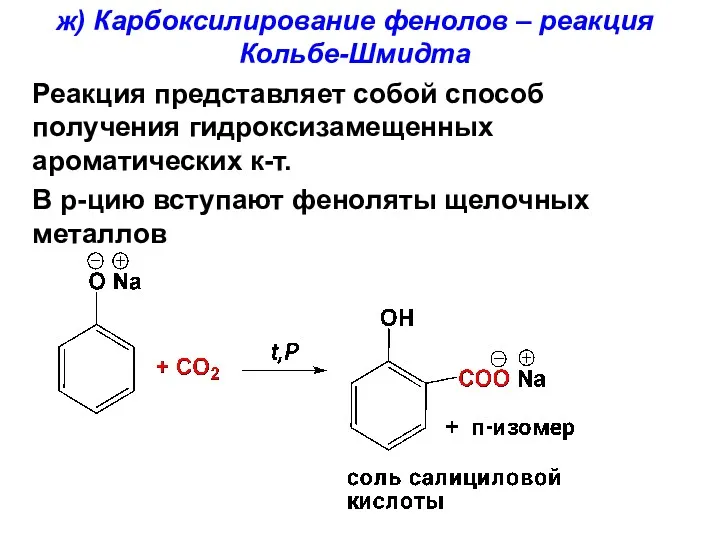
- 147. ж) Карбоксилирование фенолов – реакция Кольбе-Шмидта Реакция представляет собой способ получения гидроксизамещенных ароматических к-т. В р-цию
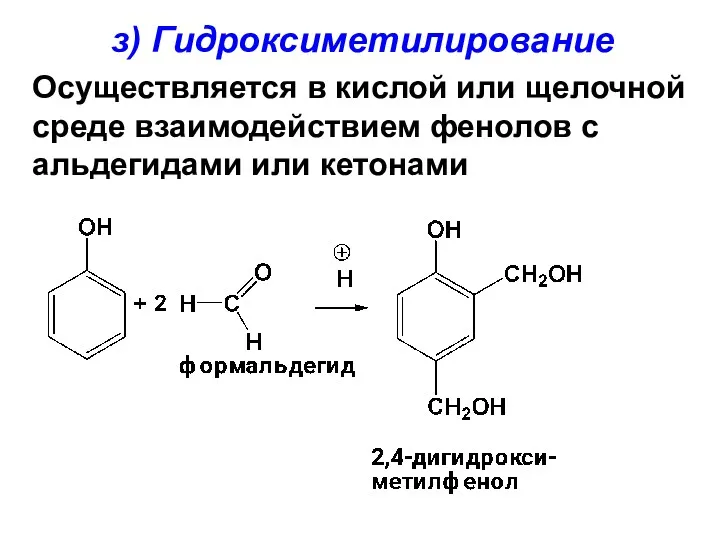
- 148. з) Гидроксиметилирование Осуществляется в кислой или щелочной среде взаимодействием фенолов с альдегидами или кетонами
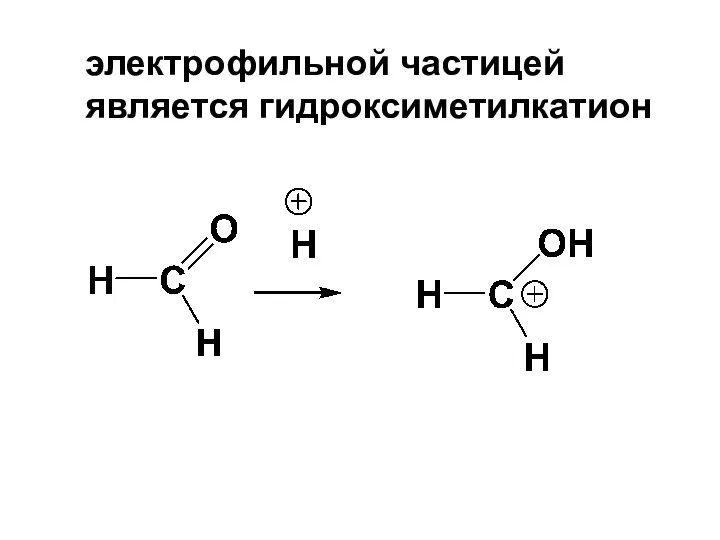
- 149. электрофильной частицей является гидроксиметилкатион
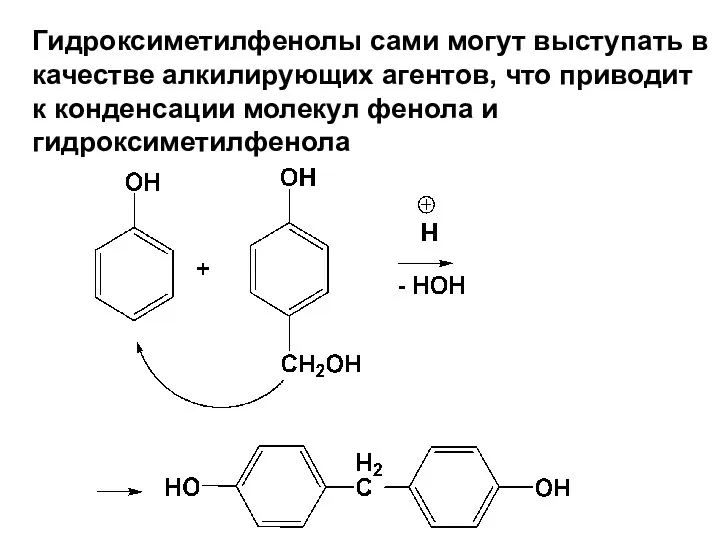
- 150. Гидроксиметилфенолы сами могут выступать в качестве алкилирующих агентов, что приводит к конденсации молекул фенола и гидроксиметилфенола
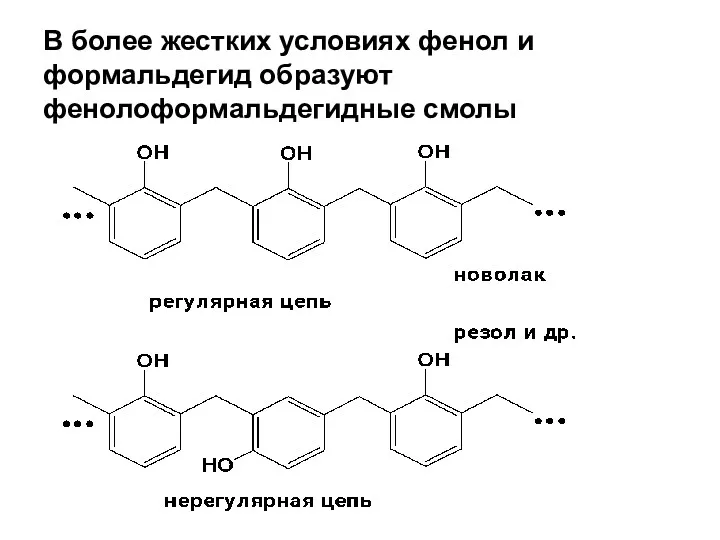
- 151. В более жестких условиях фенол и формальдегид образуют фенолоформальдегидные смолы
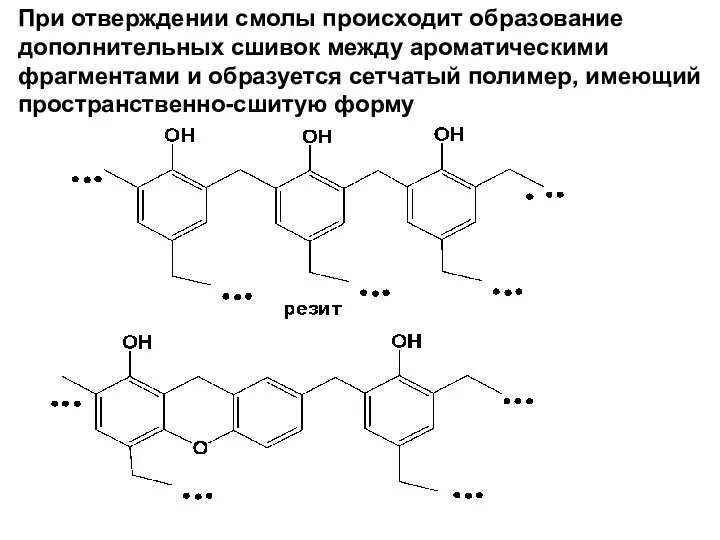
- 152. При отверждении смолы происходит образование дополнительных сшивок между ароматическими фрагментами и образуется сетчатый полимер, имеющий пространственно-сшитую
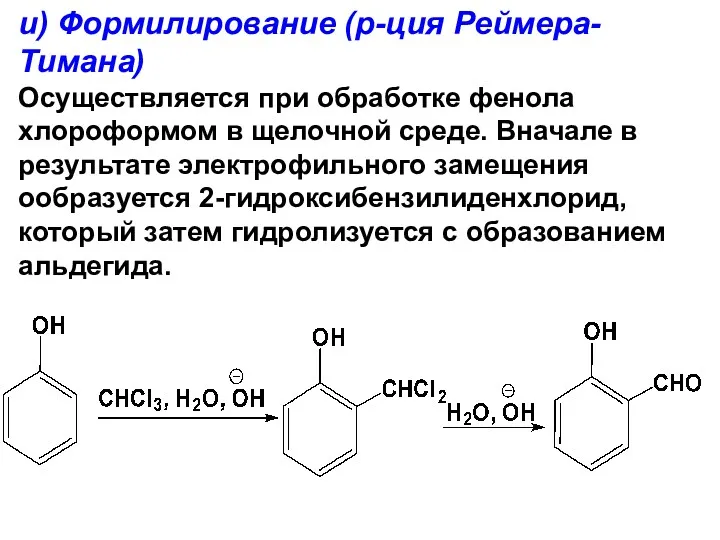
- 153. и) Формилирование (р-ция Реймера-Тимана) Осуществляется при обработке фенола хлороформом в щелочной среде. Вначале в результате электрофильного
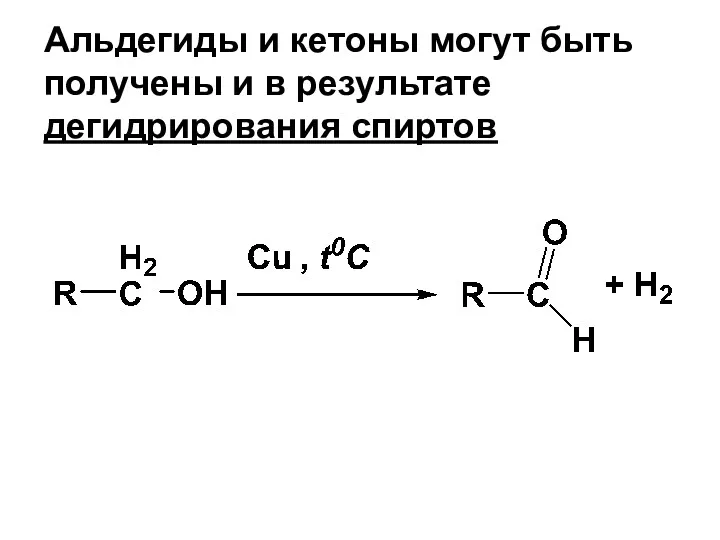
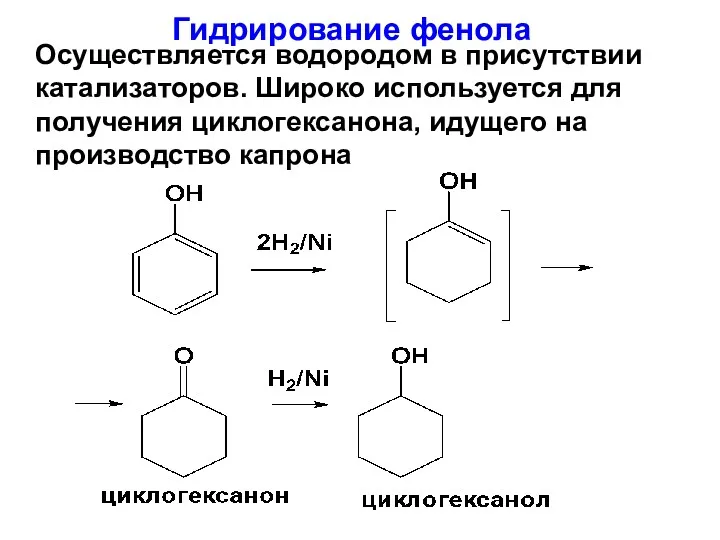
- 154. Гидрирование фенола Осуществляется водородом в присутствии катализаторов. Широко используется для получения циклогексанона, идущего на производство капрона
- 155. Важнейшие представители спиртов и фенолов Метанол - древесный спирт –Растворитель, в орг.синтезе Этанол – древнейший м-д
- 156. Аллиловый спирт – в пр-ве глицерина Бензиловый спирт – в парфюмерии и лакокрасочной пром-сти. Циклогексанол -
- 157. Этиленгликоль –→диэтиленгликоль, диоксан, простые эфиры, целлофан, полиуретаны. Глицерин -– в пр-ве взрывчатых в-в, алкидных смол, полиуретанов,
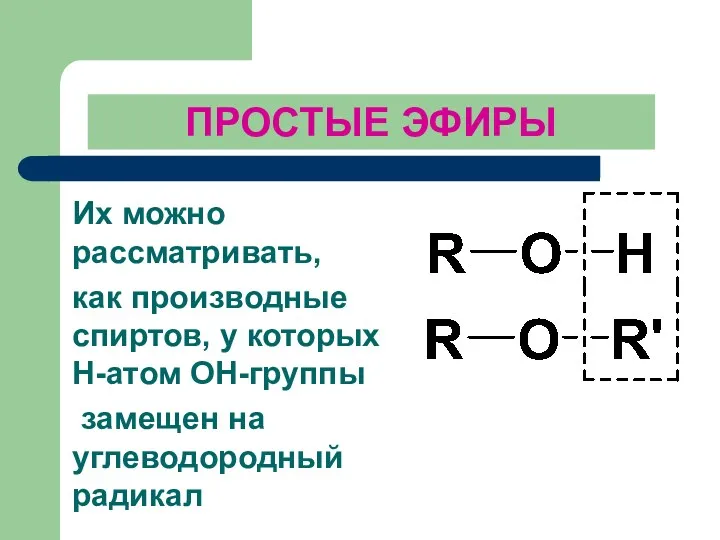
- 158. ПРОСТЫЕ ЭФИРЫ Их можно рассматривать, как производные спиртов, у которых Н-атом OH-группы замещен на углеводородный радикал
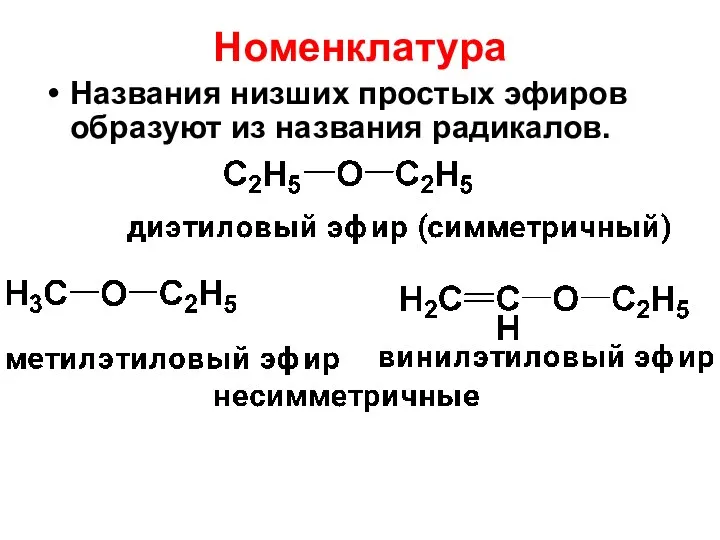
- 159. Номенклатура Названия низших простых эфиров образуют из названия радикалов.
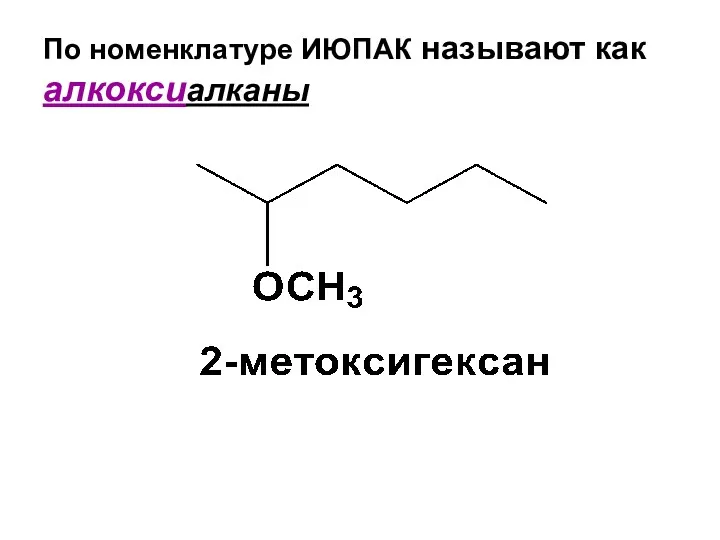
- 160. По номенклатуре ИЮПАК называют как алкоксиалканы
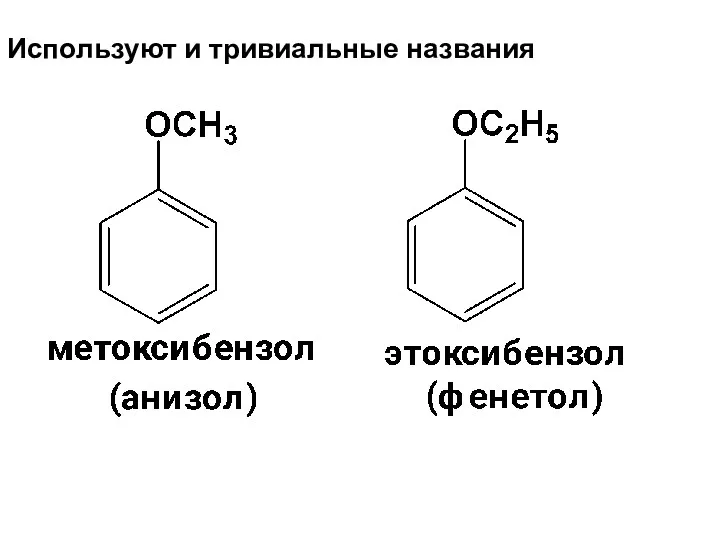
- 161. Используют и тривиальные названия
- 162. Способы получения 1). Синтез Вильямсона. 2) Алкилалкиловые – р-цией межмолекулярной дегидратации. 3) Виниловые – присоединением спиртов
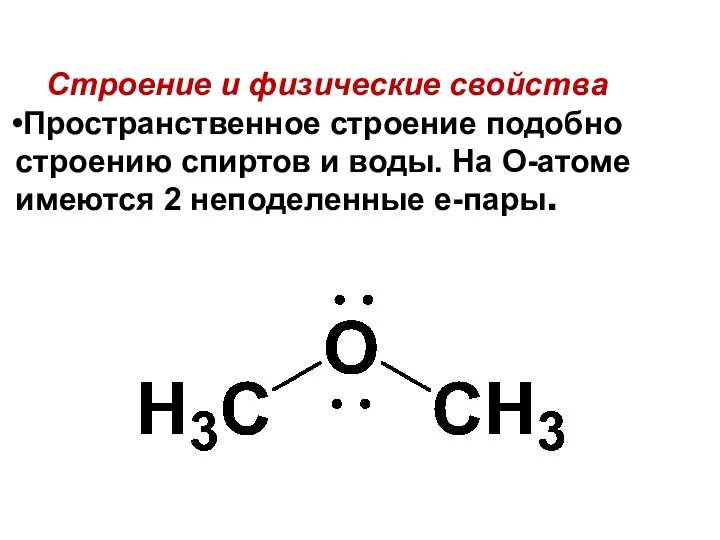
- 163. Строение и физические свойства Пространственное строение подобно строению спиртов и воды. На О-атоме имеются 2 неподеленные
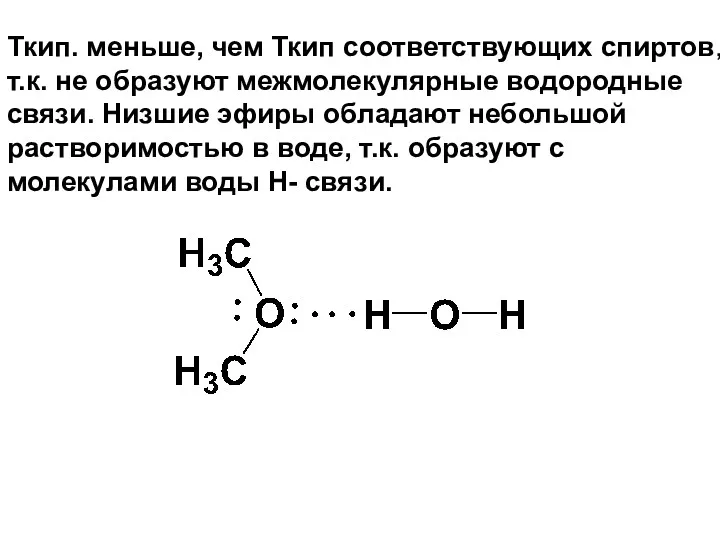
- 164. Ткип. меньше, чем Ткип соответствующих спиртов, т.к. не образуют межмолекулярные водородные связи. Низшие эфиры обладают небольшой
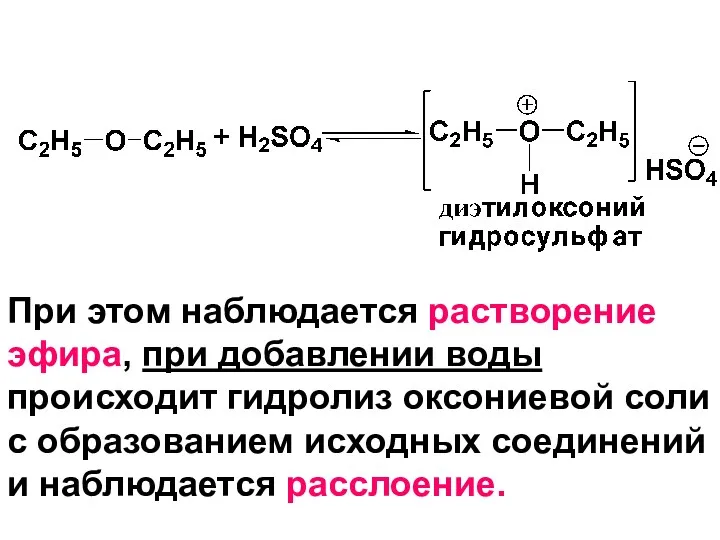
- 165. Химические свойства Простые эфиры довольно инертны. Простая эфирная связь устойчива к действию оснований, окислителей, разбавленных кислот.
- 166. При этом наблюдается растворение эфира, при добавлении воды происходит гидролиз оксониевой соли с образованием исходных соединений
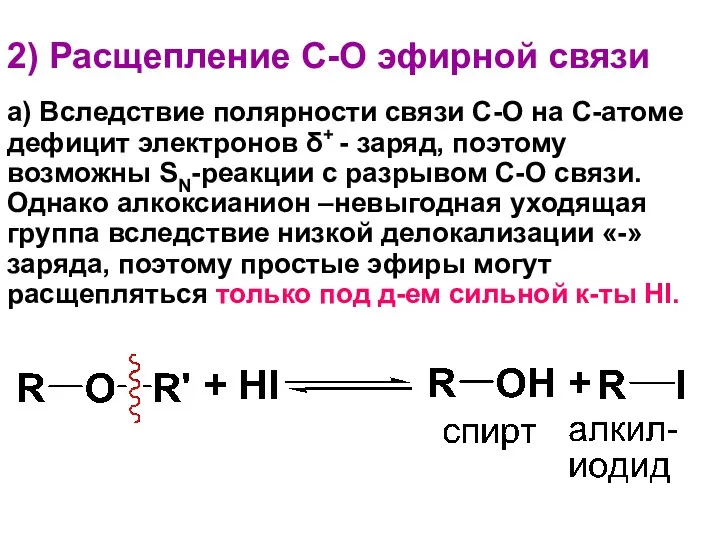
- 167. 2) Расщепление С-О эфирной связи а) Вследствие полярности связи С-О на С-атоме дефицит электронов δ+ -
- 168. Механизм реакции SN1 или SN2 после предварительного протонирования (подобно спиртам). Протонирование приводит к увеличению полярности связи
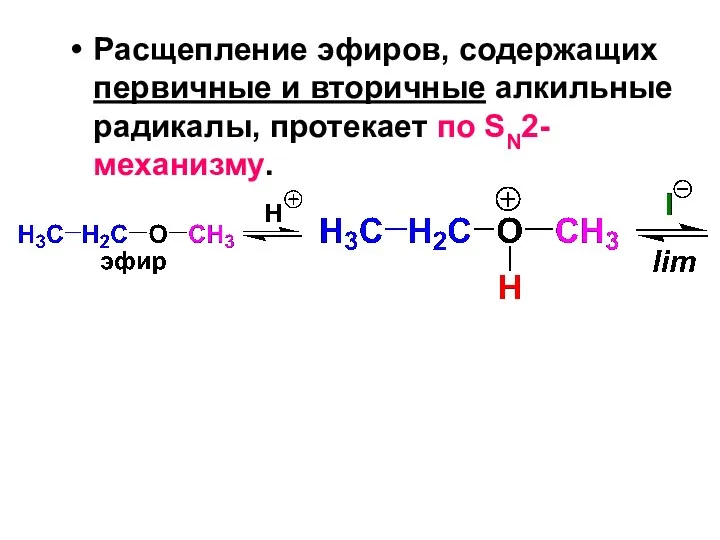
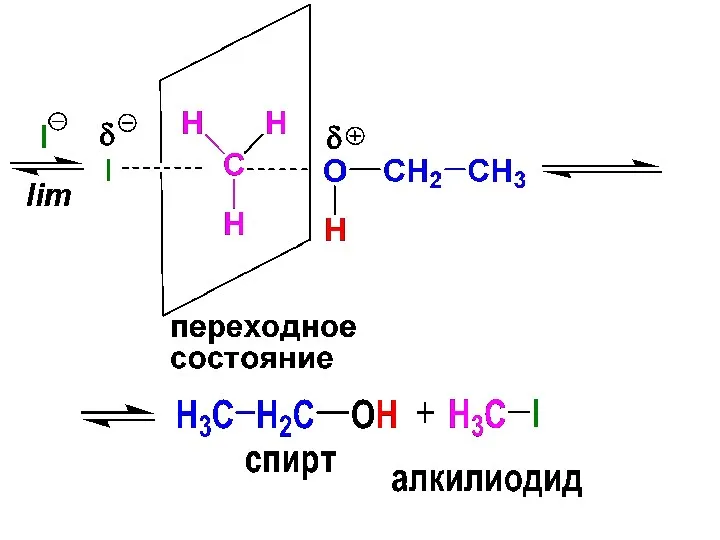
- 169. Расщепление эфиров, содержащих первичные и вторичные алкильные радикалы, протекает по SN2-механизму.
- 171. Расщепление эфиров, содержащих третичные алкильные радикалы, протекает по SN1-механизму
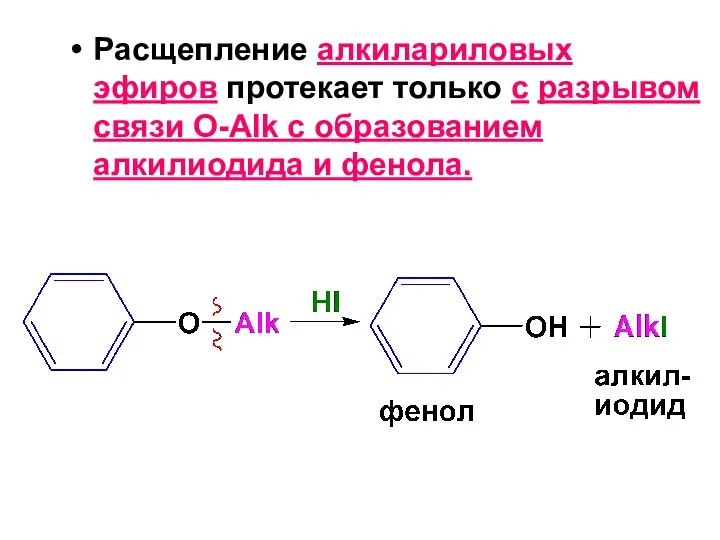
- 172. Расщепление алкилариловых эфиров протекает только с разрывом связи О-Alk с образованием алкилиодида и фенола.
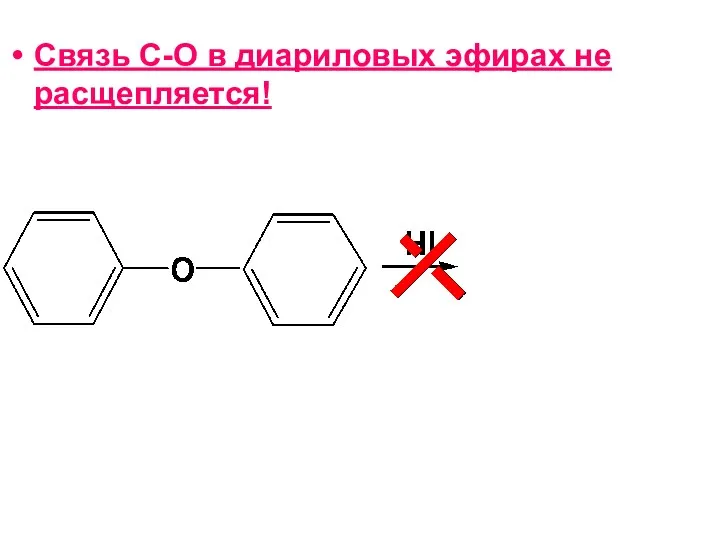
- 173. Связь С-О в диариловых эфирах не расщепляется!
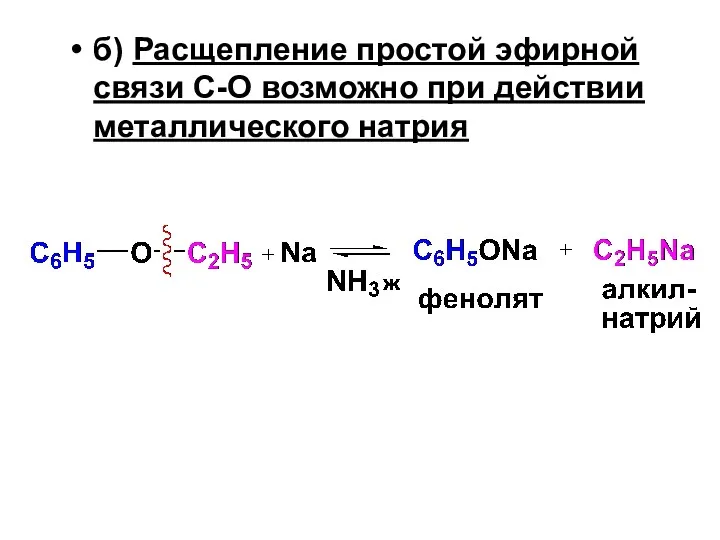
- 174. б) Расщепление простой эфирной связи С-О возможно при действии металлического натрия
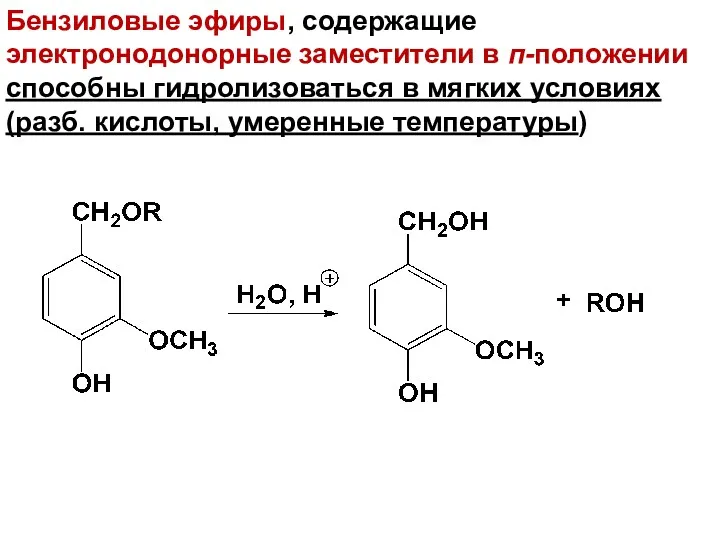
- 175. Бензиловые эфиры, содержащие электронодонорные заместители в п-положении способны гидролизоваться в мягких условиях (разб. кислоты, умеренные температуры)
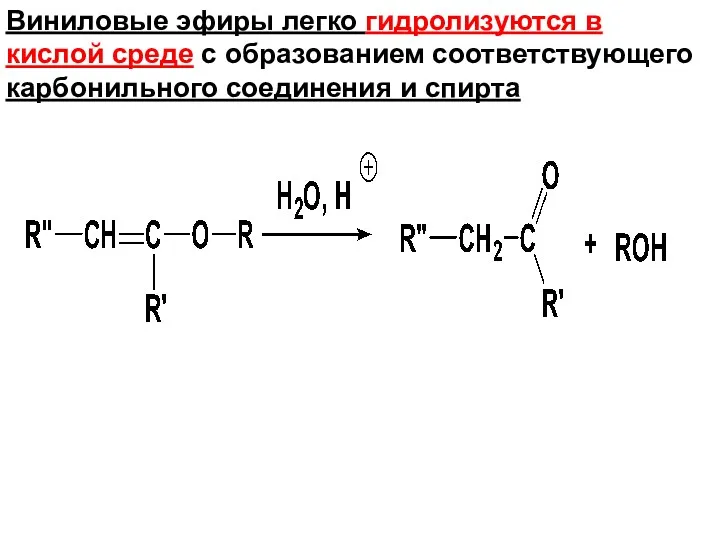
- 176. Виниловые эфиры легко гидролизуются в кислой среде с образованием соответствующего карбонильного соединения и спирта
- 177. 3. Автоокисление Большим недостатком алифатических простых эфиров является их автоокисление - под действием света и воздуха
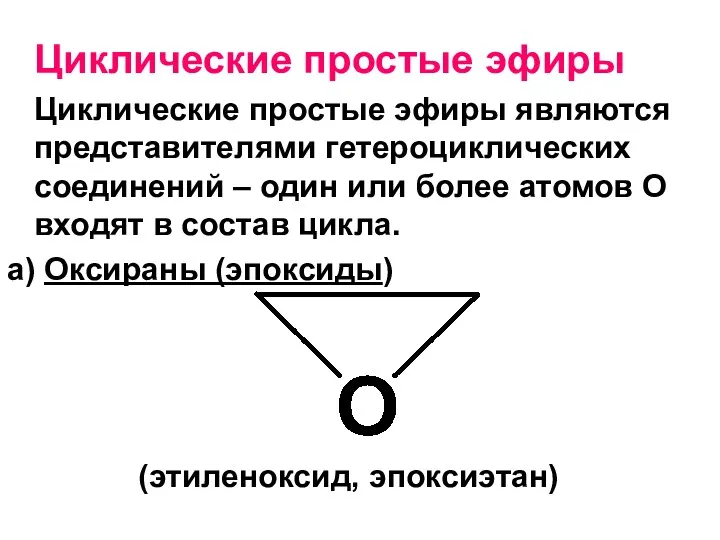
- 178. Циклические простые эфиры Циклические простые эфиры являются представителями гетероциклических соединений – один или более атомов О
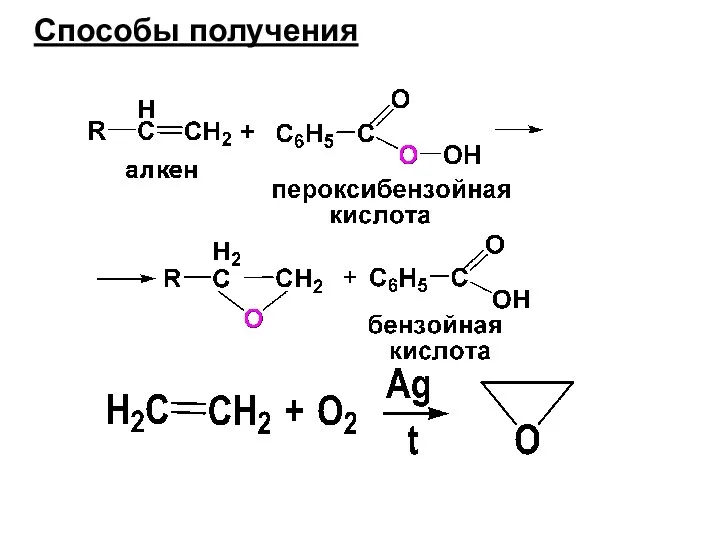
- 179. Способы получения
- 180. Реакции Эпоксиды – трехчленные циклы, неустойчивы, обладают высокой реакционной способностью. Под действием нуклеофильных реагентов вступают в
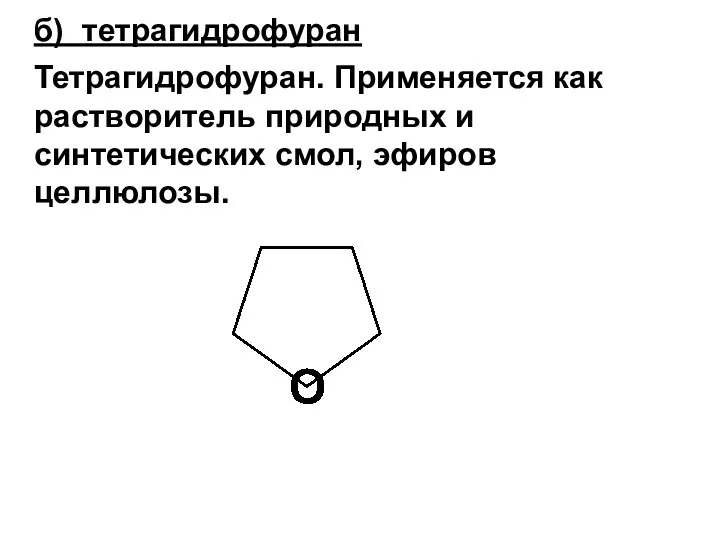
- 182. б) тетрагидрофуран Тетрагидрофуран. Применяется как растворитель природных и синтетических смол, эфиров целлюлозы.
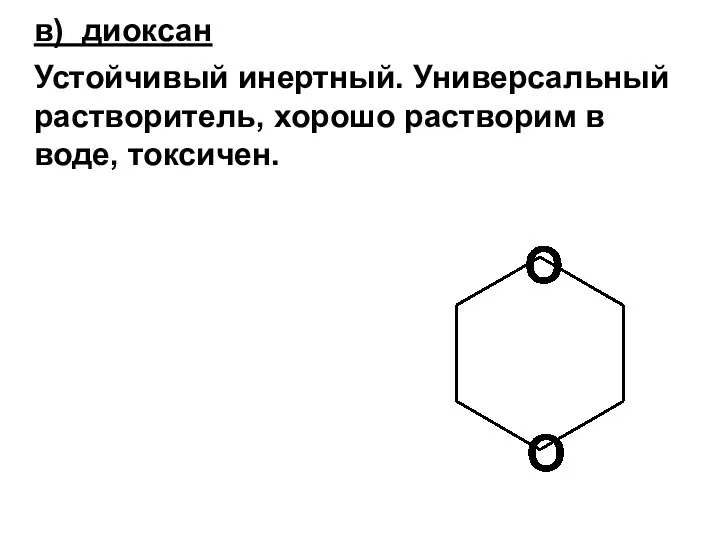
- 183. в) диоксан Устойчивый инертный. Универсальный растворитель, хорошо растворим в воде, токсичен.
- 185. Скачать презентацию































































 Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16)
Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16) Уральские горы. Самоцветы
Уральские горы. Самоцветы Аминокислоты
Аминокислоты Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ Рафинирование от растворимых окислов
Рафинирование от растворимых окислов Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Стирка по научному
Стирка по научному Si - Silicon. Distribute Properties
Si - Silicon. Distribute Properties Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Таблица элементов
Таблица элементов Аккумуляторные батареи
Аккумуляторные батареи Алкены. Полиэтилен
Алкены. Полиэтилен Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу
Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу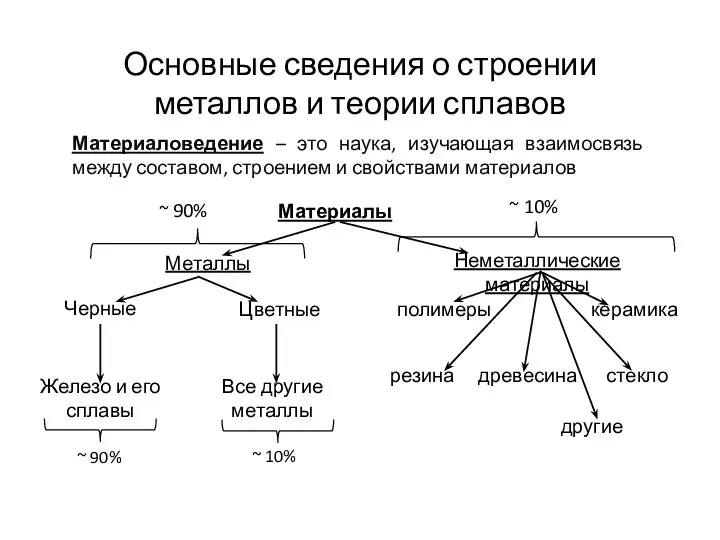 Основные сведения о строении металлов и теории сплавов
Основные сведения о строении металлов и теории сплавов Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Моторные масла
Моторные масла Використання хімічних явищ у художній творчості й народних ремеслах
Використання хімічних явищ у художній творчості й народних ремеслах Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Основания. Получение и химические свойства
Основания. Получение и химические свойства Утворення асимілятів та їхнє перетворення
Утворення асимілятів та їхнє перетворення 20231110_amfoternye_oksidy_i_gidroksidy
20231110_amfoternye_oksidy_i_gidroksidy Крохмаль. Структурна формула крохмалю
Крохмаль. Структурна формула крохмалю Удивительные свойства воды
Удивительные свойства воды Каменный уголь. Фенол
Каменный уголь. Фенол История мыловарения
История мыловарения