Содержание
- 2. Химия - это физика внешней электронной оболочки атома. Химия - наука, изучающая строение веществ и их
- 3. Дмитрий Иванович Менделеев (27 января (8 февраля) 1834, Тобольск — 20 января (2 февраля) 1907, Санкт-Петербург)
- 4. И.Н. Крамской Д. И. Менделеев. 1878. Масло Илья Репин. Портрет Д. И. Менделеева в мантии доктора
- 5. Таблица элементов Так выглядел первый вариант таблицы элементов, составленный Менделеевым в 1869 году. Д. Менделеев и
- 6. Координационные (комплексные) соединения (КС) Датский химик Свен Иергенсен (1837-1914) Швейцарский химик Альфред Вернер (1866-1919)
- 7. В 1913 году шведский король Густав V вручил Альфреду Вернеру золотую медаль лауреата Нобелевской премии и
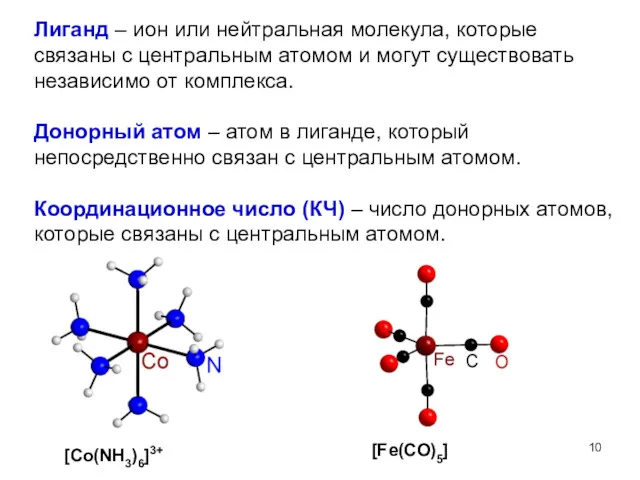
- 8. [Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение (соль). [Fe(CO)5] – комплекс и комплексное соединение Комплекс означает
- 9. Строение комплексного соединения K3 [Fe(CN)6] Ион-комплексообразователь (центральный атом) Лиганды Координационное число Внутренняя сфера Внешняя сфера
- 10. Лиганд – ион или нейтральная молекула, которые связаны с центральным атомом и могут существовать независимо от
- 11. Донорно-акцепторный механизм: лиганд предоставляет электронную пару (основание Льюиса), а центральный атом вакантную орбиталь (кислота Льюиса). Координационные
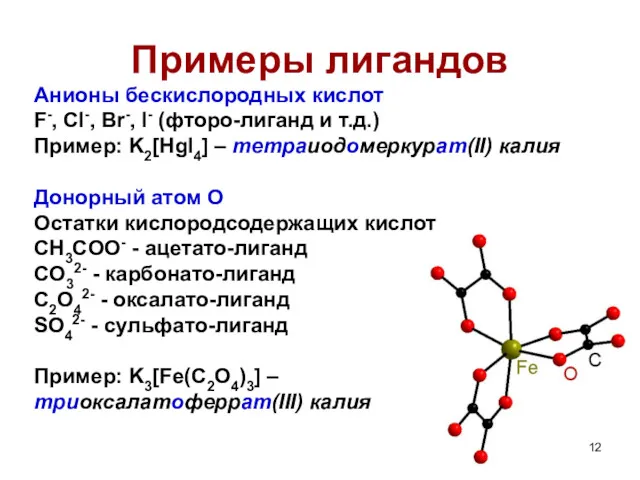
- 12. Примеры лигандов Анионы бескислородных кислот F-, Cl-, Br-, I- (фторо-лиганд и т.д.) Пример: K2[HgI4] – тетраиодомеркурат(II)
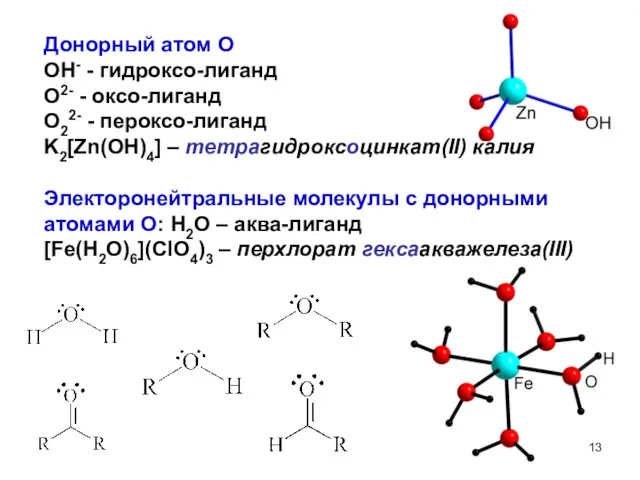
- 13. Донорный атом O OH- - гидроксо-лиганд O2- - оксо-лиганд O22- - пероксо-лиганд K2[Zn(OH)4] – тетрагидроксоцинкат(II) калия
- 14. Электоронейтральные молекулы с донорными атомами N NH3 – аммин (лиганд) R-NH2 – амин (лиганд) Пиридин (Py)
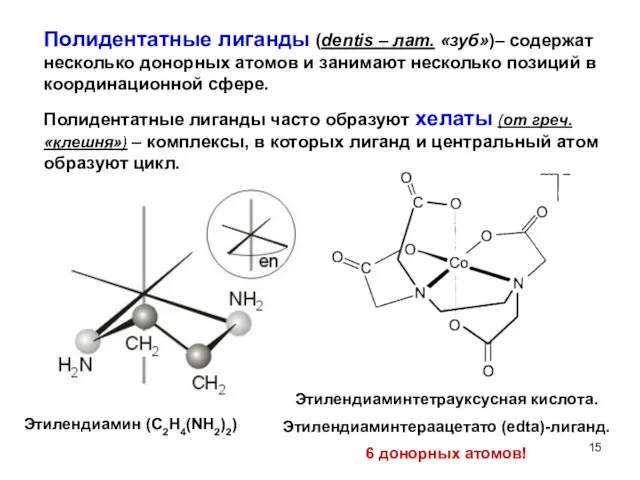
- 15. Полидентатные лиганды (dentis – лат. «зуб»)– содержат несколько донорных атомов и занимают несколько позиций в координационной
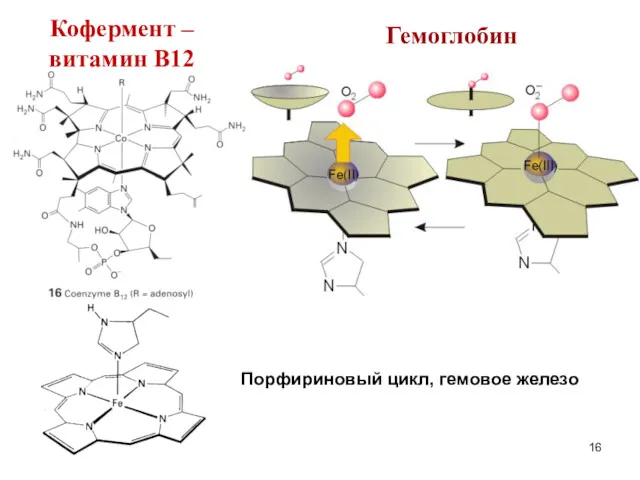
- 16. Гемоглобин Порфириновый цикл, гемовое железо Кофермент – витамин В12
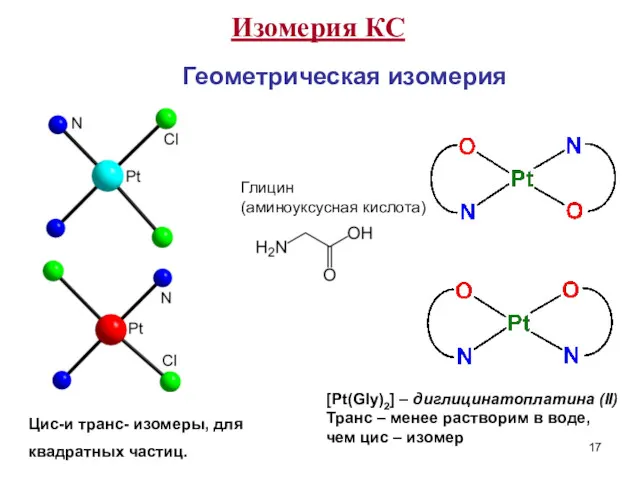
- 17. Изомерия КС Геометрическая изомерия Цис-и транс- изомеры, для квадратных частиц. [Pt(Gly)2] – диглицинатоплатина (II) Транс –
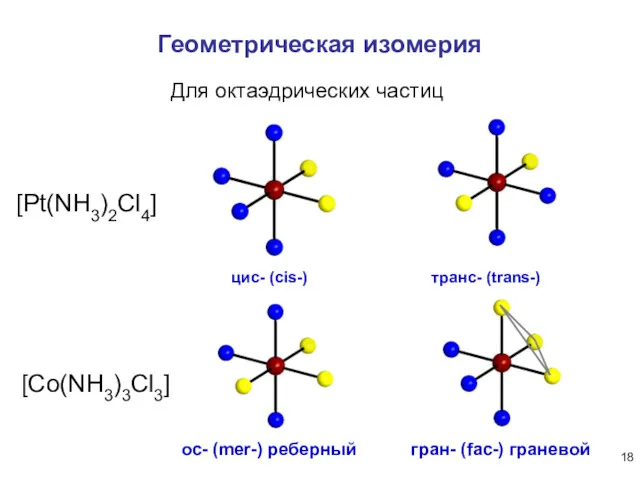
- 18. Геометрическая изомерия ос- (mer-) реберный гран- (fac-) граневой Для октаэдрических частиц [Pt(NH3)2Cl4] [Co(NH3)3Cl3] транс- (trans-) цис-
- 19. Ионизационная изомерия Лиганды во внутренней и внешней координационной сфере меняются местами. [Co(NH3)5Cl]CN – пентаамминхлорокобальт (II) цианид
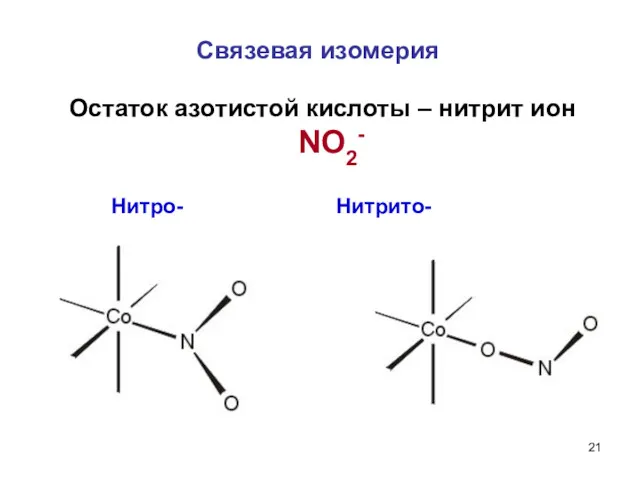
- 20. Связевая изомерия Характерна для комплексов с амбидентатными лигандами. Амбидентатный лиганд – лиганд, который может быть связан
- 21. Связевая изомерия Нитро- Нитрито- Остаток азотистой кислоты – нитрит ион NO2-
- 22. Координационная изомерия для комплексных солей, в которых и катион и анион являются комплексными (CuPt (NH3)4Cl4) [Cu(NH3)4][PtCl4]
- 23. Координационная полимерия связана с изменение молекулярной массы комплексного соединения (PtCl2(NH3)2)n [Pt(NH3)2Cl2] – один атом платины, оба
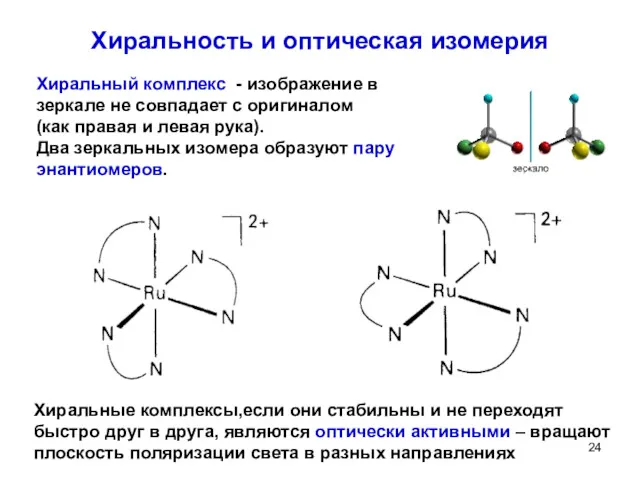
- 24. Хиральность и оптическая изомерия Хиральный комплекс - изображение в зеркале не совпадает с оригиналом (как правая
- 25. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА КОМПЛЕКСОВ Cd2+ + CN- = [Cd(CN)+] K1 = [Cd(CN)+]/[Cd2+][CN-] [Cd(CN)+] + CN- = [Cd(CN)2]
- 26. Константа образования характеризует устойчивость комплексов (в водных растворах). Константа образования характеризует прочность связывания лиганда с металлом
- 28. Скачать презентацию






![[Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение (соль). [Fe(CO)5] –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/124701/slide-7.jpg)
![Строение комплексного соединения K3 [Fe(CN)6] Ион-комплексообразователь (центральный атом) Лиганды Координационное число Внутренняя сфера Внешняя сфера](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/124701/slide-8.jpg)






![ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА КОМПЛЕКСОВ Cd2+ + CN- = [Cd(CN)+] K1 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/124701/slide-24.jpg)

 Топливо и топливосжигающие устройства
Топливо и топливосжигающие устройства большая стирка
большая стирка Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Redox reactions
Redox reactions Железо. Fe (лат. Феррум)
Железо. Fe (лат. Феррум) Фармацевтическая химия натрия гидрокарбоната
Фармацевтическая химия натрия гидрокарбоната Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Диссоциация воды. Водородный и гидроксильный показатели (рН и рОН)
Диссоциация воды. Водородный и гидроксильный показатели (рН и рОН) Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Занимательные опыты
Занимательные опыты Валентність. Хімія. 7 клас
Валентність. Хімія. 7 клас Химические уравнения. Типы химических реакций. А что такое химическая реакция?
Химические уравнения. Типы химических реакций. А что такое химическая реакция? Электронные конфигурации атомов
Электронные конфигурации атомов Общая характеристика неметаллов
Общая характеристика неметаллов Кремний и его соединения
Кремний и его соединения Химия нефти и газа
Химия нефти и газа яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis Закон сохранения массы веществ
Закон сохранения массы веществ Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Щелочноземельные металлы
Щелочноземельные металлы Значення хімії у повсякденному житті
Значення хімії у повсякденному житті Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Теория растворов электролитов и неэлектролитов
Теория растворов электролитов и неэлектролитов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Кремний и его соединения
Кремний и его соединения Химическая связь и ее типы
Химическая связь и ее типы Превращение веществ
Превращение веществ