Содержание
- 2. Fe (лат. Феррум)
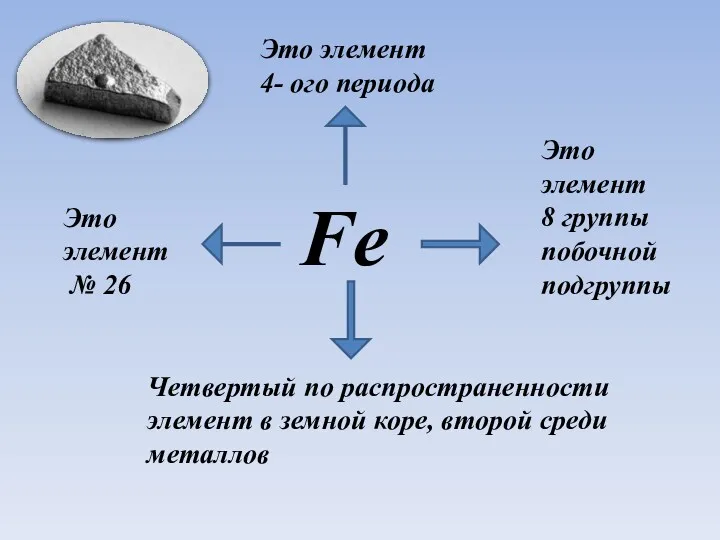
- 3. Fe Это элемент № 26 Это элемент 4- ого периода Четвертый по распространенности элемент в земной
- 4. Электронное строение железа
- 5. Железо – восстановитель. Атомы Fe отдают электроны не только с последнего уровня, приобретая С.О.+2, но способны
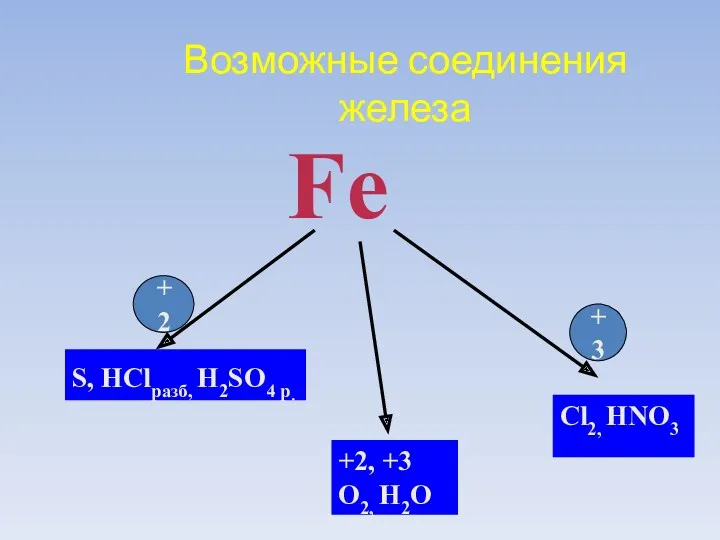
- 6. Возможные соединения железа Fe S, HСlразб, H2SO4 р. Cl2, HNO3 +2, +3 O2, H2O +2 +3
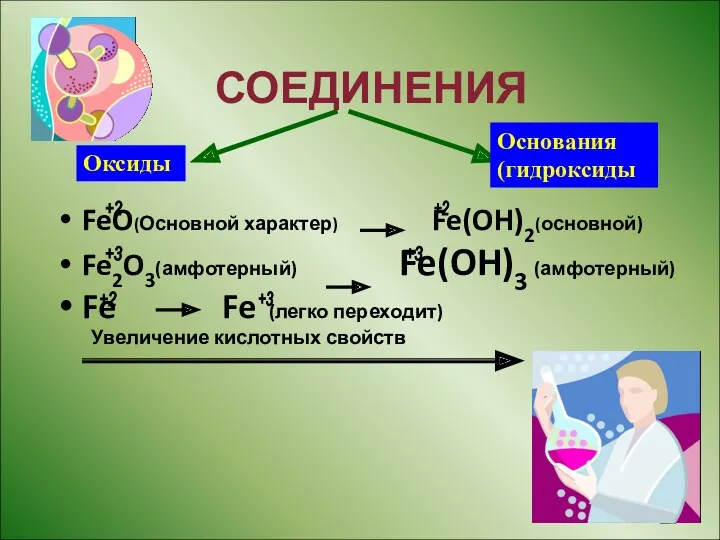
- 7. СОЕДИНЕНИЯ FeO(Основной характер) Fe(OH)2(основной) Fe2O3(амфотерный) Fe(OH)3 (амфотерный) Fe Fe (легко переходит) Увеличение кислотных свойств Оксиды Основания
- 8. Нахождение в природе В земной коре железо распространено достаточно широко — на его долю приходится около
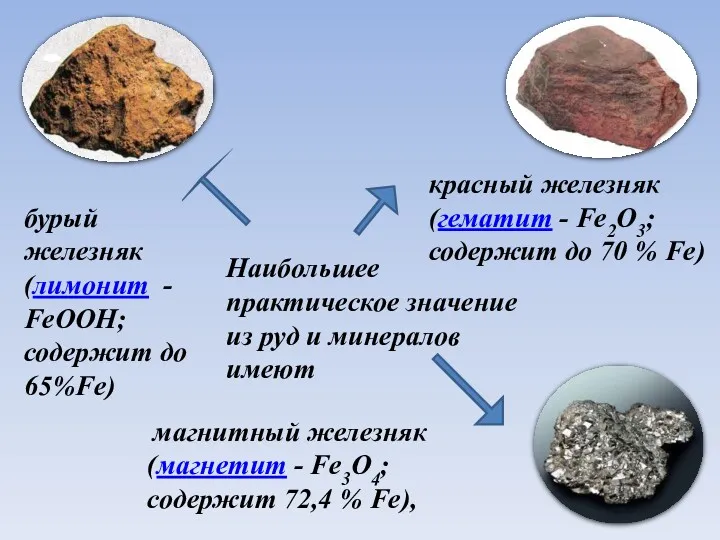
- 9. Наибольшее практическое значение из руд и минералов имеют магнитный железняк (магнетит - Fe3O4; содержит 72,4 %
- 10. Физические свойства железа Железо- сравнительно мягкий , ковкий серебристо-серый металл Температура плавления 15350C Температура кипения 28000C
- 11. Химические свойства 1. Реакции с простыми веществами Железо сгорает в чистом кислороде при нагревании:4Fe +3O2=2Fe2O3 Реагирует
- 12. Химические свойства 2. Реакции со сложными веществами С кислотами: А) с соляной кислотой 2HCL + Fe
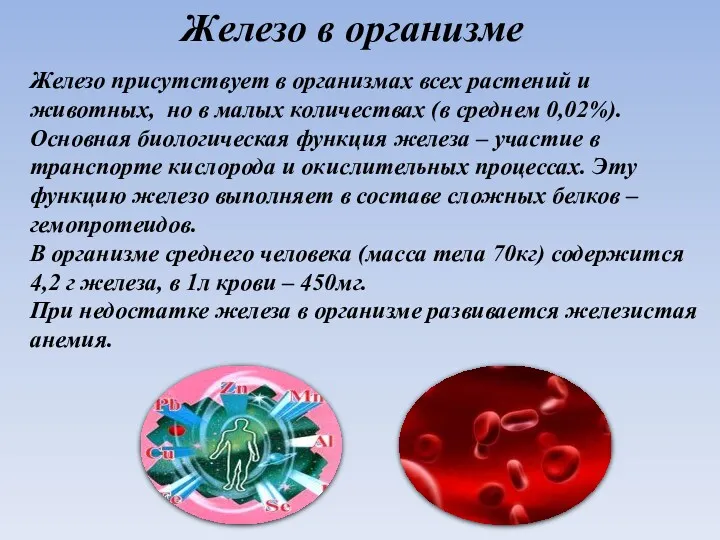
- 13. Железо в организме Железо присутствует в организмах всех растений и животных, но в малых количествах (в
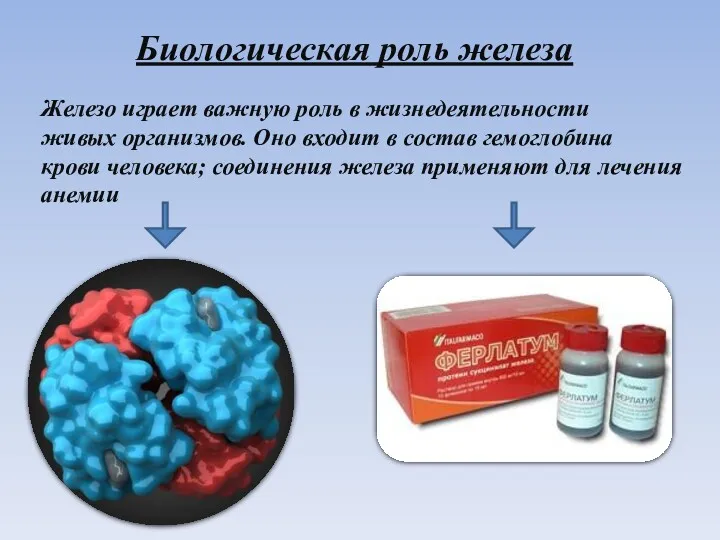
- 14. Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина
- 15. Люди впервые овладели железом в четвертом-третьем тысячелетиях до н. э., подбирая упавшие с неба камни —
- 16. Применение железа, его сплавов и соединений Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении
- 17. «Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления сердечников, трансфо-, мембраноматоров, электромагнитов
- 19. Скачать презентацию










 Электролиз
Электролиз Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Хроматографические методы анализа
Хроматографические методы анализа Коррозия металлов
Коррозия металлов Полимеры в нашей жизни (10 класс)
Полимеры в нашей жизни (10 класс) Қарапайым кристалдық құрылымдар
Қарапайым кристалдық құрылымдар Химический анализ состава йогуртов наиболее популярных торговых марок
Химический анализ состава йогуртов наиболее популярных торговых марок Классификация строительных материалов. Коррозия бетона и железобетона
Классификация строительных материалов. Коррозия бетона и железобетона Производные 8-замещенных хинолина
Производные 8-замещенных хинолина Плавление и кристаллизация
Плавление и кристаллизация Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Классификация минералов по химическому принципу. Занятие 14
Классификация минералов по химическому принципу. Занятие 14 Теоретические и экспериментальные методы исследования в химии
Теоретические и экспериментальные методы исследования в химии ЕГЭ по химии, задание 2
ЕГЭ по химии, задание 2 Окислительно-восстановительные реакции. Урок в 11 классе
Окислительно-восстановительные реакции. Урок в 11 классе Задачи на смеси и сплавы. Метод Пирсона
Задачи на смеси и сплавы. Метод Пирсона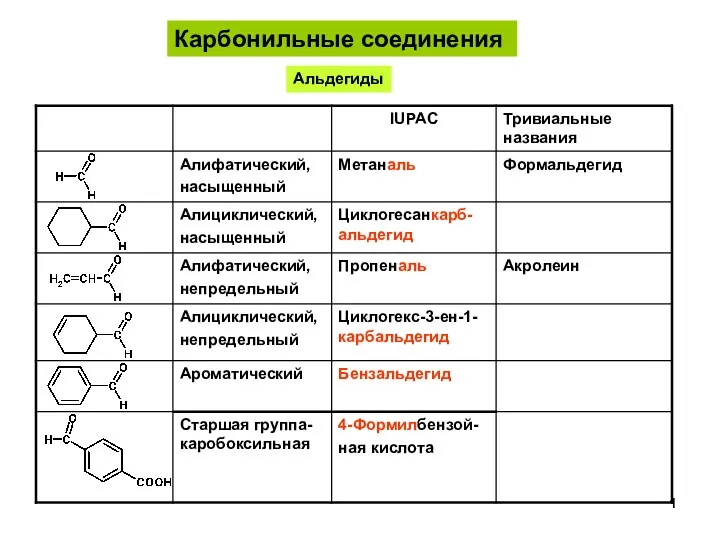 АльдегидыКетоны-1
АльдегидыКетоны-1 Химический состав клетки. Вода
Химический состав клетки. Вода Хром. Элемент VI группы побочной подгруппы
Хром. Элемент VI группы побочной подгруппы Происхождение химичесих элементов
Происхождение химичесих элементов Химический элемент углерод
Химический элемент углерод Чистые вещества и смеси
Чистые вещества и смеси Карбоновые кислоты
Карбоновые кислоты Обмен нуклеотидов
Обмен нуклеотидов Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов Щавелевая кислота
Щавелевая кислота Сущность процесса электролиза
Сущность процесса электролиза Супрамолекулярные системы – мост между неживой и живой материей
Супрамолекулярные системы – мост между неживой и живой материей