Содержание
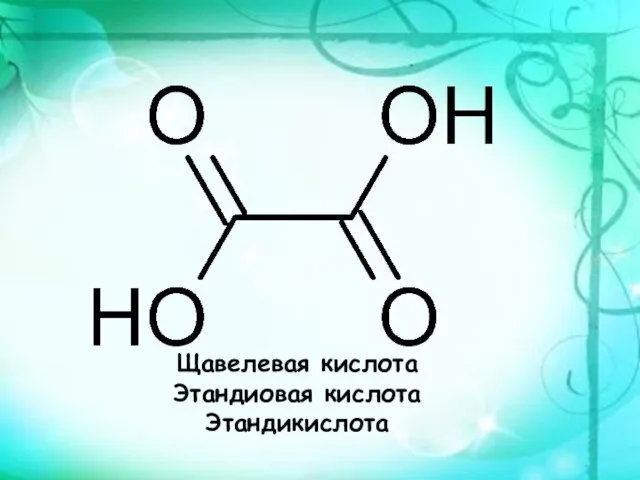
- 2. Щавелевая кислота Этандиовая кислота Этандикислота
- 3. C2H2O4
- 5. Щавелевая кислота получена впервые в 1773 г. Совари из кисличной соли, Бергман получил ее окислением сахара
- 6. Впервые щавелевая кислота синтезирована в 1824 году немецким химиком Фридрихом Вёлером из дициана.
- 7. Химические свойства Щаве́левая кислота обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры щавелевой
- 8. Н2 С2 О4 → СО2 +СО + Н2 О
- 12. Скачать презентацию





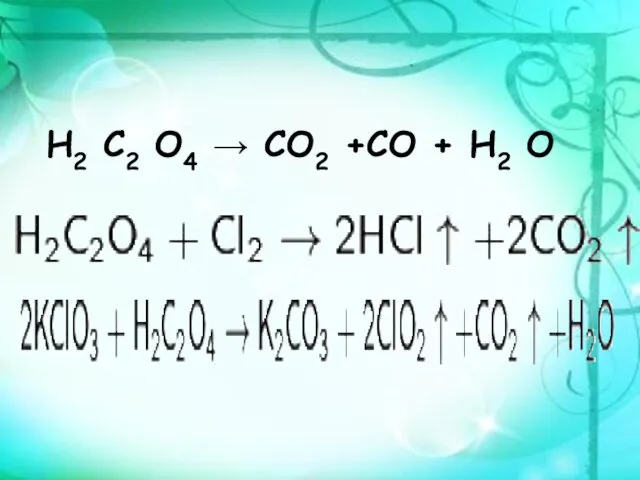


 Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Химическая термодинамика
Химическая термодинамика Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Классификация органических веществ
Классификация органических веществ Сравнительная характеристика галогенов
Сравнительная характеристика галогенов Амин қышқылдар
Амин қышқылдар Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Строение атома
Строение атома Липиды. Классификация липидов
Липиды. Классификация липидов Крахмал. Строение вещества
Крахмал. Строение вещества Значення хімії у житті людини
Значення хімії у житті людини Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Каменный уголь
Каменный уголь Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Бензо́л (C6H6, PhH)
Бензо́л (C6H6, PhH) Поняття про валентність. Ребус
Поняття про валентність. Ребус Текстовые задачи на проценты, смеси и сплавы
Текстовые задачи на проценты, смеси и сплавы Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Природные источники углеводородов
Природные источники углеводородов Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия
Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия Органическая химия
Органическая химия 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Общая характеристика неметаллов
Общая характеристика неметаллов Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений