Слайд 2
Слайд 3

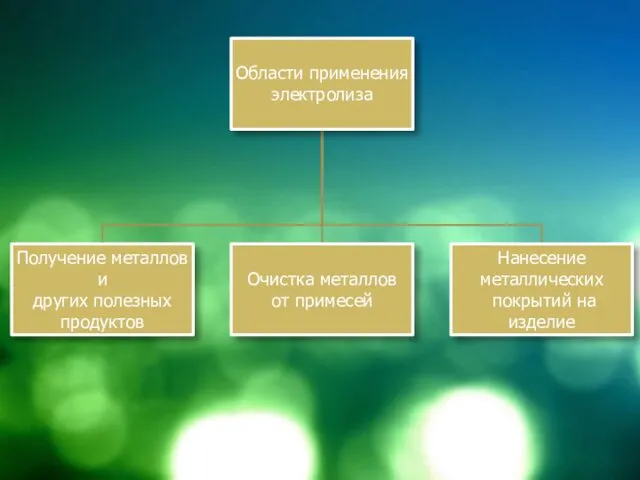
Области применения электролиза
В основной химической промышленности – получение H2, O2,
S, галогенов, щелочей и др.
Электрометаллургия – получают металлы, в том числе щелочные и щелочно-земельные электролизом расплавов солей
Металлообрабатывающая промышленность – гальваностегия – нанесение металлических покрытий на изделия в декоративных целях, в целях защиты от коррозии (хромирование, никелирование, золочение, серебрение и т.д.)
Гальванопластика – снятие копий с изделий (скульптуры, грампластинки, рельефные рисунки). Внедрил Б. С. Якоби, под руководством которого таким образом изготовили украшения фронтона Большого театра, Исаакиевского Собора, Эрмитажа
Очистка металлов – рафинирование (очистку Ni, Pb, Cu проводят электрохимическим методом)
Слайд 4
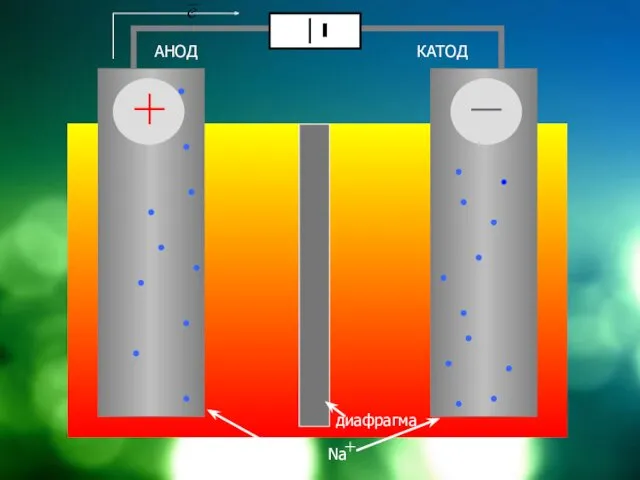
АНОД
КАТОД
диафрагма
NaCl = Cl + Na
Слайд 5

Электролиз расплавов солей
Слайд 6
Слайд 7

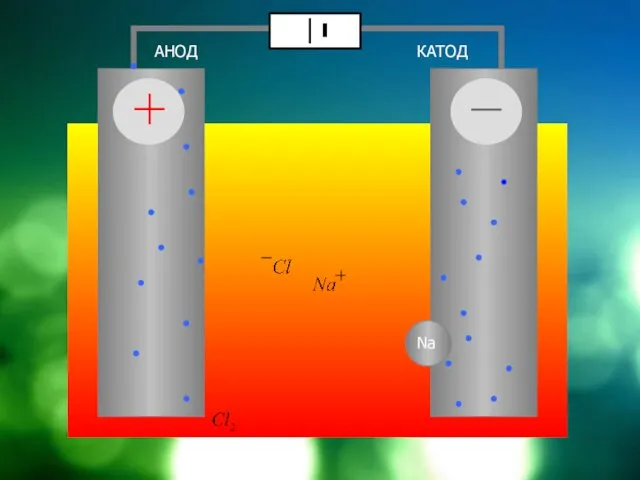
K(-) восстановление
A(+) окисление
2
2
1
расплав
Слайд 8

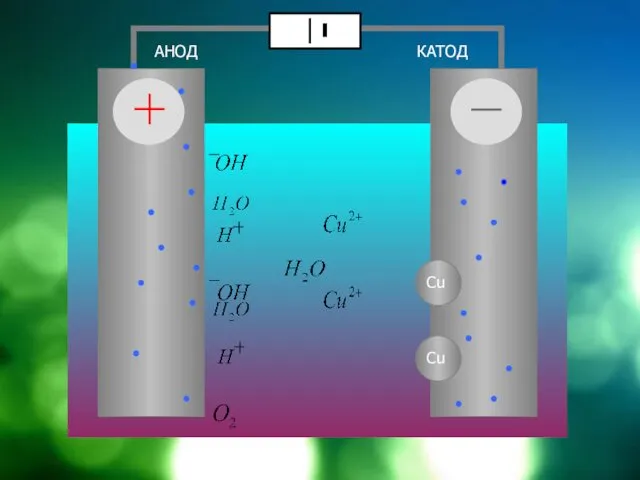
Электролиз растворов солей
Слайд 9

Схема электролиза раствора CuSO4
Слайд 10
Слайд 11

K(-) восстановление
A(+) окисление
8
4
2
2
1
Слайд 12

Схема электролизера на примере электролиза NaCl
Слайд 13
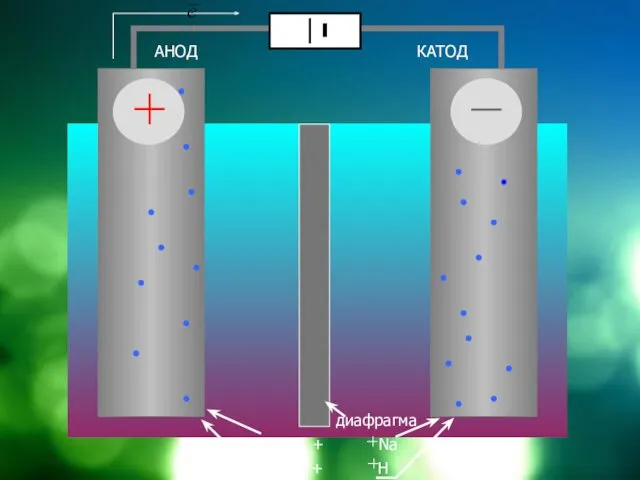
АНОД
КАТОД
диафрагма
NaCl = Cl + Na
HOH = OH
+ H
Слайд 14













 Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5) Электролиз
Электролиз Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура
Одноосновные карбоновые кислоты. Строение, физические свойства, номенклатура Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Алкены. Состав, строение, свойства и химические превращения
Алкены. Состав, строение, свойства и химические превращения Реакция Бэйлиса Хиллмана-Мориты
Реакция Бэйлиса Хиллмана-Мориты Осадительное титрование. (Лекция 27)
Осадительное титрование. (Лекция 27) Человек в мире веществ, материалов и химических реакций. Химия и пища
Человек в мире веществ, материалов и химических реакций. Химия и пища Чистые вещества и смеси. Состав смесей. Разделение смесей
Чистые вещества и смеси. Состав смесей. Разделение смесей Типы химических реакций
Типы химических реакций Фосфорлы тыңайытқыштар
Фосфорлы тыңайытқыштар Полусинтетическое масло
Полусинтетическое масло Основания. Названия оснований
Основания. Названия оснований Растворы. Классификация
Растворы. Классификация Скорость химических реакций
Скорость химических реакций Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Заттардың формулалары және химиялық реакция теңдеулері
Заттардың формулалары және химиялық реакция теңдеулері Щелочноземельные металлы
Щелочноземельные металлы Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері
Химиялық өнеркәсіп шикізаты . Шикізат көздері Химиялық өндірістегі энергия және энергия көздері Углеводы. 10 класс
Углеводы. 10 класс Атомдар мен молекулалар
Атомдар мен молекулалар Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Химические свойста воды
Химические свойста воды Основания. Классификация оснований
Основания. Классификация оснований Why use plastics
Why use plastics Соединения химических элементов
Соединения химических элементов Способи очищення води
Способи очищення води