Содержание
- 2. Раствор состоит из растворенного вещества и растворителя. Растворителем считают тот компонент, агрегатное состояние которого не изменяется
- 3. В зависимости от агрегатного состояния растворителя растворы бывают: газовые (воздух –растворенные друг в друге азот, кислород,
- 4. Вода – бесцветная, прозрачна жидкость, может существовать в 3 агрегатных состояниях – жидком, твердом (лед) и
- 5. Кристаллизация воды сопровождается увеличением объема. Кристаллы воды образуют решетку молекулярного типа. Слабый электролит. Сравнительно высокая температура
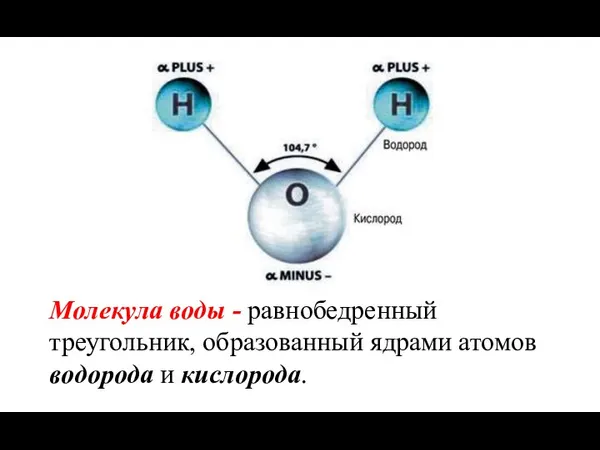
- 6. Молекула воды - равнобедренный треугольник, образованный ядрами атомов водорода и кислорода.
- 7. Связь ковалентная полярная, что приводит к асимметрии распределения зарядов и полярности молекулы – молекула диполь. У
- 8. Химическая теория растворов Д.И. Менделеева Растворение – физико-химический процесс, который в зависимости от природы веществ –
- 9. Растворение сопровождается увеличением энтропии системы (ΔS > 0), с этим связана самопроизвольность процесса растворения, даже, если
- 10. Химическая теория растворов Д.И. Менделеева: вещества растворяясь в воде образуют с ней химические соединения – гидраты,
- 11. сольваты и гидраты образованы либо силами электростатического притяжения (диполь - дипольное взаимодействие), либо донорно-акцепторным взаимодействием; гидраты
- 12. гидраты, у которых вода входит в состав кристаллов растворенного вещества называются кристаллогидратами, а содержащаяся в них
- 13. Растворимость веществ Растворимость (коэффициент растворимости β [г/100г H2O]) – это масса вещества, которая может раствориться при
- 14. По растворимости в воде вещества делятся на: растворимые (Р) – β >1 [г/100г H2O]; малорастворимые (М)
- 15. Растворимость зависит от: природы растворенного вещества; природы растворителя; температуры; давления.
- 16. 1 и 2. Сходство химической природы веществ усиливает их взаимную растворимость: вещества, состоящие из полярных молекул
- 17. 3 и 4. Влияние Т и Р на растворимость регулируется принципом Ле Шателье: при увеличении температуры
- 18. В зависимости от количества вещества, растворенного в растворителе различают: насыщенные растворы – содержащие максимальное количество растворенного
- 19. Ненасыщенные растворы с содержанием растворенного вещества менее 1 моль на 1 литр раствора называются разбавленными, более
- 20. Способы выражения количественного состава растворов 1) Массовая доля Показывает сколько граммов растворенного вещества содержится в 100
- 21. 2) Мольная доля Отношение числа молей растворенного вещества (или растворителя) к сумме молей растворенного вещества и
- 22. 3) Молярная концентрация (молярность) Отношение количества вещества к объему раствору, показывает число молей растворенного вещества в
- 23. 4) Эквивалентная или нормальная концентрация (нормальность) Отношение количества эквивалентов вещества к объему раствору, показывает число эквивалентов
- 24. 5) Моляльная концентрация (моляльность) Отношение количества растворенного вещества к массе растворителя, показывает сколько молей растворенного вещества
- 26. Скачать презентацию










![Растворимость веществ Растворимость (коэффициент растворимости β [г/100г H2O]) – это](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/238223/slide-12.jpg)











 Бензен як представник ароматичних вуглеводнів
Бензен як представник ароматичних вуглеводнів Йонний, металічний, водневий хімічні зв’язки
Йонний, металічний, водневий хімічні зв’язки Текстуры и структуры метаморфических горных пород
Текстуры и структуры метаморфических горных пород Металл серебро
Металл серебро Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Водород H2
Водород H2 Химические свойста воды
Химические свойста воды Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation
Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation Железо и его соединения
Железо и его соединения Такой разный песок
Такой разный песок Предмет и задачи химии. Вещества и их свойства (продолжение)
Предмет и задачи химии. Вещества и их свойства (продолжение) Общая технология отрасли. Сахар и сахаристые вещества
Общая технология отрасли. Сахар и сахаристые вещества Синтез и химические модификации индиго
Синтез и химические модификации индиго Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода Бейорганикалық заттар технологиясындағы жүйелерді термодинамикалық талдау
Бейорганикалық заттар технологиясындағы жүйелерді термодинамикалық талдау Amino acid and protein metabolism II
Amino acid and protein metabolism II Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Алюминий и его соединения
Алюминий и его соединения Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 Значение металлов для человека
Значение металлов для человека Карбонові кислоти
Карбонові кислоти Реальные газы, жидкости и твердые тела
Реальные газы, жидкости и твердые тела Двойной электрический слой. Теория Гельмгольца
Двойной электрический слой. Теория Гельмгольца Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Органическая химия – химия соединений углерода
Органическая химия – химия соединений углерода