Содержание
- 2. С О Д Е Р Ж А Н И Е ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ НАХОЖДЕНИЕ В
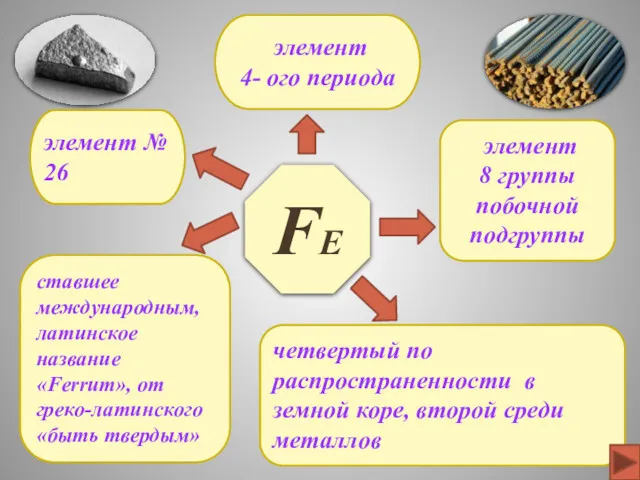
- 3. FЕ элемент № 26 элемент 4- ого периода четвертый по распространенности в земной коре, второй среди
- 4. ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА ЖЕЛЕЗА Fe +26 2е 8е 14е 2е 1S22S22P63S23P63D64S2 возможные степени окисления +2 и
- 5. Нахождение в природе В земной коре на долю железа приходится около 4,1% массы земной коры (4-е
- 6. Первое металлическое железо, попавшее в руки человека, имело, явно, метеоритное происхождение. Руды железа широко распространены и
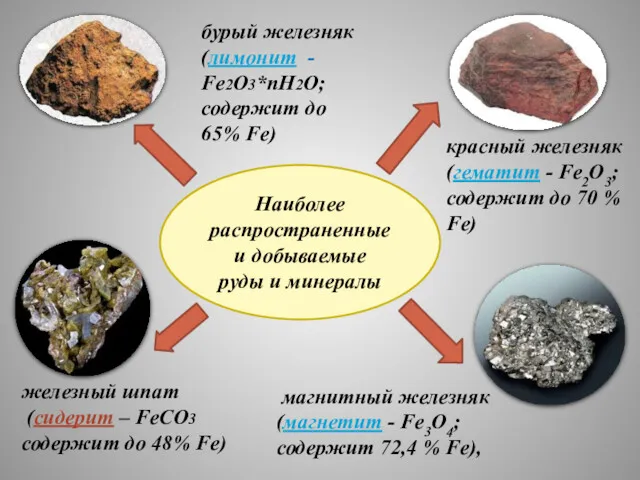
- 7. Наиболее распространенные и добываемые руды и минералы магнитный железняк (магнетит - Fe3O4; содержит 72,4 % Fe),
- 8. Люди впервые овладели железом в 4-3 тысячелетиях до н. э., подбирая упавшие с неба камни —
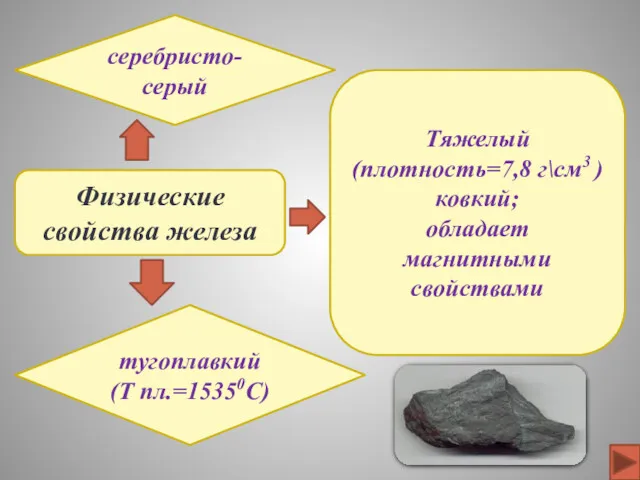
- 9. Физические свойства железа серебристо-серый тугоплавкий (Т пл.=15350C) Тяжелый (плотность=7,8 г\см3 ) ковкий; обладает магнитными свойствами
- 10. Химические свойства Реакции с простыми веществами Железо сгорает в чистом кислороде при нагревании:3Fe +2O2=Fe3O4 Реагирует с
- 11. Химические свойства Реакции со сложными веществами С кислотами: А) с соляной кислотой 2HCL + Fe =
- 12. Железо разрушается под действием окружающей среды, т.е. подвергается коррозии – «ржавлению». При этом на поверхности образуется
- 13. СОЕДИНЕНИЯ ЖЕЛЕЗА
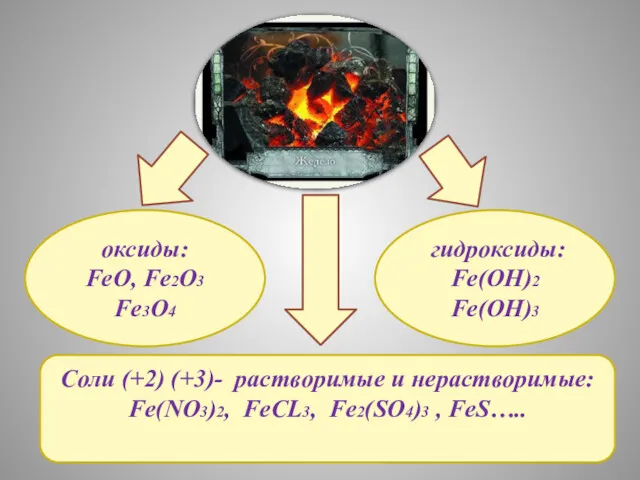
- 14. Соли (+2) (+3)- растворимые и нерастворимые: Fe(NO3)2, FeCL3, Fe2(SO4)3 , FeS….. оксиды: FeO, Fe2O3 Fe3O4 гидроксиды:
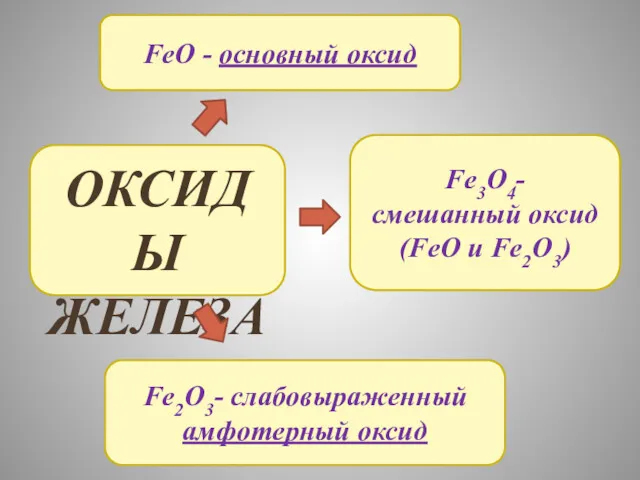
- 15. ОКСИДЫ ЖЕЛЕЗА FeO - основный оксид Fe2O3- слабовыраженный амфотерный оксид Fe3O4- смешанный оксид (FeO и Fe2O3)
- 16. Химические свойства FeO с кислотами: FeO + 2HCL=FeCL2 + H2O 2) с более активными металлами: 3FeO
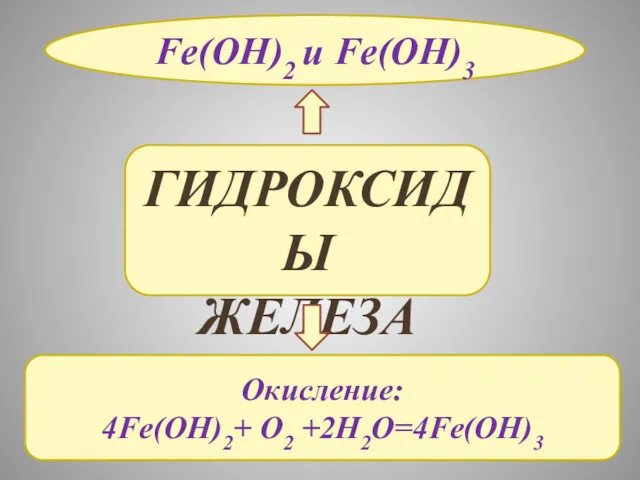
- 17. ГИДРОКСИДЫ ЖЕЛЕЗА Fe(OH)2 и Fe(OH)3 Окисление: 4Fe(OH)2+ O2 +2H2O=4Fe(OH)3
- 18. Fe(OH)2 и Fe(OH)3 Fe(OH)3 реагирует с конц. щелочами Fe(OH)3 + 3NaOH=Na3(Fe(OH)6) 1)Реагируют с кислотами: Fe(OH)2 +
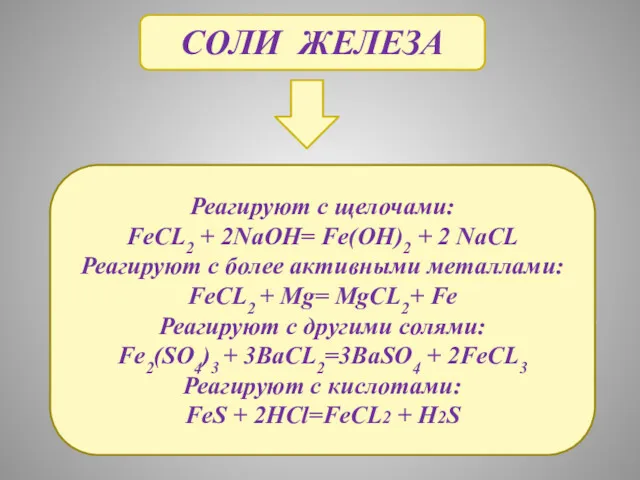
- 19. СОЛИ ЖЕЛЕЗА Реагируют с щелочами: FeCL2 + 2NaOH= Fe(OH)2 + 2 NaCL Реагируют с более активными
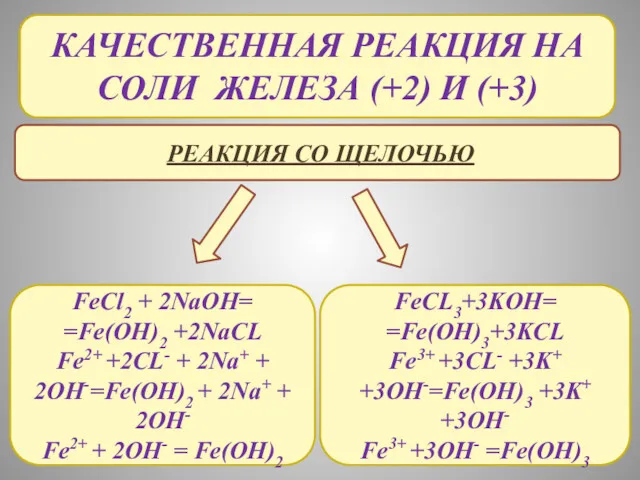
- 20. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СОЛИ ЖЕЛЕЗА (+2) И (+3) РЕАКЦИЯ СО ЩЕЛОЧЬЮ FeCl2 + 2NaOH= =Fe(OH)2 +2NaCL
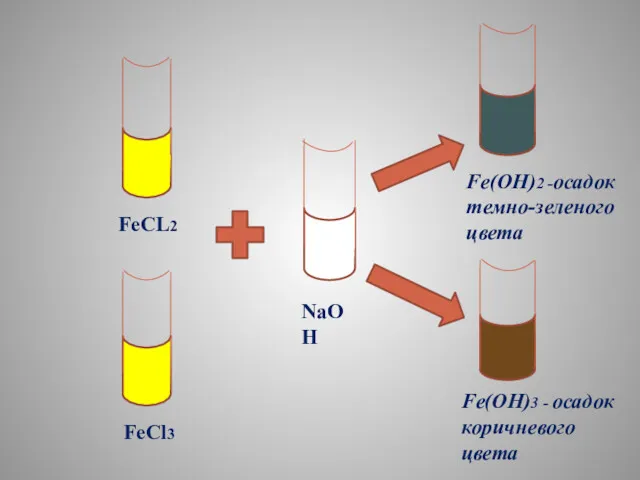
- 21. FeCL2 FeCl3 NaOH Fe(OH)2 -осадок темно-зеленого цвета Fe(OH)3 - осадок коричневого цвета
- 22. ЖЕЛЕЗО В ОРГАНИЗМЕ Железо в виде ионов присутствует в организмах всех растений и животных и, конечно
- 23. Основная роль железа в организме – участие в «рождении» красных (эритроцитов) и белых (лимфоцитов) кровяных клеток.
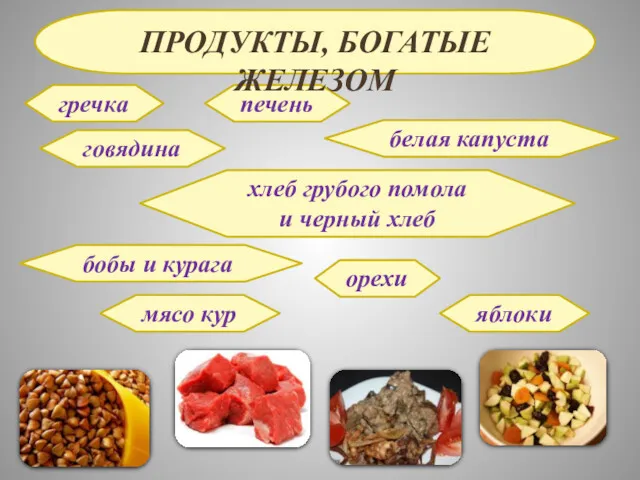
- 24. гречка говядина печень белая капуста хлеб грубого помола и черный хлеб бобы и курага орехи мясо
- 25. При анемии, для приготовления пищи, рекомендуется использовать чугунную посуду. Как показали эксперименты, приготовление и кипячение соуса
- 26. П Р И М Е Н Е Н И Е Ж Е Л Е З А
- 27. Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении сердечников электромагнитов, как катализатор химических процессов,
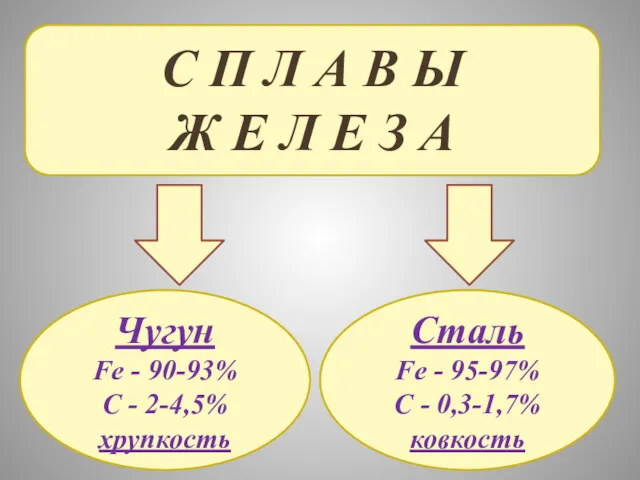
- 28. С П Л А В Ы Ж Е Л Е З А Чугун Fe - 90-93%
- 29. Железо сегодня Гидроэлектро- станции и опоры линий электропередач Трубопроводы для воды, нефти и газа Автомобили ,
- 30. Ф О Л Ь К Л О Р О Ж Е Л Е З Е
- 31. «Ржавое железо не блестит» (никчемность и бездеятельность человека портит!!!) Очень часто употребляемая пословица: «Куй железо, пока
- 32. Есть у железа страшный враг – «ржавчина». К чему она приводит, как с ней бороться и
- 33. А Т Е П Е Р Ь К Р О С С В О Р Д
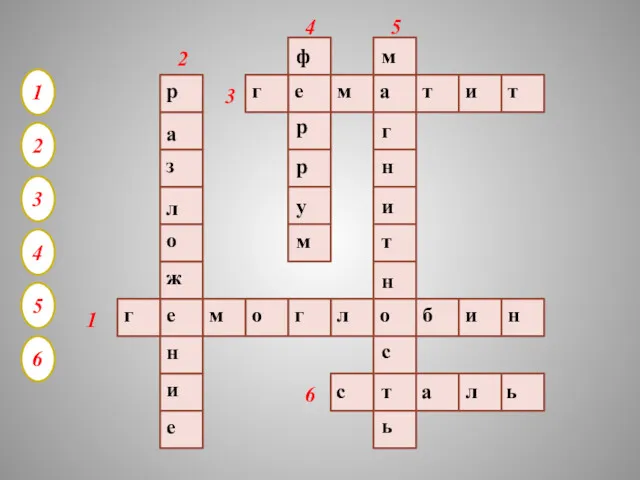
- 34. 1 2 3 4 5 6 г е м о г л о б и н
- 35. 1. БЕЛОК КРОВИ, ПЕРЕНОСЯЩИЙ ПО ОРГАНИЗМУ КИСЛОРОД 2. ТИП РЕАКЦИИ, В КОТОРУЮ ВСТУПАЮТ ГИДРОКСИДЫ ЖЕЛЕЗА ПРИ
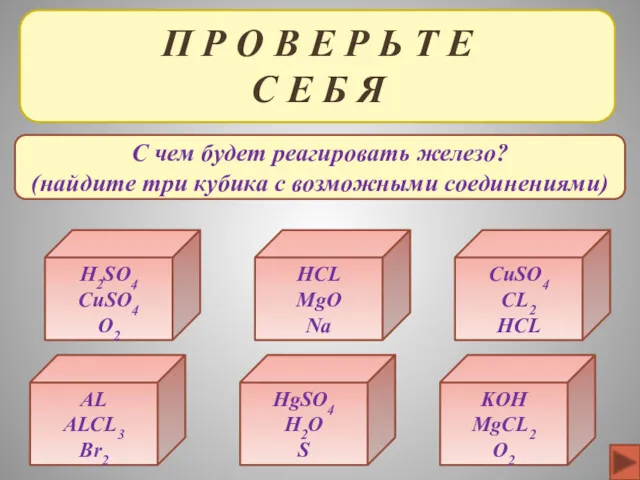
- 36. П Р О В Е Р Ь Т Е С Е Б Я H2SO4 CuSO4 O2
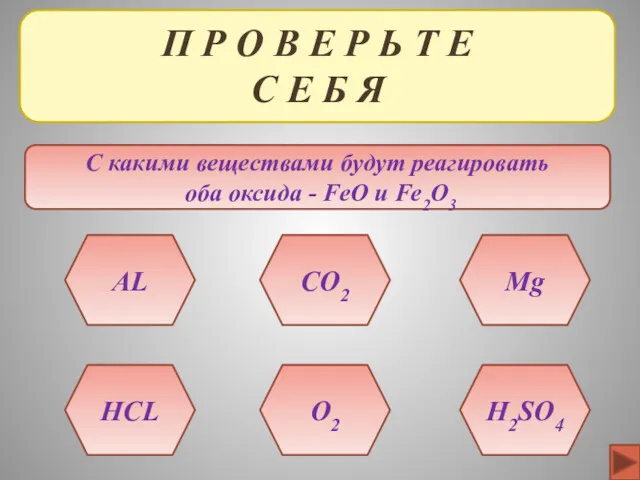
- 37. П Р О В Е Р Ь Т Е С Е Б Я С какими веществами
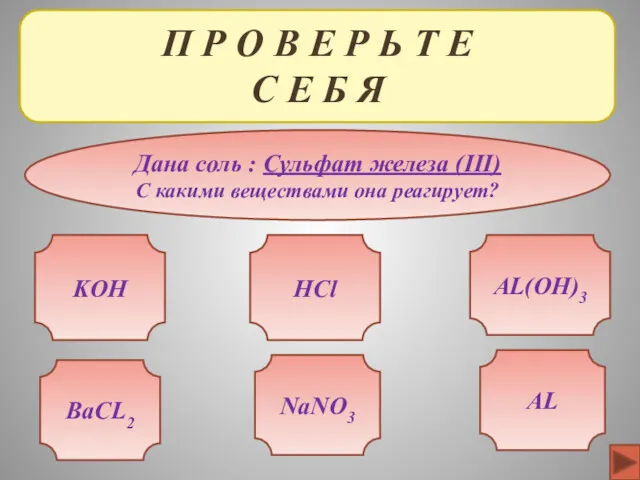
- 38. П Р О В Е Р Ь Т Е С Е Б Я Дана соль :
- 40. Скачать презентацию





















 Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Закон сохранения массы веществ
Закон сохранения массы веществ Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий
Методы определения поверхностной энергии твердых тел. Контроль растекания, смачивания, адгезии и водостойкости покрытий Основное уравнение молекулярно-кинетической теории. Идеальный газ
Основное уравнение молекулярно-кинетической теории. Идеальный газ Күкірт қышқылы
Күкірт қышқылы Интересные факты о химических веществах
Интересные факты о химических веществах Химическая термодинамика
Химическая термодинамика Введение в кристаллографию
Введение в кристаллографию Оксиды. Химические свойства и получение оксидов
Оксиды. Химические свойства и получение оксидов Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Приемы обращения с лабораторным оборудованием. Строение пламени
Приемы обращения с лабораторным оборудованием. Строение пламени Пластмасса, пластикалық материалдар
Пластмасса, пластикалық материалдар Предмет и задачи химии. Место химии среди естественных наук. Атомно-молекулярное учение. Основные стехиометрические законы химии
Предмет и задачи химии. Место химии среди естественных наук. Атомно-молекулярное учение. Основные стехиометрические законы химии Использование сплавов алюминия
Использование сплавов алюминия Щелочные металлы
Щелочные металлы Липиды. Составные части липидов
Липиды. Составные части липидов Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Йони. Йонний зв’язок, його утворення
Йони. Йонний зв’язок, його утворення Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії
Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії Вводная лекция
Вводная лекция Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Stirring in liquid media
Stirring in liquid media Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение соединения VI группы продвинутая версия
соединения VI группы продвинутая версия