Содержание
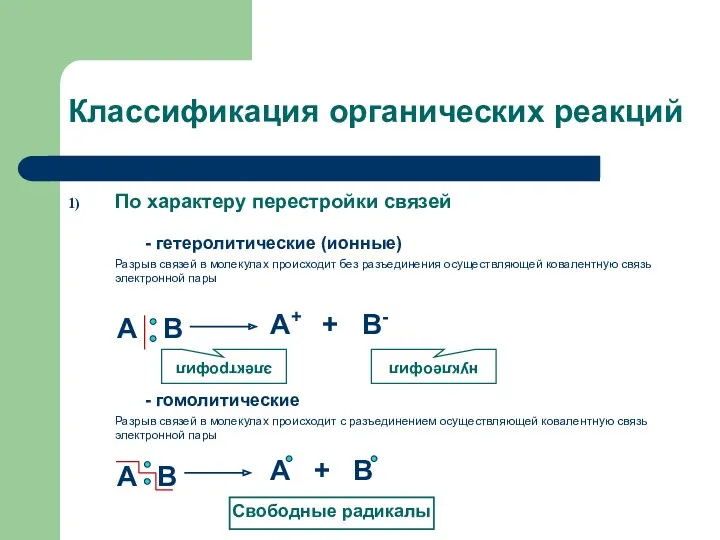
- 2. Классификация органических реакций По характеру перестройки связей - гетеролитические (ионные) Разрыв связей в молекулах происходит без
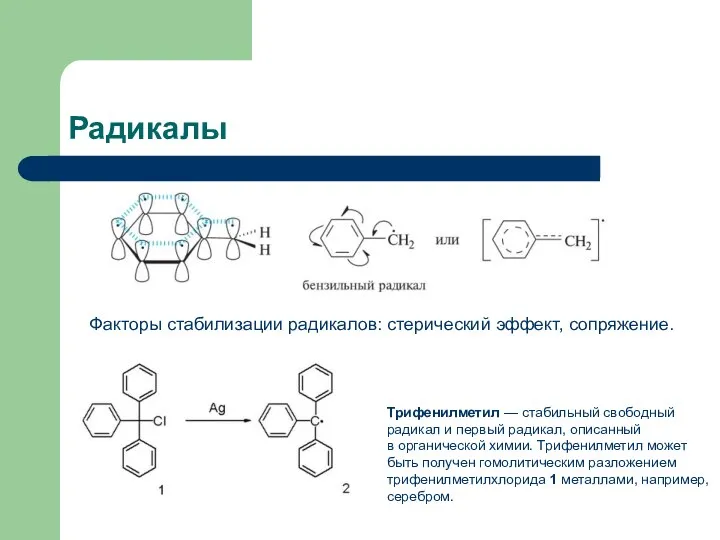
- 3. Радикалы Трифенилметил — стабильный свободный радикал и первый радикал, описанный в органической химии. Трифенилметил может быть
- 4. Электрофилы Электрофильные реагенты (Е, Е+) – это частицы, образующие новые ковалентные связи за счет пары электронов
- 5. Нуклеофилы Нуклеофильные реагенты (:Nu, Nu-) – это частицы, образующие новые ковалентные связи со своим партнером, предоставляя
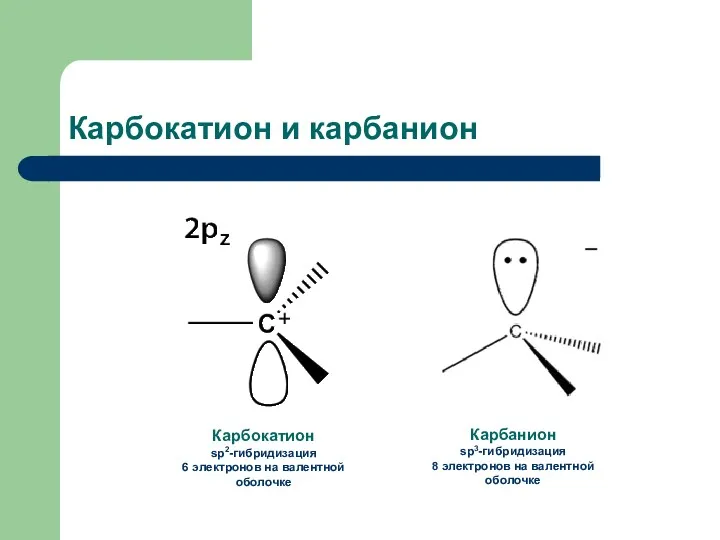
- 6. Карбокатион и карбанион Карбанион sp3-гибридизация 8 электронов на валентной оболочке Карбокатион sp2-гибридизация 6 электронов на валентной
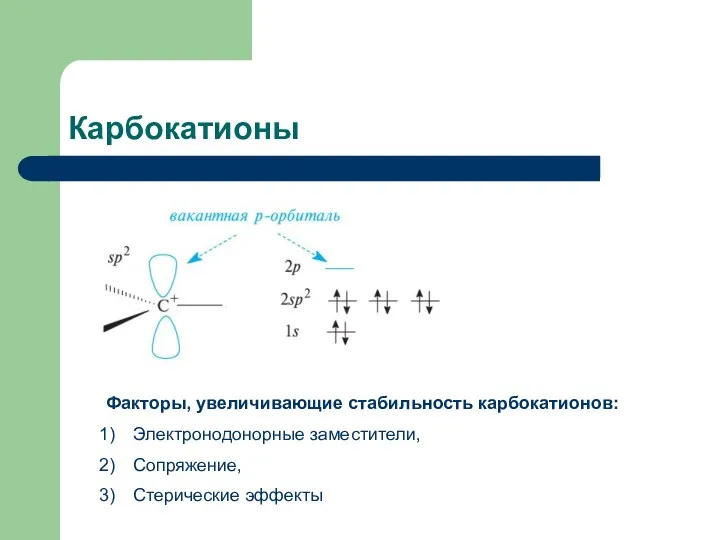
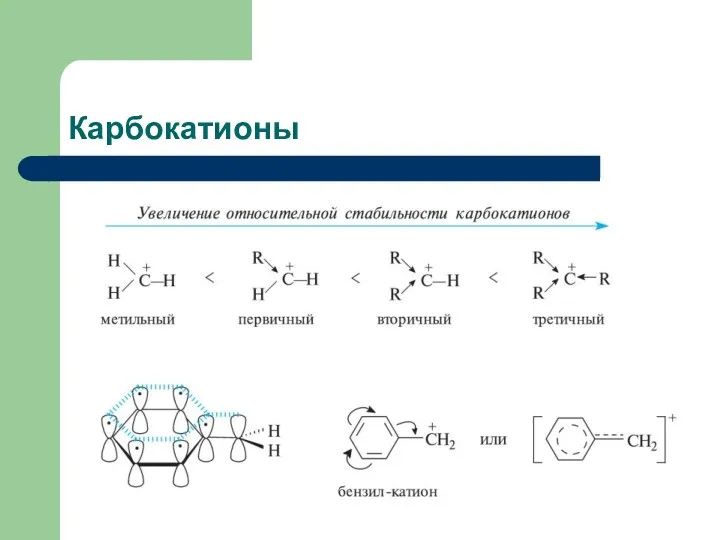
- 7. Карбокатионы Факторы, увеличивающие стабильность карбокатионов: Электронодонорные заместители, Сопряжение, Стерические эффекты
- 8. Карбокатионы
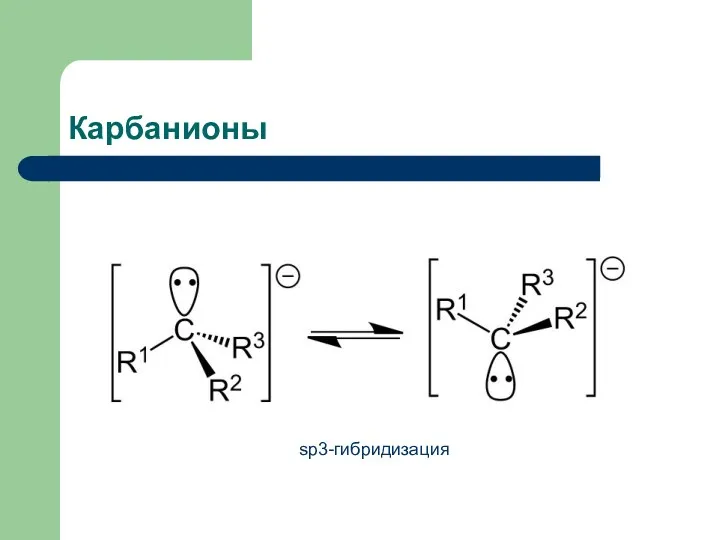
- 9. Карбанионы sp3-гибридизация
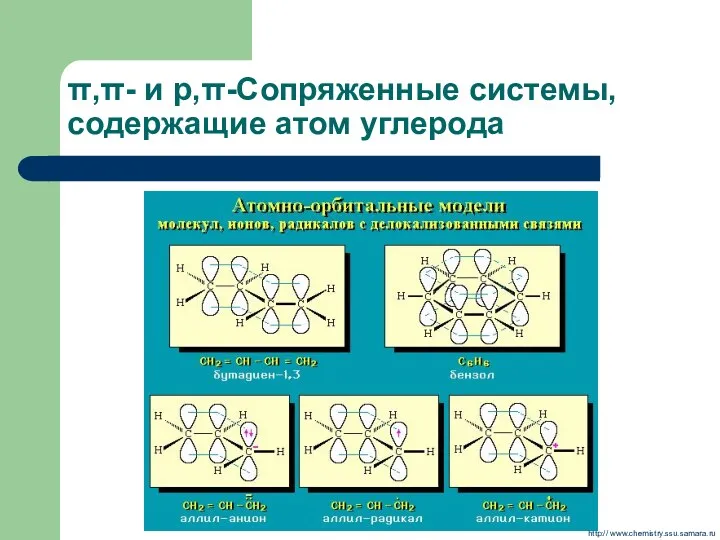
- 10. π,π- и р,π-Сопряженные системы, содержащие атом углерода http:// www.chemistry.ssu.samara.ru
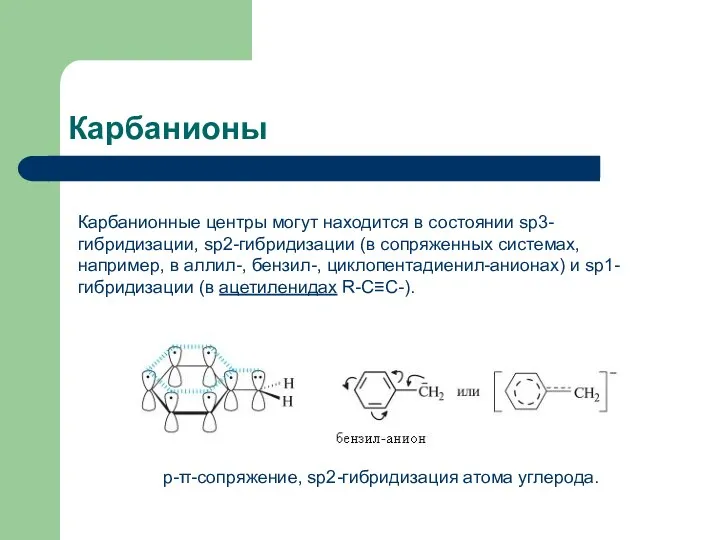
- 11. Карбанионы Карбанионные центры могут находится в состоянии sp3-гибридизации, sp2-гибридизации (в сопряженных системах, например, в аллил-, бензил-,
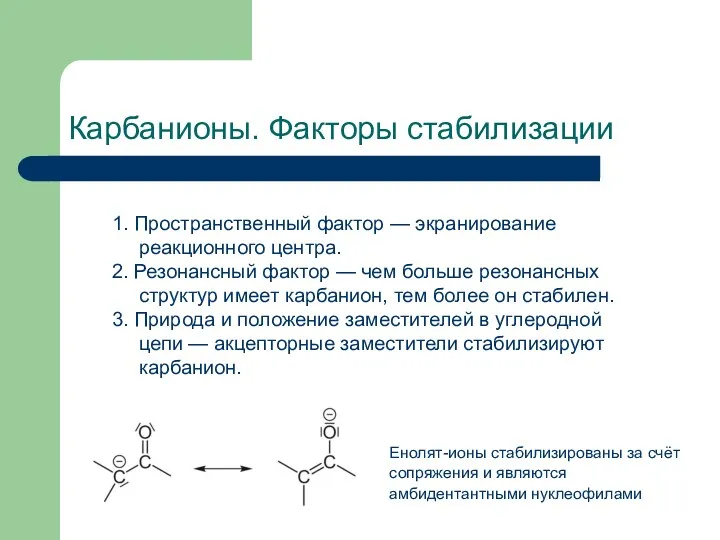
- 12. Карбанионы. Факторы стабилизации 1. Пространственный фактор — экранирование реакционного центра. 2. Резонансный фактор — чем больше
- 13. Классификация органических реакций по типу частиц, участвующих в реакции Радикальные реакции протекают с участием радикалов (например,
- 14. Реакции замещения Реакции замещения (S) – один или несколько атомов или групп атомов в молекуле замещаются
- 15. Механизмы SN-реакций Мономолекулярный механизм SN1 Бимолекулярный механизм SN2
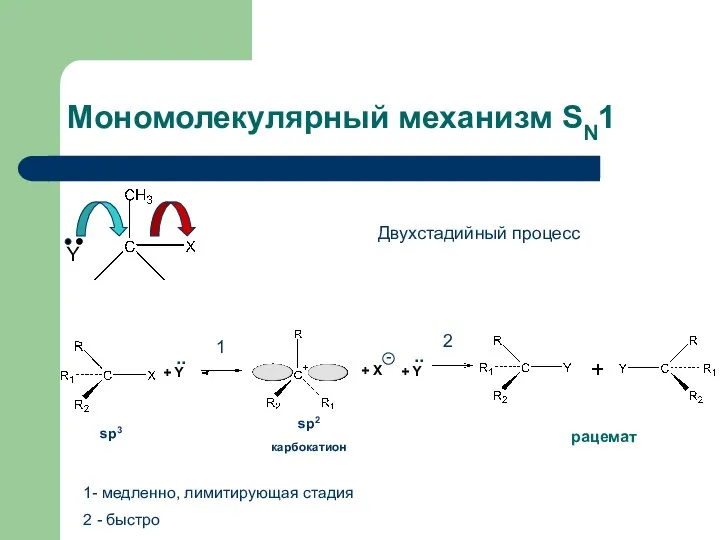
- 16. Мономолекулярный механизм SN1 Двухстадийный процесс 1 2 1- медленно, лимитирующая стадия 2 - быстро
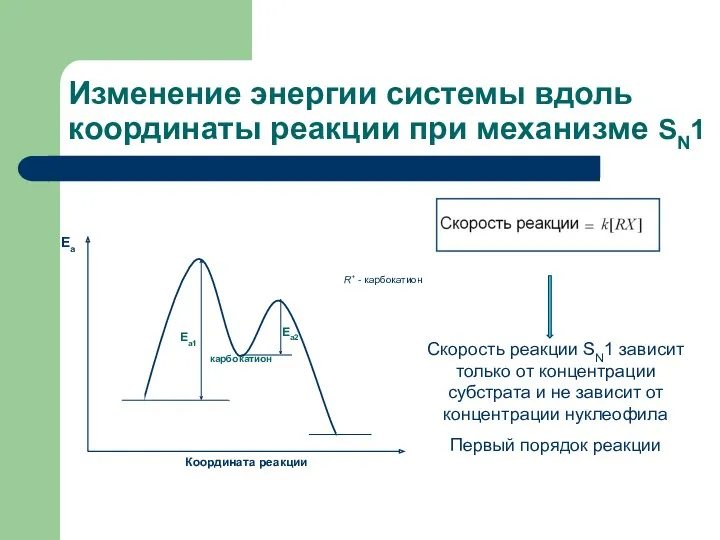
- 17. Изменение энергии системы вдоль координаты реакции при механизме SN1 Скорость реакции SN1 зависит только от концентрации
- 18. Эффект общего иона R+ - карбокатион
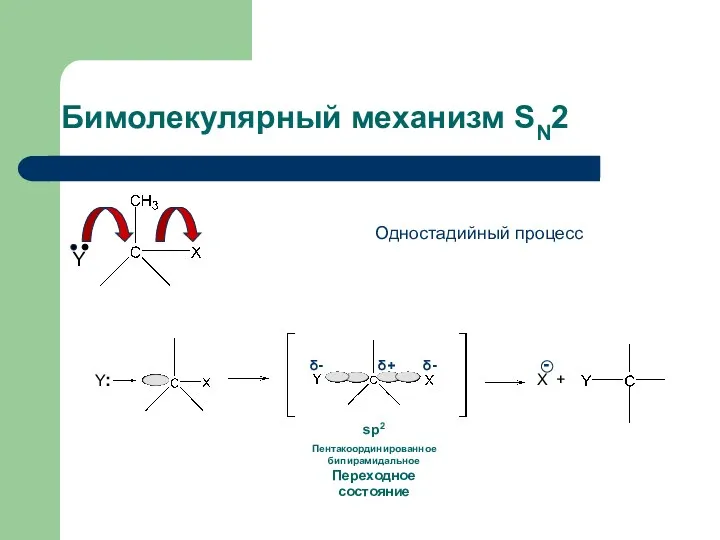
- 19. Бимолекулярный механизм SN2 Одностадийный процесс sp2 Пентакоординированное бипирамидальное Переходное состояние
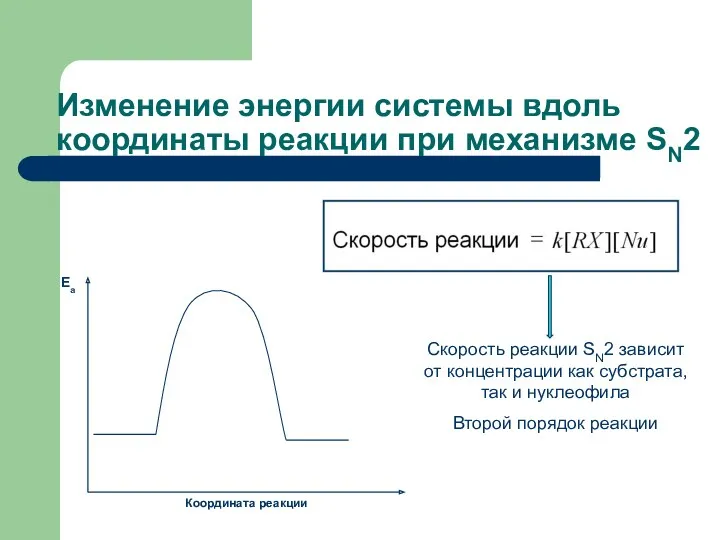
- 20. Изменение энергии системы вдоль координаты реакции при механизме SN2 Скорость реакции SN2 зависит от концентрации как
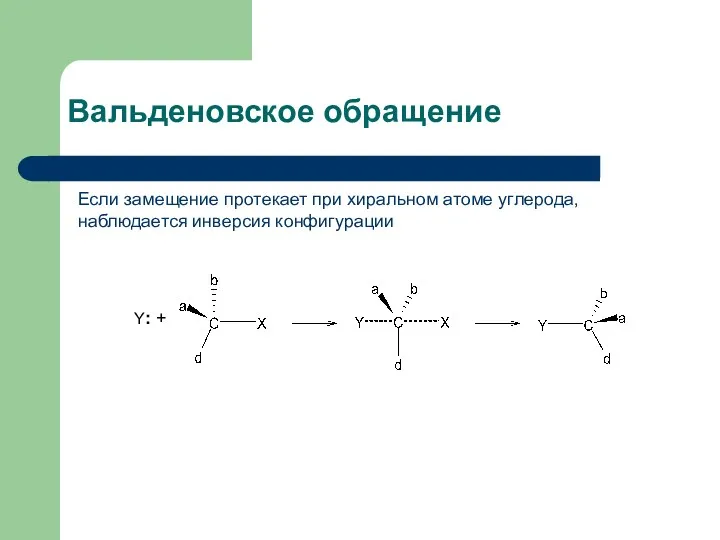
- 21. Вальденовское обращение Если замещение протекает при хиральном атоме углерода, наблюдается инверсия конфигурации
- 22. Факторы, влияющие на скорость реакции SN Строение субстрата Природа нуклеофила Природа уходящей группы Природа растворителя Пространственные
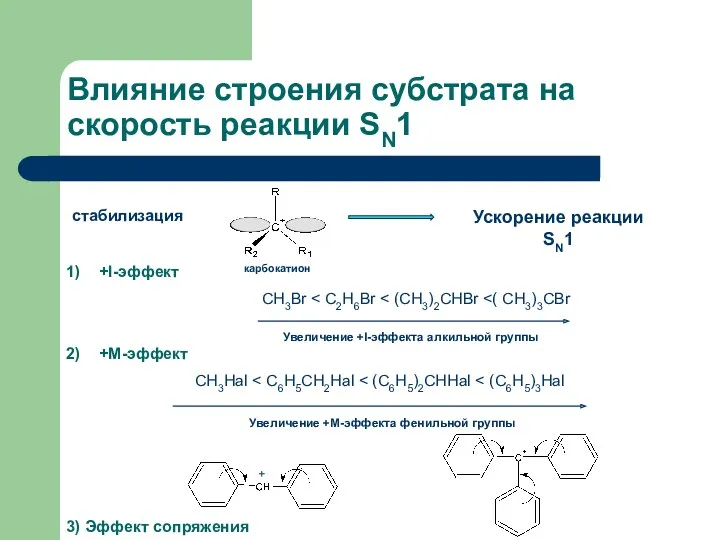
- 23. Влияние строения субстрата на скорость реакции SN1 3) Эффект сопряжения
- 24. -I-эффект (СН3)3CХ -М-эффект Пространственное строение субстрата (стерический фактор) Эффект сопряжения Влияние строения субстрата на скорость реакции
- 25. Влияние стерического фактора на скорость реакции SN2 Алкилирование аминов алкилгалогенидами (реакция Меншуткина): 2) Объемистый заместитель находится
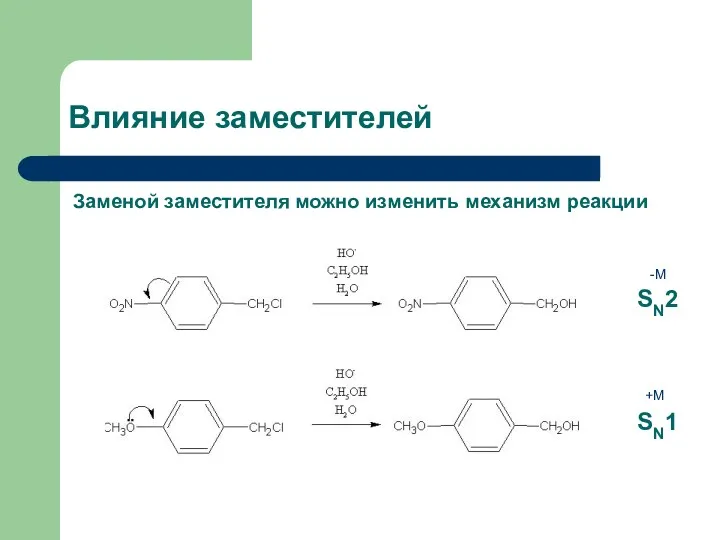
- 26. Влияние заместителей Заменой заместителя можно изменить механизм реакции SN2 SN1 -M +M
- 27. Влияние природы нуклеофила на скорость реакции SN1 Скорость реакции SN1 не зависит от концентрации нуклеофила (он
- 28. Влияние природы нуклеофила на скорость реакции SN2 Повышение концентрации нуклеофила приводит к увеличению скорости реакции Влияние
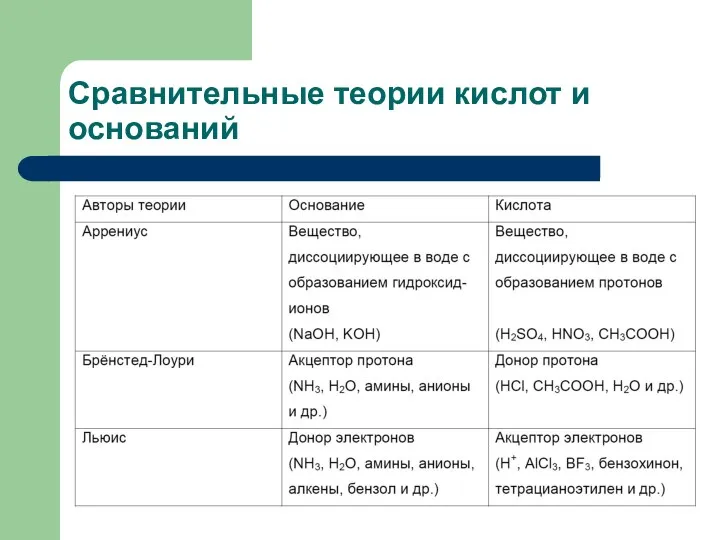
- 29. Сравнительные теории кислот и оснований
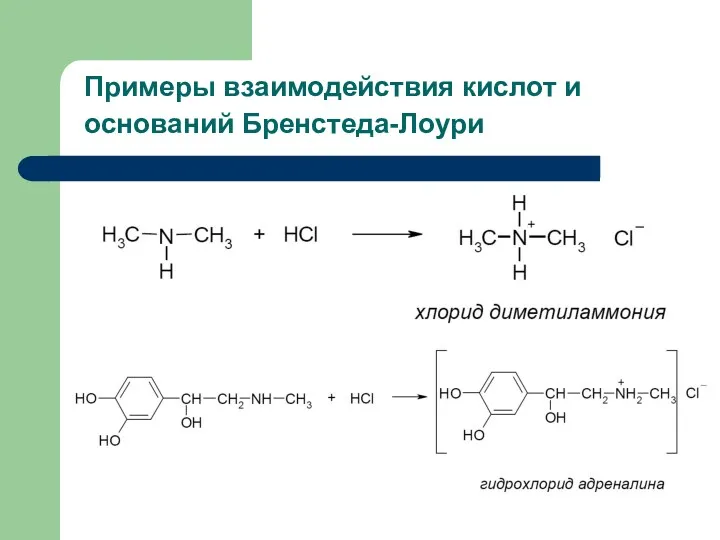
- 30. Примеры взаимодействия кислот и оснований Бренстеда-Лоури
- 31. Нуклеофильность и основность Сильный нуклеофил не обязательно сильное основание Сильное основание не обязательно сильный нуклеофил
- 32. Нуклеофильность и основность Нуклеофил = основание, но основность и нуклеофильность могут не совпадать! HO_ > СN_
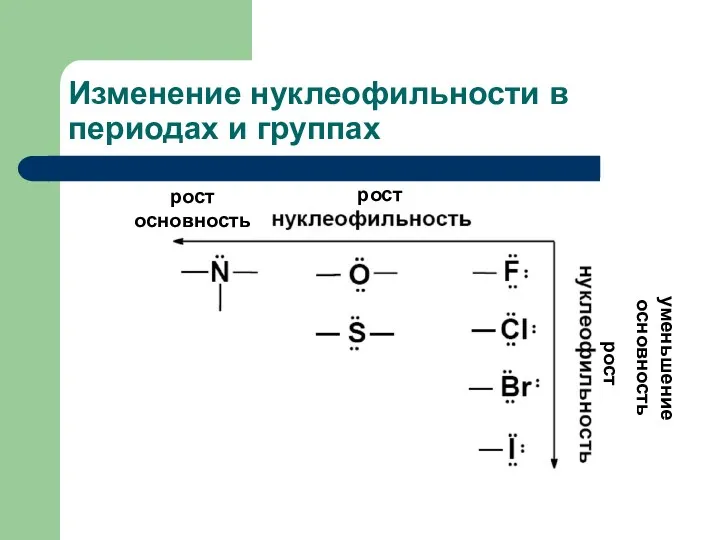
- 33. Изменение нуклеофильности в периодах и группах рост рост рост основность уменьшение основность
- 34. Факторы, влияющие на основность Чем больше электроотрицательность атома основного центра, тем сильнее удерживается НЭП, тем меньше
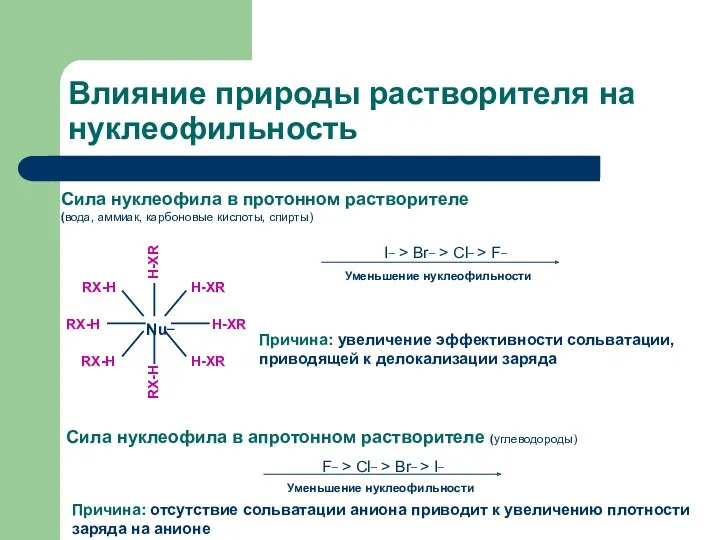
- 35. Влияние природы растворителя на нуклеофильность I_ > Br_ > Cl_ > F_ Причина: увеличение эффективности сольватации,
- 36. Изменение нуклеофильности Депротонированная форма является более сильным нуклеофилом, чем протонированная: Н2О более слабый нуклеофил, чем ОН_
- 37. Увеличение нуклеофильности повышает вероятность протекания реакции по механизму SN2 Резюме
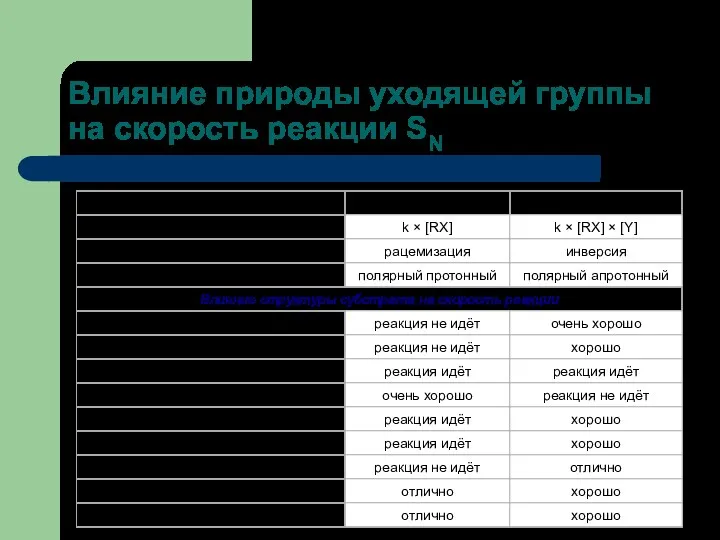
- 38. Влияние природы уходящей группы на скорость реакции SN C-Х + Y C-Y + X основание Уходящая
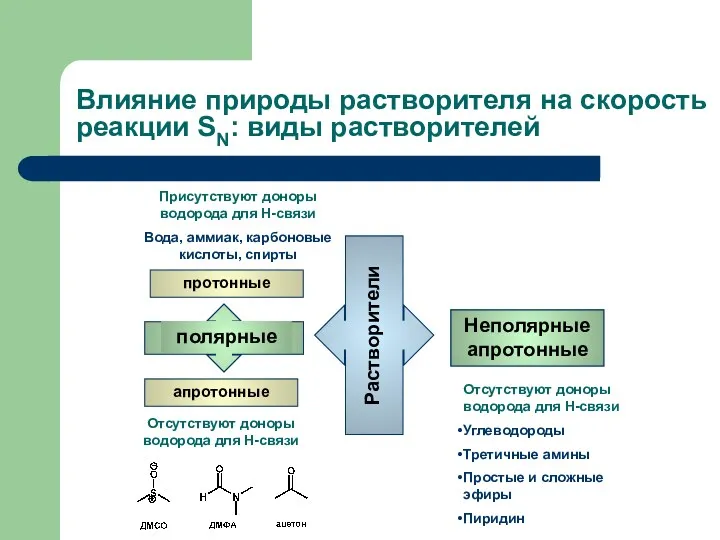
- 39. Влияние природы растворителя на скорость реакции SN: виды растворителей
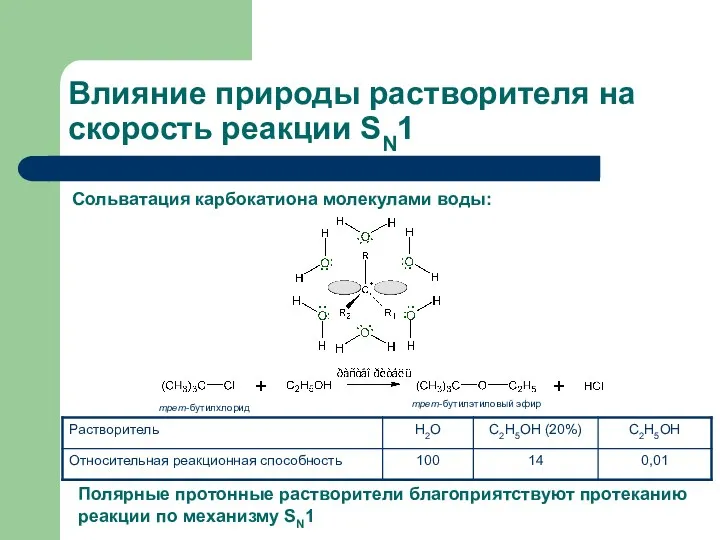
- 40. Влияние природы растворителя на скорость реакции SN1 Сольватация карбокатиона молекулами воды: Полярные протонные растворители благоприятствуют протеканию
- 41. Влияние природы уходящей группы на скорость реакции SN
- 42. Влияние природы растворителя на скорость реакции SN2 R-X + Y_ → [Y…R…X] → RY + X_
- 43. Основные органические реакции, относящиеся к типу SN Получение алкилгалогенидов Получение и расщепление простых эфиров в кислых
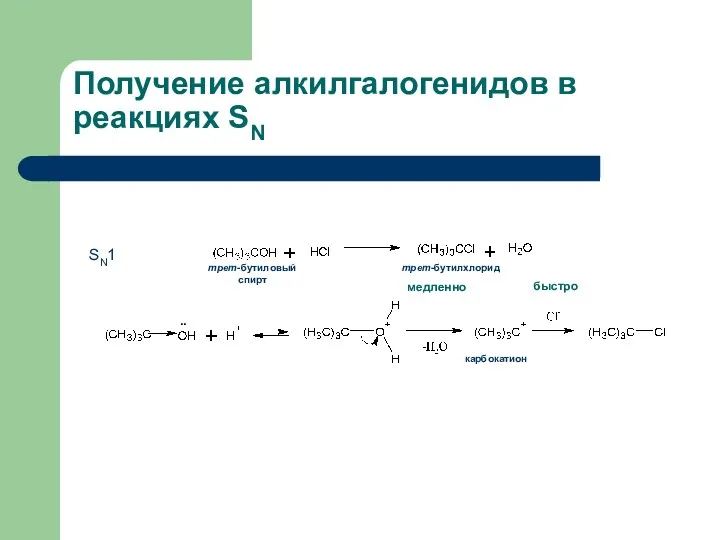
- 44. Получение алкилгалогенидов в реакциях SN медленно быстро .. карбокатион трет-бутиловый спирт трет-бутилхлорид SN1
- 45. Примеры реакций Гидролиз алкилгалогенидов
- 46. Примеры реакций Алкоголиз алкилгалогенидов
- 47. Примеры реакций Аммонолиз алкилгалогенидов Реакция алкилгалогенидов с цианидами
- 48. Примеры реакций Взаимодействие алкилгалогенидов с солями кислот
- 50. Скачать презентацию























 Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ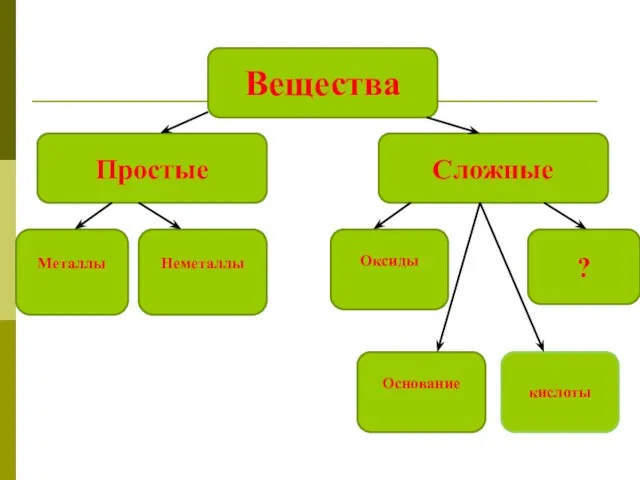 Соли, как производные кислот и оснований
Соли, как производные кислот и оснований Получение и свойства кислорода
Получение и свойства кислорода Теория электролитической диссоциации
Теория электролитической диссоциации Экоаналитический контроль воздуха
Экоаналитический контроль воздуха Метал конструкциялық материалдар
Метал конструкциялық материалдар Нафталин
Нафталин Типы химических реакций
Типы химических реакций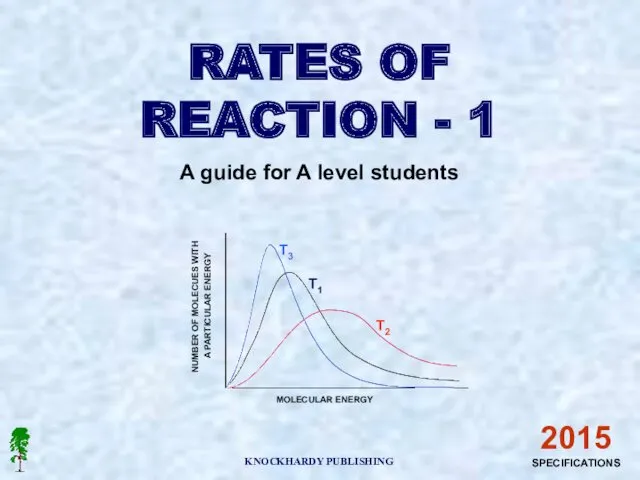 Number of molecues with a particular energy
Number of molecues with a particular energy Сложные эфиры
Сложные эфиры Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Түсті металдар
Түсті металдар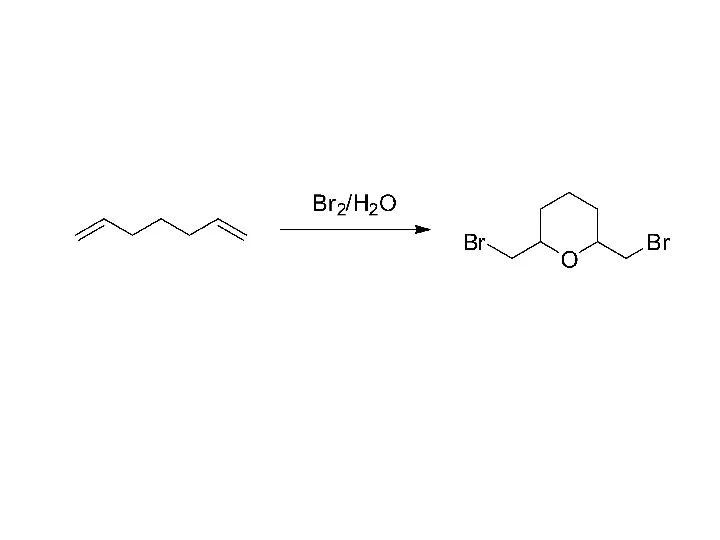 Превращение (S)-бутанол-2 в другие соединения
Превращение (S)-бутанол-2 в другие соединения Термодинамика химических процессов
Термодинамика химических процессов Углерод и его оксиды
Углерод и его оксиды Расчет процесса горения: состав горючей системы и расчет количества воздуха, необходимого для горения
Расчет процесса горения: состав горючей системы и расчет количества воздуха, необходимого для горения Электрохимические методы анализа
Электрохимические методы анализа Строение атома углерода. Валентные состояния атома углерода
Строение атома углерода. Валентные состояния атома углерода Аминокислоты
Аминокислоты Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Хлор (лат. Chlorum, Cl)
Хлор (лат. Chlorum, Cl) Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Соединения углерода
Соединения углерода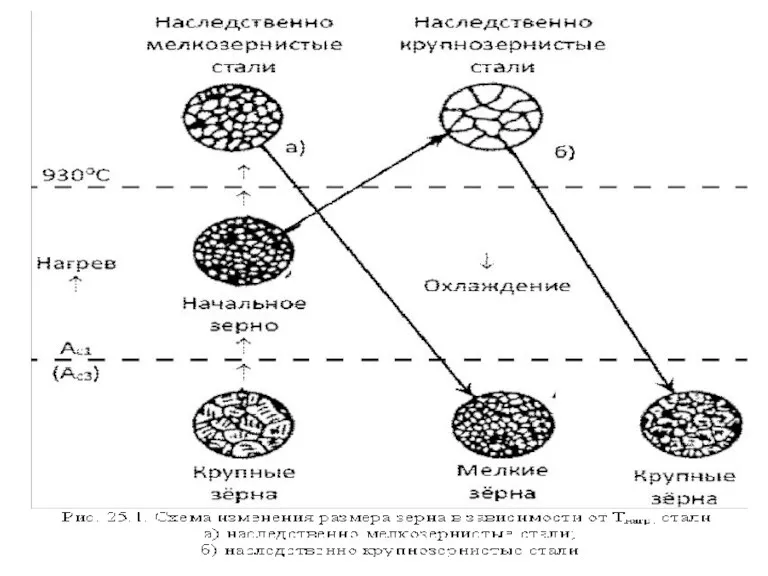 Материаловедение-2
Материаловедение-2 Мұнайды өңдеудің химиялық процестерінің теориялық негіздері
Мұнайды өңдеудің химиялық процестерінің теориялық негіздері Фосфор и его соединения
Фосфор и его соединения Функциональные производные с простой связью C-“Э”. Часть 4 …окси-производные
Функциональные производные с простой связью C-“Э”. Часть 4 …окси-производные Қышқылдар мен сілтілер тепе-теңдігі
Қышқылдар мен сілтілер тепе-теңдігі