Содержание
- 2. Оксид углерода (II) Состав. Строение 2. Получение а) в лаборатории б) в промышленности 5. Химические свойства
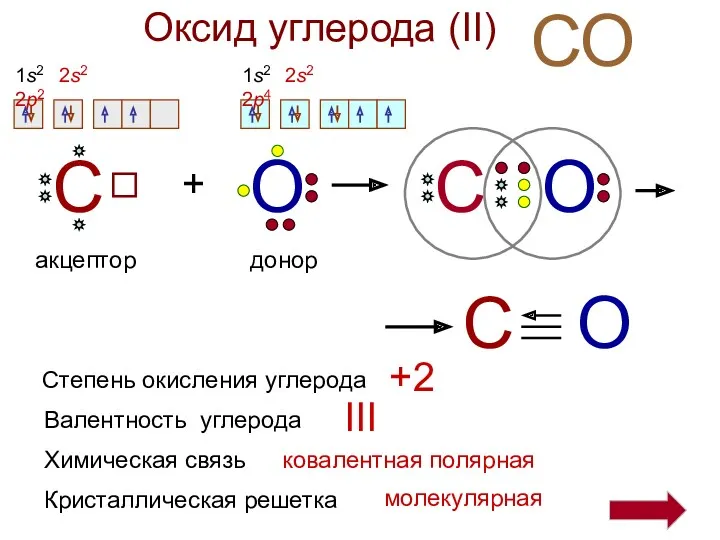
- 3. Оксид углерода (II) СО С + О С О С О донор акцептор Степень окисления углерода
- 4. Монооксид углерода представляет собой бесцветный и неимеющий запаха газ, малорастворимый в воде. Растворимость СО в воде
- 5. На человека угарный газ воздействует как сильнодействующий яд. Сущность отравления угарным газом состоит в том, что
- 6. Никогда не оставляйте в гараже машину с включенным двигателем, даже если двери гаража открыты. Никогда не
- 7. Химические свойства оксида углерода (II) Угарный газ реагирует с пероксидом натрия Na2O2 с образованием соды –
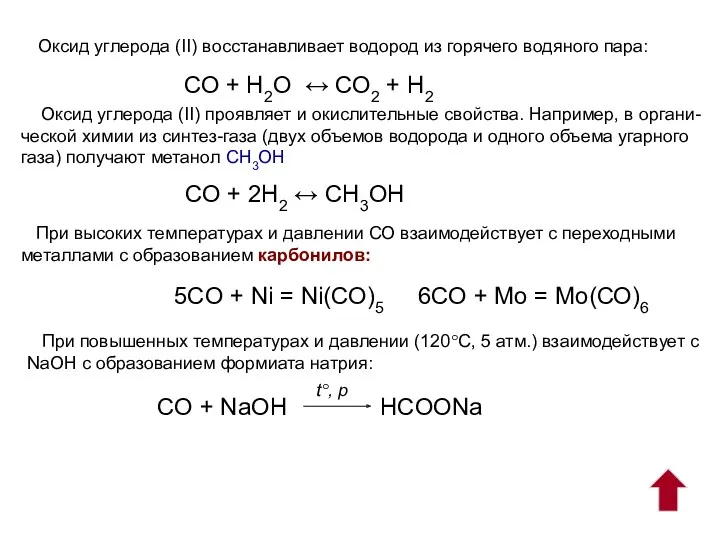
- 8. Оксид углерода (II) восстанавливает водород из горячего водяного пара: СО + Н2О ↔ СО2 + Н2
- 9. Применение оксида углерода (II) 1. Угарный газ служит сырьем для получения метилового спирта и некоторых других
- 10. Оксид углерода (IV) cолеобразующий кислотный оксид Состав. Строение. 2. Физические свойства. 3. Получение: а) в лаборатории;
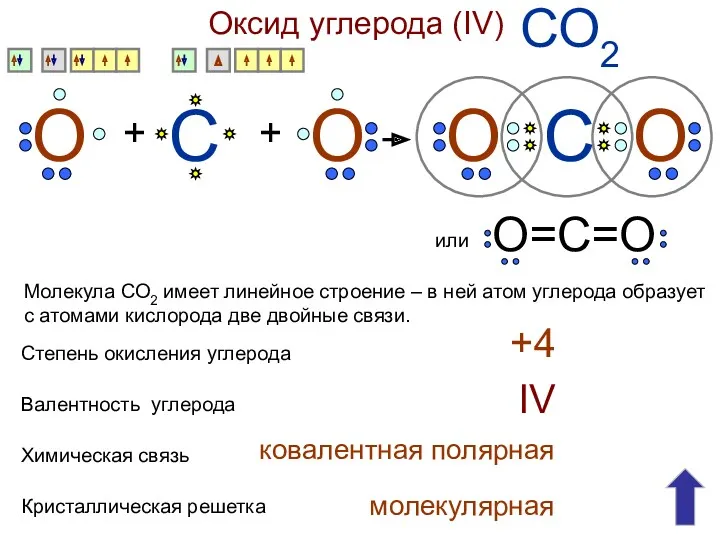
- 11. Оксид углерода (IV) СО2 С О + О + О О С О=С=О или Степень окисления
- 12. Физические свойства оксида углерода (IV) Dвоздуху(СО2) M(СО2) M(воздуха) = 29г/моль 44г/моль = 1,5 = = агрегатное
- 13. Физические свойства углекислого газа Углекислый газ в зависимости от давления и температуры может находится в газообразном,
- 14. Содержание углекислого газа в атмосфере Земли сейчас самое высокое за последние 650 тысяч лет. Увеличение его
- 15. Получение и распознавание углекислого газа Составьте уравнение реакции получения углекислого газа в лаборатории СаСО3 + 2HCl
- 16. Получение углекислого газа в промышленности 3. из отходящих газов химических производств, прежде всего синтетического аммиака и
- 17. Химические свойства оксида углерода (IV) Взаимодействие с водой: Углекислый газ растворим в воде: при 20 С
- 18. 4. Взаимодействие с магнием: Составьте уравнение реакции взаимодействия углекислого газа с магнием. Рассмотрите с т. зр.
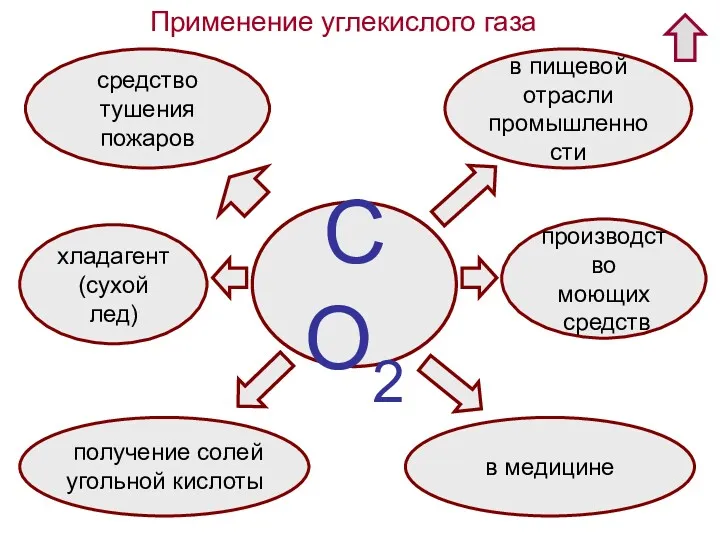
- 19. Применение углекислого газа СО2 хладагент (сухой лед) средство тушения пожаров в пищевой отрасли промышленности производство моющих
- 20. Средство тушения пожаров
- 21. Хладагент (сухой лед)
- 22. в пищевой отрасли промышленности
- 23. производство моющих средств
- 24. получение солей угольной кислоты кальцинированная сода (Na2CO3) питьевая (пищевая) сода (NаНCO3) кристаллическая сода Nа2CO3·10Н2О
- 25. Терапия с применением углекислого газа в медицине
- 26. Угольная кислота и ее соли 1. Состав. Строение 2. Классификация 3. Соли угольной кислоты 4. Качественная
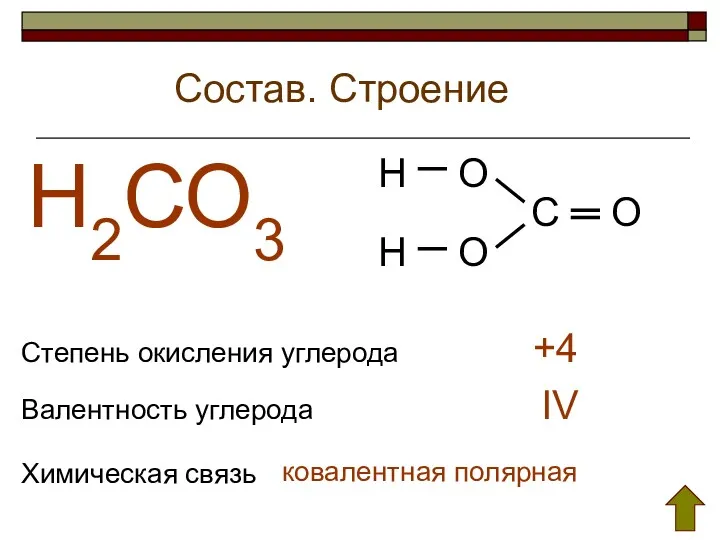
- 27. Состав. Строение Н2СО3 Степень окисления углерода Валентность углерода +4 IV Химическая связь ковалентная полярная Н Н
- 28. Угольная кислота (Н2СО3). Классификация. наличию кислорода: основности: растворимости в воде: степени электролитической диссоциации: стабильности: кислородная двухосновная
- 29. Соли угольной кислоты карбонаты гидрокарбонаты Составьте уравнения реакций получения карбоната кальция, перехода карбоната в гидрокарбонат. Са(ОН)2
- 31. Скачать презентацию























 Основи. Склад, назви, класифікація, використання
Основи. Склад, назви, класифікація, використання Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Тепловой эффект химической реакции
Тепловой эффект химической реакции Переходные элементы
Переходные элементы Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Химическая связь
Химическая связь Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Хімічні властивості кислот
Хімічні властивості кислот История открытия натурального каучука
История открытия натурального каучука Минералогический состав почв
Минералогический состав почв Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Химический элемент радий
Химический элемент радий Ask the right question to find the best answer
Ask the right question to find the best answer Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Водород
Водород Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Серная кислота
Серная кислота Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини
Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН Щелочи
Щелочи Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Перманганат калия
Перманганат калия Химическая промышленность Донецкой области
Химическая промышленность Донецкой области