Первые описания получения серной кислоты («купорового масла») дали итальянские учённые
В. Бирингучо в 1540 и немецкий алхимик, чьи труды были опубликованы под именем Василия Валентина. А первые заводы по производству серной кислоты были созданы в Великобритании в 1740 (Ричмонд), во Франции в 1766 (Руан), в Германии в 1810 (близ Лейпцига), в России в 1805 (в Московской губернии).
Серная кислота
Химическая формула: H2SO4
Молярная масса: 98.078 г/моль
Температура плавления: 10,38 °C
Температура кипения: 279,6 °C
Плотность вещества: 1,8356 г/см³
Растворимость: смешивается во всех соотношениях г/100 мл
Состояние: бесцветная маслянистая жидкость без запаха
Серная кислота и история её открытия








 Горение топлива
Горение топлива Арены. Бензол
Арены. Бензол Будова атома. Ядро й електронні оболонки. Склад атомних ядер
Будова атома. Ядро й електронні оболонки. Склад атомних ядер Спирты. Обобщающий урок
Спирты. Обобщающий урок Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Применение серной кислоты
Применение серной кислоты Свойства металлов
Свойства металлов Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Алкадиены. Циклоалканы. Лекция № 5
Алкадиены. Циклоалканы. Лекция № 5 Газовые законы для идеальных и реальных газов. Лекция 1
Газовые законы для идеальных и реальных газов. Лекция 1 Каталитический риформинг бензинов
Каталитический риформинг бензинов Арени. Бензен: молекулярна і структурна формули, фізичні властивості
Арени. Бензен: молекулярна і структурна формули, фізичні властивості Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Строение атома. Лекция 2
Строение атома. Лекция 2 Номенклатура углеводородов: алканов алкенов алкинов. Создание учебного пособия
Номенклатура углеводородов: алканов алкенов алкинов. Создание учебного пособия Кевлар. Структура кевлара
Кевлар. Структура кевлара Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Медь
Медь Химическая связь
Химическая связь Белки. Изучение органических веществ в 9-10 классе
Белки. Изучение органических веществ в 9-10 классе Этил спирті және оның адам ағзасына әсері
Этил спирті және оның адам ағзасына әсері Коррозия каменных и бетонных строительных конструкций
Коррозия каменных и бетонных строительных конструкций Рідкі кристали
Рідкі кристали Алкины - непредельные углеводороды с общей формулой CnH2n+2
Алкины - непредельные углеводороды с общей формулой CnH2n+2 Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества Химиялық элементтер
Химиялық элементтер Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения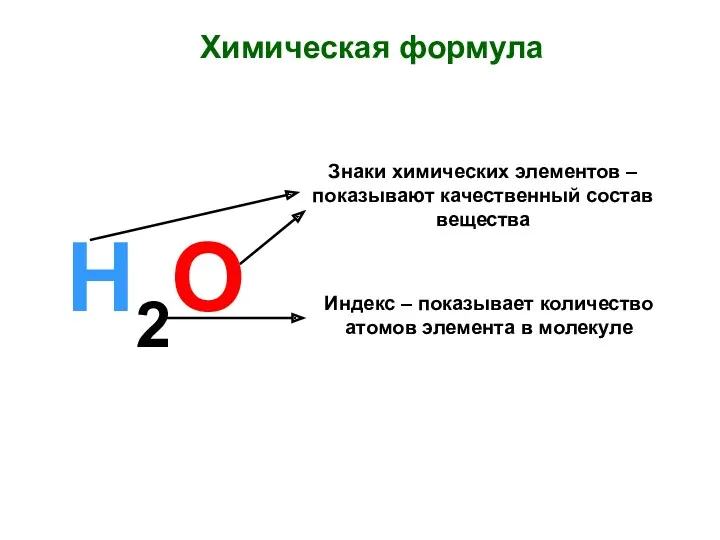 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов