Содержание
- 2. Після уроку ви зможете: називати фізичні властивості бензену; наводити приклади ароматичних вуглеводнів; складати на основі загальної
- 3. ПОНЯТТЯ ПРО АРЕНИ. За якісним складом арени належать до вуглеводнів і мають циклічну будову карбонового ланцюга.
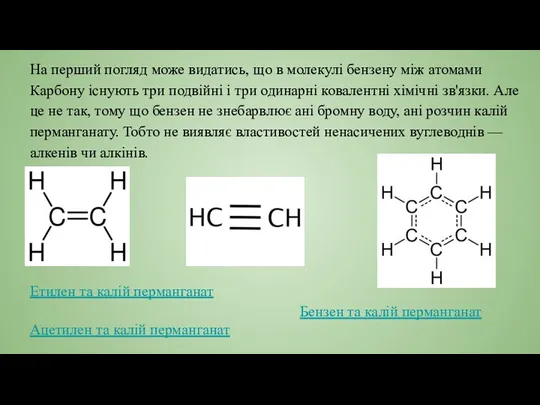
- 4. На перший погляд може видатись, що в молекулі бензену між атомами Карбону існують три подвійні і
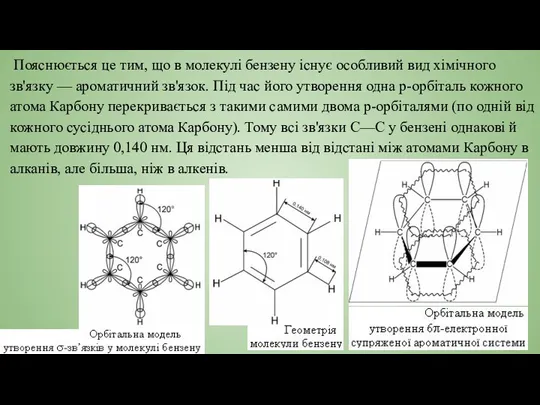
- 5. Пояснюється це тим, що в молекулі бензену існує особливий вид хімічного зв'язку — ароматичний зв'язок. Під
- 6. Тому точнішим є запис структурної формули бензену у вигляді правильного шестикутника з колом усередині нього (так
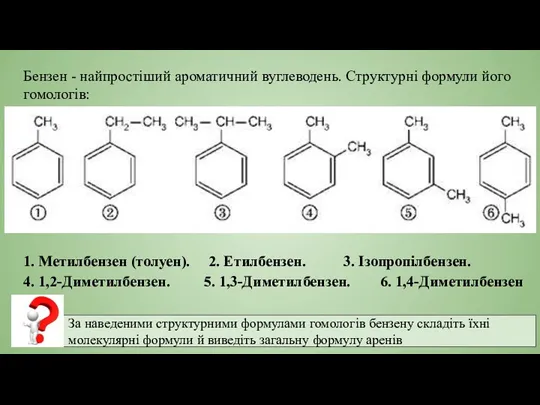
- 7. Бензен - найпростіший ароматичний вуглеводень. Структурні формули його гомологів: 1. Метилбензен (толуен). 2. Етилбензен. 3. Ізопропілбензен.
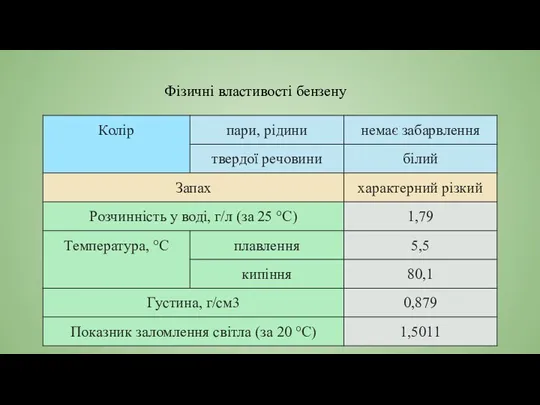
- 8. ФІЗИЧНІ ВЛАСТИВОСТІ АРЕНІВ. Бензен — безбарвна рідина з характерним запахом, нерозчинна у воді й легша за
- 9. Фізичні властивості бензену
- 10. ХІМІЧНІ ВЛАСТИВОСТІ БЕНЗЕНУ. Наявність особливого ароматичного хімічного зв'язку, в утворенні якого беруть участь відразу шість р-електронів,
- 11. Реакції заміщення. Галогенування. Ця реакція відбувається в присутності каталізаторів.
- 12. Реакції приєднання. Бензен вступає також у реакції приєднання, але важче, ніж алкени чи алкіни. У цих
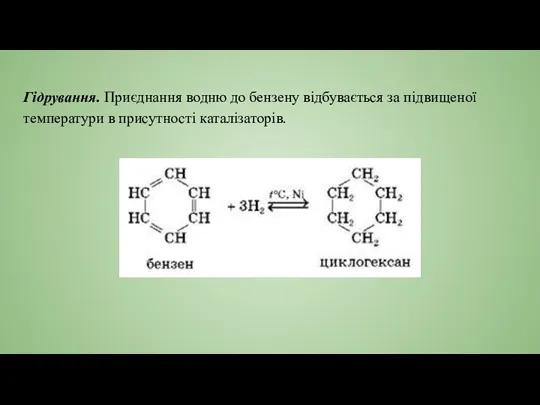
- 13. Гідрування. Приєднання водню до бензену відбувається за підвищеної температури в присутності каталізаторів.
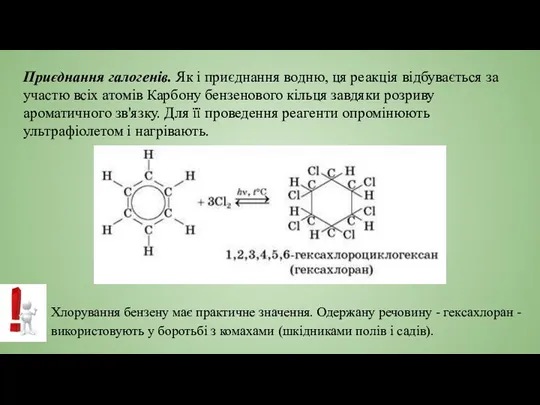
- 14. Приєднання галогенів. Як і приєднання водню, ця реакція відбувається за участю всіх атомів Карбону бензенового кільця
- 15. Окиснення бензену. Бензен стійкий до дії окисників і не знебарвлює розчин калій перманганату. Більш сильні окисники
- 16. Горіння (повне окиснення) бензену. Бенезен легкозаймистий на повітрі й згорає кіптявим полум'ям унаслідок високого вмісту Карбону
- 17. Використання Бензен використовують у виробництві пластмас, барвників, отрутохімікатів, лаків, вибухових речовин, синтетичних волокон, ліків та багатьох
- 18. Висновки: • Бензен С6Н6 — найпростіший представник вуглеводнів класу арени. • Молекула бензену має особливий ковалентний
- 20. Скачать презентацию











 Металлы и сплавы
Металлы и сплавы Периодический закон и ПСХЭ Д. И. Менделеева в свете учения о строении атома
Периодический закон и ПСХЭ Д. И. Менделеева в свете учения о строении атома Субстраты и продукты биохимических реакций
Субстраты и продукты биохимических реакций Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс
Созвездие талантов. Игра-зачет по теме Основные классы неорганической химии 8 класс Химические свойства металлов
Химические свойства металлов Електеу дегеніміз
Електеу дегеніміз Химико-лесной комплекс
Химико-лесной комплекс Алкени та алкіни
Алкени та алкіни Побочная подгруппа 1 и 2. Медь
Побочная подгруппа 1 и 2. Медь Свойства растворов электролитов
Свойства растворов электролитов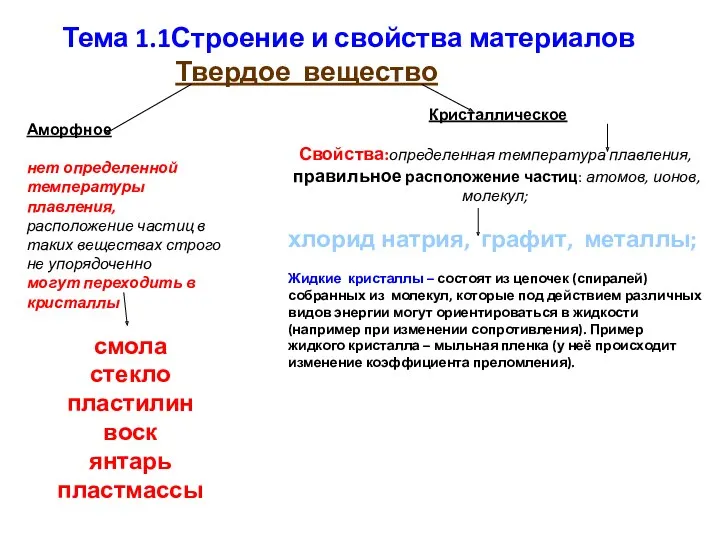 Строение и свойства материалов. Тема 1.1
Строение и свойства материалов. Тема 1.1 Целлюлоза
Целлюлоза Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини
Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини Горючее, смазочные материалы и специальные жидкости
Горючее, смазочные материалы и специальные жидкости Координационные комплексные соединения
Координационные комплексные соединения Хімічні властивості кисню
Хімічні властивості кисню Иондар және олардың түзілуі
Иондар және олардың түзілуі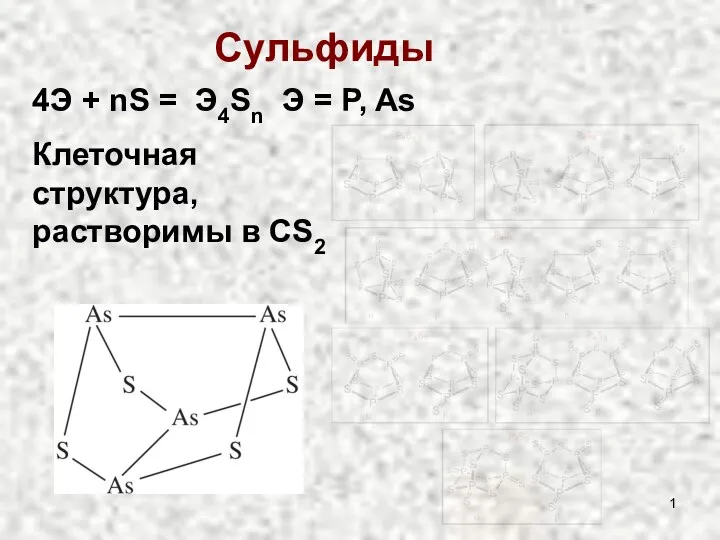 Сульфиды и оксиды
Сульфиды и оксиды Цинк и его соединения
Цинк и его соединения Химический элемент уран
Химический элемент уран Алюминий и его соединения. Характеристика химического элемента: 3-й период, 3-я А подгруппа
Алюминий и его соединения. Характеристика химического элемента: 3-й период, 3-я А подгруппа Взаимодействие ускоренных ионов с веществом (часть 1)
Взаимодействие ускоренных ионов с веществом (часть 1) Гидролиз солей. Гидроксиды
Гидролиз солей. Гидроксиды Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс
Вещества и их системы. Растворы. Массовая доля растворенного вещества. 11 класс Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная ОВР в органической химии
ОВР в органической химии Метанол, етанол, гліцерин
Метанол, етанол, гліцерин