Содержание
- 2. Гидроксиды NaOH, KOH, NH4OH, Cu(OH)2, Zn(OH)2, Al(OH)3, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr, H2SO3, H2CO3,
- 3. 03/04/2024 Громова О.И Электролиты сильные: NaOH, KOH, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr; слабые: ,
- 4. 03/04/2024 Громова О.И Изменение цвета различных индикаторов при действии растворов кислот и щелочей
- 5. 03/04/2024 Громова О.И Любую соль можно представить как продукт взаимодействия основания с кислотой. В зависимости от
- 6. 03/04/2024 Громова О.И 1.Соли, образованные сильной кислотой и слабым основанием (AlCl3, FeSO4, Mn(NO3)2.) 2. Соли, образованные
- 7. 03/04/2024 Громова О.И Гидролизом называется взаимодействие веществ с водой, при котором составные части вещества соединяются с
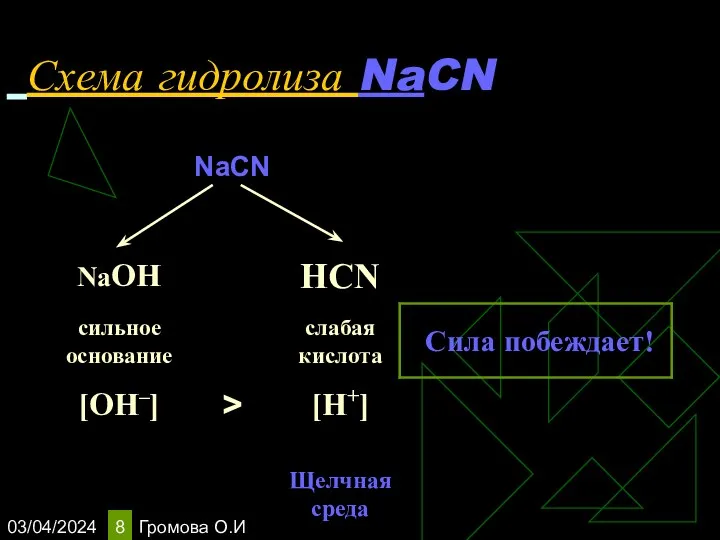
- 8. 03/04/2024 Громова О.И Схема гидролиза NaCN
- 9. 03/04/2024 Громова О.И Уравнения гидролиза NaCN NaCN ↔Na+ + CN‾ Н2О ↔ OH ‾ + H+
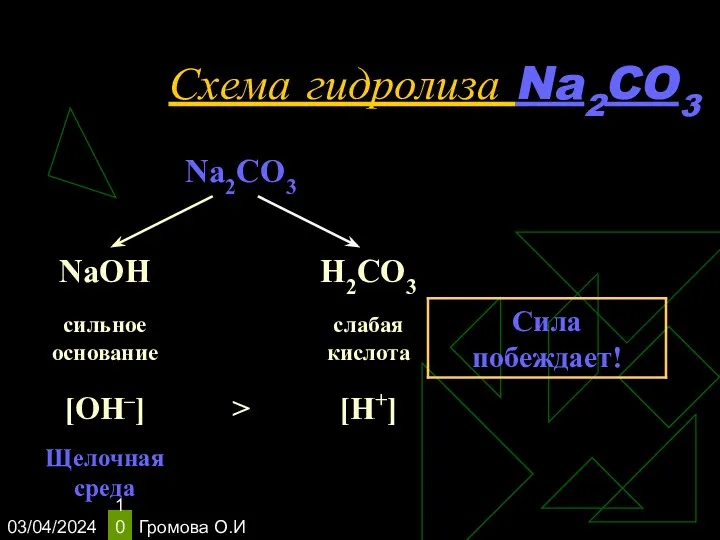
- 10. 03/04/2024 Громова О.И Схема гидролиза Na2CO3
- 11. 03/04/2024 Громова О.И Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН–
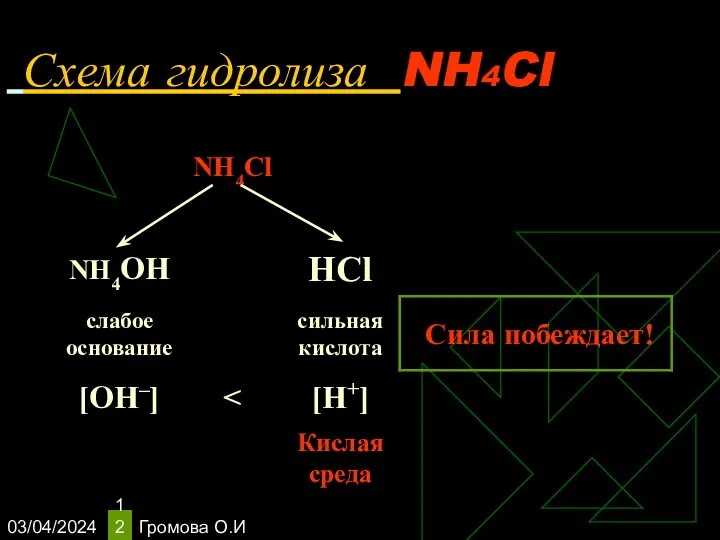
- 12. 03/04/2024 Громова О.И Схема гидролиза NH4Cl
- 13. 03/04/2024 Громова О.И Уравнения гидролиза NH4Cl NH4Cl ↔ NH4+ + Сl– Н2O ↔ Н+ + ОН–
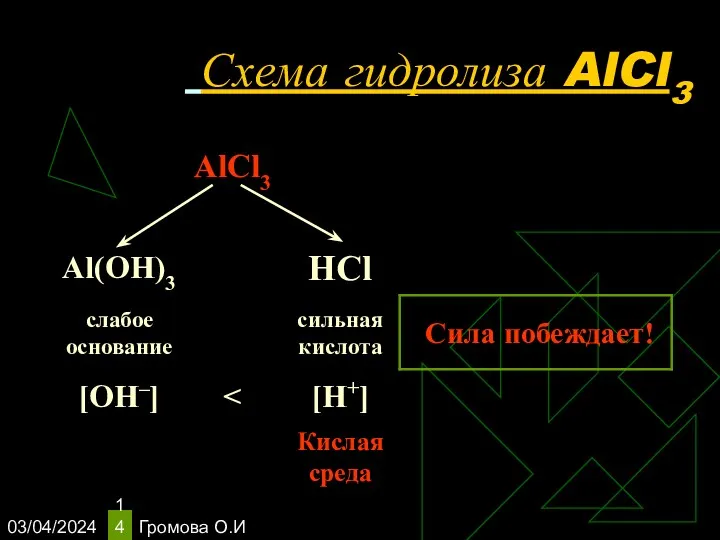
- 14. 03/04/2024 Громова О.И Схема гидролиза AlCl3
- 15. 03/04/2024 Громова О.И Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН–
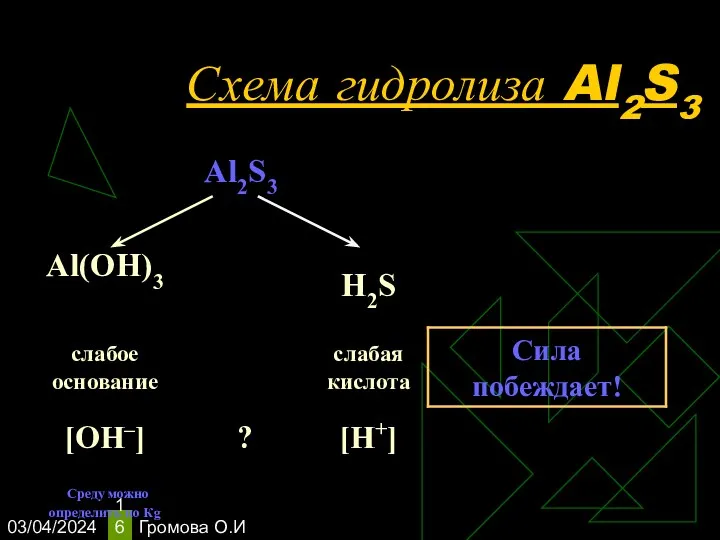
- 16. 03/04/2024 Громова О.И Схема гидролиза Al2S3
- 17. 03/04/2024 Громова О.И Уравнения гидролиза Al2S3 Al2S3 + 6H2O-->2Al(OH)3 + 3H2S Гидролиз по катиону и аниону.
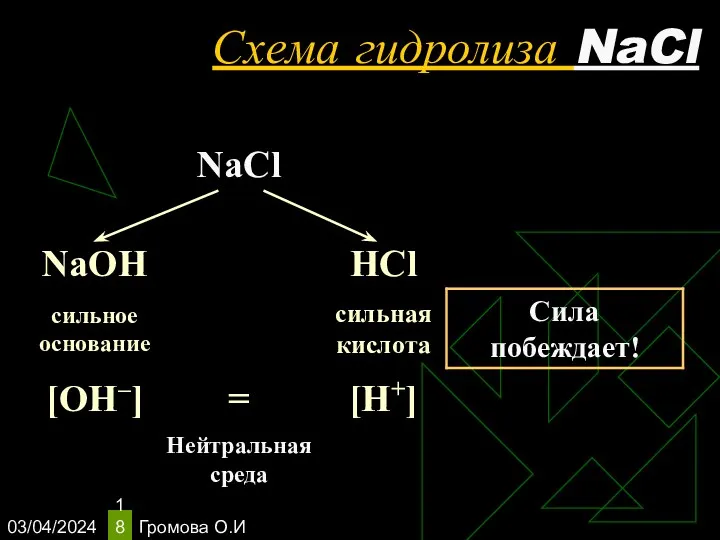
- 18. 03/04/2024 Громова О.И Схема гидролиза NaCl
- 19. 03/04/2024 Громова О.И Уравнения гидролиза NaCl NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН–
- 20. 03/04/2024 Громова О.И Выполните следующие задания Какую среду будут иметь водные растворы следующих солей: 1 вариант
- 21. 03/04/2024 Громова О.И Ответы
- 22. 03/04/2024 Громова О.И Zn(NO3)2 ↔ Zn2+ + 2NO3– Н2O ↔ Н+ + ОН – ________________________________________________________ Zn2+
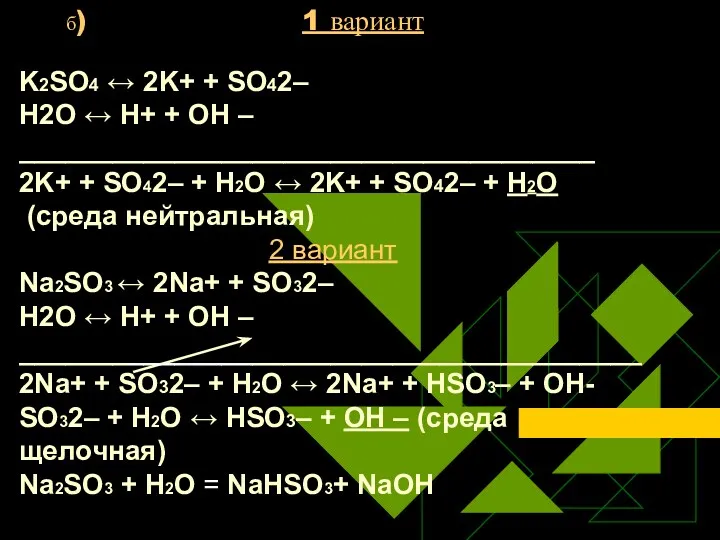
- 23. б) 1 вариант K2SO4 ↔ 2K+ + SO42– Н2O ↔ Н+ + ОН – _____________________________________ 2K+
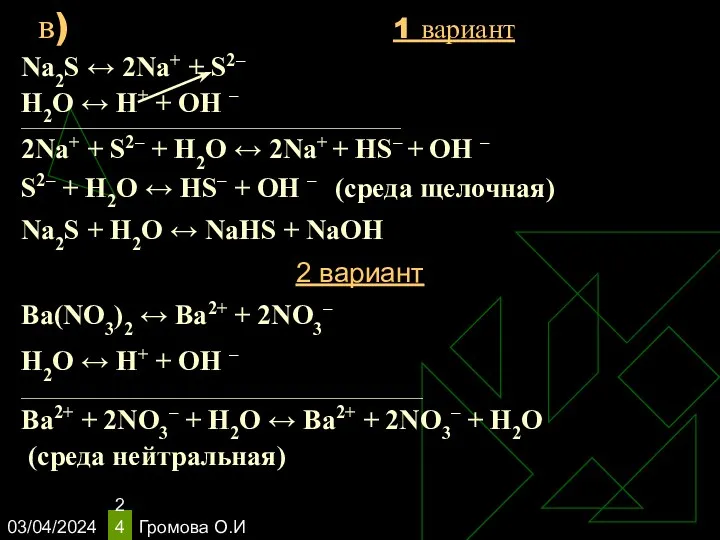
- 24. 03/04/2024 Громова О.И Na2S ↔ 2Na+ + S2– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+
- 25. 03/04/2024 Громова О.И Задания ЕГЭ
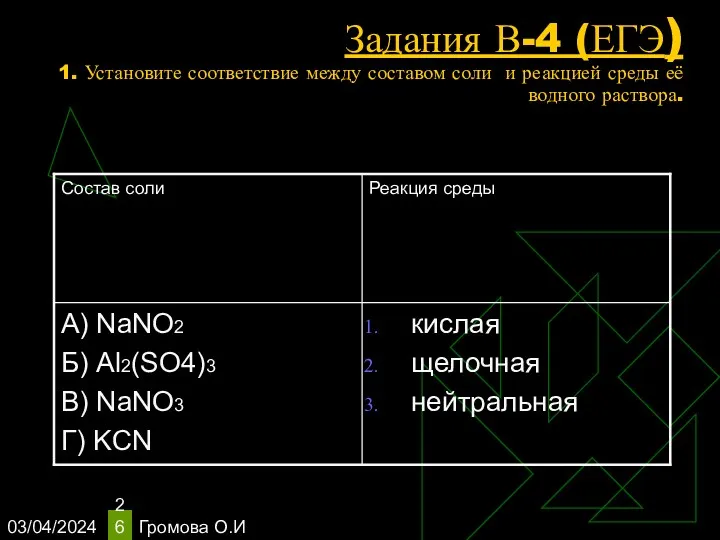
- 26. 03/04/2024 Громова О.И Задания В-4 (ЕГЭ) 1. Установите соответствие между составом соли и реакцией среды её
- 27. 03/04/2024 Громова О.И 2. Установите соответствие между составомсоли и реакцией среды её водного раствора.
- 28. 03/04/2024 Громова О.И 3. Установите соответствие между названием соли и средой её водного раствора.
- 29. 03/04/2024 Громова О.И Задние на дом: Параграф 18, № 1-11. В контакте. Ru, в заметках, материал
- 31. Скачать презентацию



















 Аминокислоты 2
Аминокислоты 2 Магний. Нахождение в природе
Магний. Нахождение в природе Цветные металлы и сплавы
Цветные металлы и сплавы Концентрации растворов
Концентрации растворов Небезпечні хімічні речовини
Небезпечні хімічні речовини Медь и её соединения
Медь и её соединения Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Расстояние между молекулами в разных агрегатных состояниях
Расстояние между молекулами в разных агрегатных состояниях Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Азотовмісні сполуки
Азотовмісні сполуки Кристаллография, кристаллохимия, минералогия
Кристаллография, кристаллохимия, минералогия Знаки химических элементов. Химические формулы. Химический диктант
Знаки химических элементов. Химические формулы. Химический диктант Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс
Химическое равновесие в гомогенных системах. Ионное произведение воды. 12 класс Изомерия и ее виды
Изомерия и ее виды Берилій
Берилій Новые интеллектуальные материалы на основе полимеров
Новые интеллектуальные материалы на основе полимеров Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Вуглеводні. Лекція 11
Вуглеводні. Лекція 11 Алмазы. Бриллианты
Алмазы. Бриллианты Растворы. Общие свойства растворов
Растворы. Общие свойства растворов Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность