Содержание
- 2. СТРОЕНИЕ. Медь-элемент побочной подгруппы 1 группы. Строение атома: +12Сu 1s2|2s22p6|3s23p63d10|4s1|
- 3. Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения и малой
- 4. Нахождение в природе. Медь встречается в природе в основном в связанном виде и входит в состав
- 5. Нахождение в природе. Нередко встречаются месторождения меди в осадочных породахНередко встречаются месторождения меди в осадочных породах
- 6. Физические свойства Медь – металл светло-розового цвета, тягучий, вязкий, легко прокатывается. Температура плавления 1083 градуса по
- 7. Химические свойства. В сухом воздухе и при обычной температуре медь почти не изменяется. А при повышенной
- 8. Взаимодействие с простыми веществами. С кислородом 2Cu+O2 2CuO оксид меди(2) С серой Cu+S CuS сульфид меди
- 9. Взаимодействие со сложными веществами. Находясь в ряду напряжений левее водорода медь не вытесняет водород из разбавленных
- 10. Одним из основных свойств меди во всех степенях окисления является способность образовывать комплексные соединения. Большинство растворимых
- 11. Аммиачные комплексы образуются при действии аммиака на растворы солей меди (II) : CuSO4 + 4NH3 =
- 12. Оксид меди (I) Cu2O - Амфотерный оксид. Кристаллическое вещество коричнево-красного цвета. Оксид меди(I) не реагирует с
- 13. Оксид меди (II) CuO CuO — основный оксид . Кристаллы чёрного цвета, в обычных условиях довольно
- 14. Гидроксид меди (II) Cu(OH)2 Гидроксид меди(II) - голубое аморфное или кристаллическое вещество, практически не растворимое в
- 15. Получение. Процесс получения меди весьма сложный. Упрощенно процесс ее производства из медного блеска отразить можно так:
- 16. Применение. Чистая медь используется в электротехнической промышленности для изготовления электрических проводов, кабелей и в теплообменных аппаратах.
- 17. Применение Медь широко применяется в электротехникеМедь широко применяется в электротехнике для изготовления силовых кабелей, проводов или
- 18. Медь широко используется для роизводства медных труб применяющихся для транспортировки жидкостей и газов В разнообразных областях
- 19. Ювелирные сплавы В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к
- 20. Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии
- 21. Соединения меди. CuSO4 –сульфат меди (белый порошок). CuSO4*5H2O –медный купорос (голубой порошок). CuCl2*2H2O –хлорид меди (темно-зеленый
- 22. 1. Оксид меди (2) получение: 2Cu+O2 2CuO черный порошок, проявляет свойства основного оксида взаимодействует с кислотами:
- 23. Биологическая роль Медь - необходимый элемент для высших растений и животных. После усваивания меди кишечникомПосле усваивания
- 25. Скачать презентацию






















 Цинк и его соединения
Цинк и его соединения Химический анализ веществ
Химический анализ веществ Лекция 4. Классификация и механизмы органических реакций
Лекция 4. Классификация и механизмы органических реакций Химиялық термодинамиканың негізгі түсініктерінің биохимияда қолданылуы
Химиялық термодинамиканың негізгі түсініктерінің биохимияда қолданылуы Атомы и молекулы
Атомы и молекулы Нуклеин қышқылдары
Нуклеин қышқылдары Определение расхода воздуха на горение, количество и температуру продуктов
Определение расхода воздуха на горение, количество и температуру продуктов Физико-химические и пожароопасные свойства углеводородов. (Тема 3.1)
Физико-химические и пожароопасные свойства углеводородов. (Тема 3.1) Химический элемент кремний
Химический элемент кремний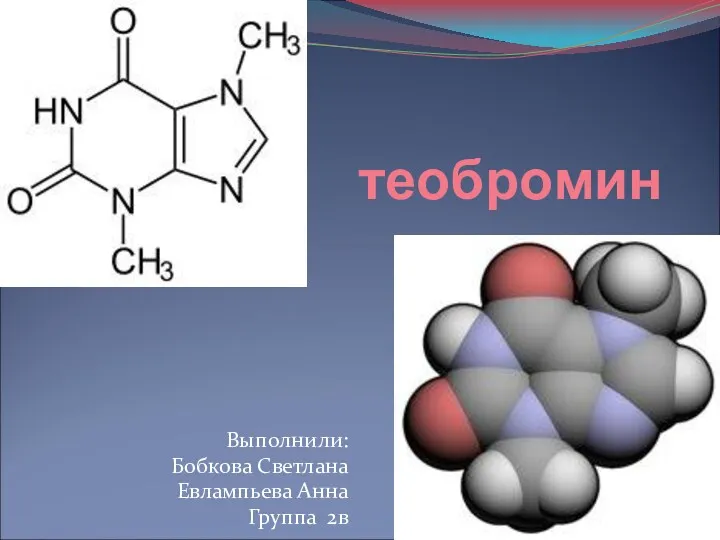 Теобромин
Теобромин Алюминий и его соединения
Алюминий и его соединения Реакционная способность соединений с карбонильной группой
Реакционная способность соединений с карбонильной группой Хімія в побуті
Хімія в побуті Алканы. Способы получения алканов. Химические свойства алканов
Алканы. Способы получения алканов. Химические свойства алканов Химическая связь
Химическая связь Резина. Свойства резины
Резина. Свойства резины Марганец. Железо
Марганец. Железо Классификация кристаллов по типу химической связи
Классификация кристаллов по типу химической связи Молярный объем газов
Молярный объем газов Массовая доля вещества в растворе
Массовая доля вещества в растворе Строение атома
Строение атома Задача №5. Свинцовый водопровод. Команда Карбораны
Задача №5. Свинцовый водопровод. Команда Карбораны Особенности строения твердых тел
Особенности строения твердых тел Водород и щелочные металлы
Водород и щелочные металлы Многоядерные ароматические углеводороды
Многоядерные ароматические углеводороды Теория растворов электролитов и неэлектролитов
Теория растворов электролитов и неэлектролитов Серная кислота и ее соли
Серная кислота и ее соли Общие способы получения металлов
Общие способы получения металлов