Содержание
- 2. Условие задачи Существует мнение, что свинцовый водопровод в древнем Риме отрицательно повлиял на здоровье людей античности.
- 3. Цель: определить влияние «свинцовых» труб на здоровье римлян Задачи: Предположить, какие вредные для здоровья вещества могли
- 4. Ограничения решения задачи: будем считать, что вода в районе водозабора не содержит органических веществ. среда воды
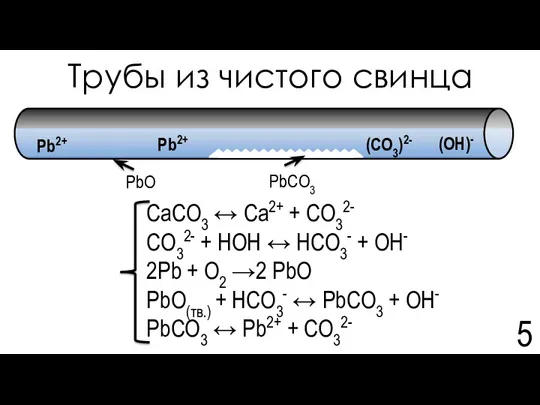
- 5. Трубы из чистого свинца CaCO3 ↔ Ca2+ + CO32- CO32- + HOH ↔ HCO3- + OH-
- 6. Трубы из чистого свинца 25. Guidelines for drinking-water quality, fourth edition, WHO, 2011, 564 pages, ISBN:
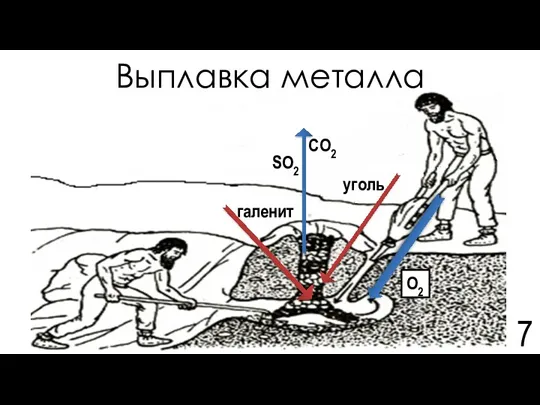
- 7. Выплавка металла галенит уголь SO2 O2 CO2
- 8. Химия процесса выплавки Обжиг: Me2+nSn-2 + (0,5k+n)O2 (из воздуха) → Me2+kOk-2 + nSO2↑, где k≥n Восстановление:
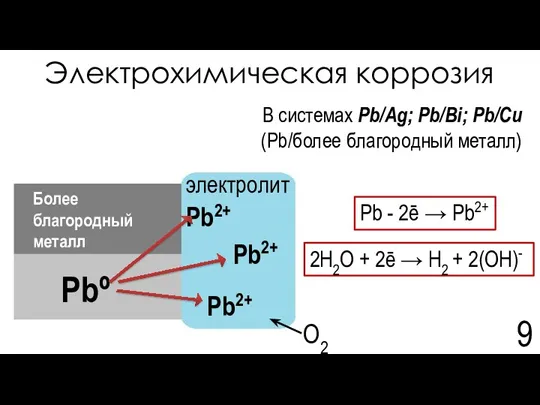
- 9. Электрохимическая коррозия В системах Pb/Ag; Pb/Bi; Pb/Cu (Pb/более благородный металл) 2H2O + 2ē → H2 +
- 10. Электрохимическая коррозия 25. Guidelines for drinking-water quality, fourth edition, WHO, 2011, 564 pages, ISBN: 978 92
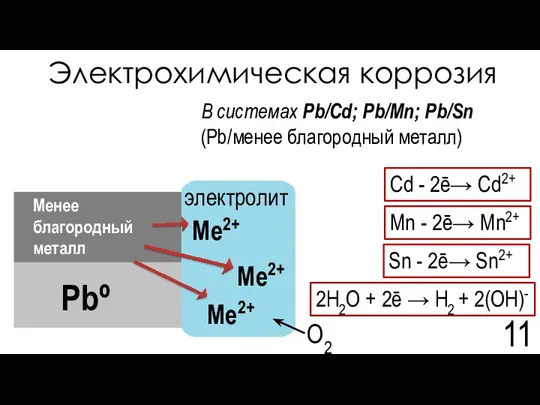
- 11. Электрохимическая коррозия 2H2O + 2ē → H2 + 2(OH)- Cd - 2ē→ Cd2+ электролит В системах
- 12. Электрохимическая коррозия 25. Guidelines for drinking-water quality, fourth edition, WHO, 2011, 564 pages, ISBN: 978 92
- 13. Электрохимическая коррозия 25. Guidelines for drinking-water quality, fourth edition, WHO, 2011, 564 pages, ISBN: 978 92
- 14. Электрохимическая коррозия 25. Guidelines for drinking-water quality, fourth edition, WHO, 2011, 564 pages, ISBN: 978 92
- 15. «Исправление» вина 2Pb+4H++4(CH3COO)- + O2(из воздуха) → 2Pb2++ 4(CH3COO)- + 2H2O m(Pb2+)на 1л = 10,35 г/л
- 16. Общие выводы по задаче: 1. В следствие контакта водопроводной воды с трубой, изготовленной в древности, в
- 17. Общие выводы по задаче: 2. Отравление римлян свинцом могло иметь место из-за повсеместного использования технологии «исправления»
- 18. Общие выводы по задаче: 3. Влияние на здоровье римлян «свинцового» водопровода было незначительным и лишь дополняющим
- 19. Общие выводы по задаче: 4.Так как ПДК превышена не была, то очищать воду не нужно.
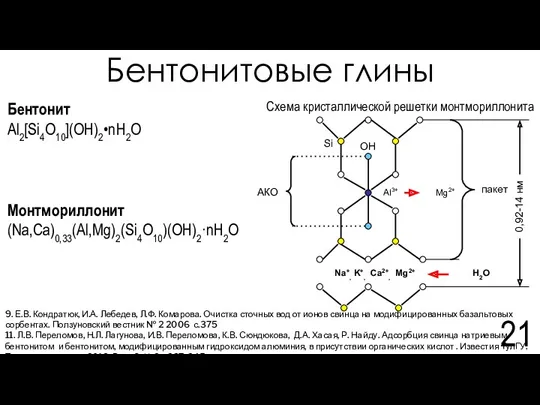
- 21. Бентонитовые глины 9. Е.В. Кондратюк, И.А. Лебедев, Л.Ф. Комарова. Очистка сточных вод от ионов свинца на
- 22. Абрамов А.А., 1972. Влияние pH и окислительно-восстановительного потенциала раствора на состояние поверхности сульфида свинца (галенита)// Обогащение
- 23. 15. Турова Н.Я. Справочные таблицы по неорганической химии.«Химия». Л. 1977.-116с. 16. Чесноков Б.В., Бушмакин А.Ф., Аронскинд
- 24. Спасибо за внимание!
- 25. Трубы из чистого свинца Вывод: ПДК ионов Pb2+ не была превышена 10. Ю.Ю.Лурье Справочник по аналитической
- 26. Галенит Галенит – это минерал, имеющий примеси соединений селена(Me2n+Sen-2) марганца(MnS) серебра(Ag2S) мышьяка(As2S3) кадмия(CdS) сурьмы(SbS) висмута(BiS) меди(CuS)
- 27. Химия процесса выплавки Обжиг: 2PbS + 3O2 → 2PbO + 2SO2↑ PbS + 2PbO → 3Pb
- 28. Химия процесса выплавки II. Восстановление: PbO + C(древесный) → Pb + CO↑ (800 oC) 2PbO +
- 29. Электрохимическая коррозия Вывод: ПДК ионов Pb2+ не была превышена 10. Ю.Ю.Лурье Справочник по аналитической химии. М.,
- 30. Электрохимическая коррозия Вывод: ПДК ионов Cd2+ не была превышена 10. Ю.Ю.Лурье Справочник по аналитической химии. М.,
- 31. Электрохимическая коррозия Вывод: ПДК ионов Mn2+ не была превышена 10. Ю.Ю.Лурье Справочник по аналитической химии. М.,
- 32. Электрохимическая коррозия Вывод: ПДК ионов Sn2+ не была превышена 10. Ю.Ю.Лурье Справочник по аналитической химии. М.,
- 33. «Исправление» вина 2Pb + 4H+ + 4(CH3COO)- + O2(из воздуха) → 2Pb2++ 4(CH3COO)- + 2H2O ω(CH3COOH)в
- 34. Равновесие между карбонатом и основанием свинца PbCO3(тв.) + 2OH- ↔ Pb(OН)2(тв.) + CO32- Михайлов В.А., Сорокина
- 35. Процессы растворения металлов в свинце Pb/Cd [8], [21], [22], [26]
- 36. Процессы растворения металлов в свинце Pb/Mn [8], [21], [22], [26]
- 37. Процессы растворения металлов в свинце Pb/Sn [8], [21], [22], [27]
- 39. Скачать презентацию




























![Процессы растворения металлов в свинце Pb/Cd [8], [21], [22], [26]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/188057/slide-34.jpg)
![Процессы растворения металлов в свинце Pb/Mn [8], [21], [22], [26]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/188057/slide-35.jpg)
![Процессы растворения металлов в свинце Pb/Sn [8], [21], [22], [27]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/188057/slide-36.jpg)
 Применение спиртов
Применение спиртов Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Курсовая работа. Оптимизация рецептуры вареных колбасных изделий по пищевым добавкам
Курсовая работа. Оптимизация рецептуры вареных колбасных изделий по пищевым добавкам Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Амины. Номенклатура аминов
Амины. Номенклатура аминов Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс ЕГЭ по химии. Задание 30-34
ЕГЭ по химии. Задание 30-34 Галогенопроизводные углеводородов 1
Галогенопроизводные углеводородов 1 Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Анализ двойных диаграмм. Лабораторная работа
Анализ двойных диаграмм. Лабораторная работа Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Химический элемент титан
Химический элемент титан Минерал чароит. Месторождения
Минерал чароит. Месторождения Тұздар гидролизі
Тұздар гидролизі Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Текстуры метаморфических пород
Текстуры метаморфических пород Ртуть и цинк
Ртуть и цинк АТФ Аденозинтрифосфат
АТФ Аденозинтрифосфат Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Вода. Растворимость, растворы
Вода. Растворимость, растворы Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс NaOH. Гидроксид натрия
NaOH. Гидроксид натрия Властивості і застосування каучуків. (Урок 15)
Властивості і застосування каучуків. (Урок 15) Водород и щелочные металлы
Водород и щелочные металлы Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение 20230306_gidroliz
20230306_gidroliz Интеллектуальная физико-химическая игра
Интеллектуальная физико-химическая игра