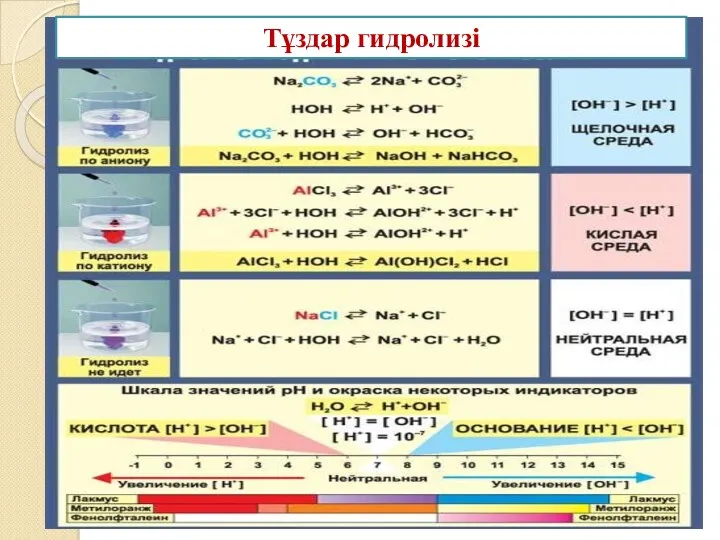
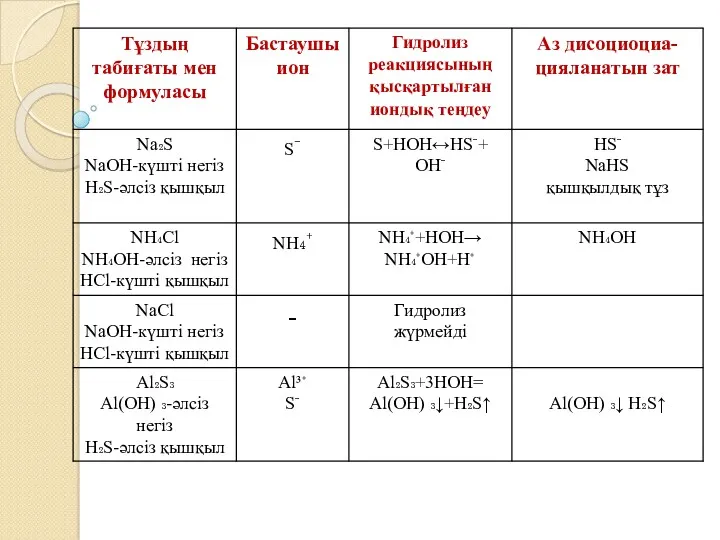
Күшті негіз бен күшті қышқылдан түзілген тұз сумен әрекеттеспейді (гидролизге ұшырамайды).
Орта бейтарап қалпын сақтайды.
Әлсіз негіз және күшті қышқылдан түзілген тұз құрамындағы металл катионы гидроксид ОН-ионымен байланысатындықтан, ерітіндіге Н+ иондары жиналып қышқылдық орта береді.
Күшті негіз бен әлсіз қышқылдан түзілген тұз анионы сутек катионымен Н+ байланысатындықтан, ерітіндіге ОН- иондары жиналып сілтілік орта береді.
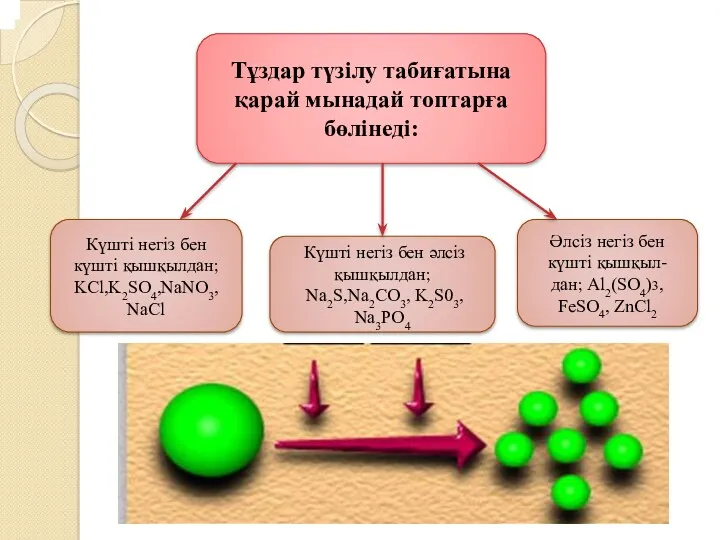
Әлсіз негіз бен әлсіз қышқылдан түзілген тұз құрамындағы иондар Н+ және ОН- иондарымен байланысатындықтан, гидролиздену реакциясы соңына дейін жүреді.
Қорытынды






 Органічні сполуки (9 клас)
Органічні сполуки (9 клас) Вредные вещества в продуктах питания
Вредные вещества в продуктах питания Обмен нуклеопротеинов
Обмен нуклеопротеинов Минералогия литофильных редких элементов. Бериллий
Минералогия литофильных редких элементов. Бериллий Приборы радиационной и химической разведки
Приборы радиационной и химической разведки Задачи по химии
Задачи по химии Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций Предмет химии. Вещества
Предмет химии. Вещества Введение в органическую химию
Введение в органическую химию Бумажная и тонкослойная хроматография
Бумажная и тонкослойная хроматография Химический элемент и вещество
Химический элемент и вещество Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Коллигативные свойства растворов
Коллигативные свойства растворов Энергетика химических процессов
Энергетика химических процессов Аминдердің химиялық қасиеттері
Аминдердің химиялық қасиеттері 1.1 Взрывчатые вещества и пороха
1.1 Взрывчатые вещества и пороха Презентация по химии по теме Решаем задачи Домашняя аптечка для 8, 9 класса
Презентация по химии по теме Решаем задачи Домашняя аптечка для 8, 9 класса Алкены. Строение алкенов
Алкены. Строение алкенов Неметаллические конструкционные материалы
Неметаллические конструкционные материалы Class micro and macro elements
Class micro and macro elements Оксиды неметаллов и кислородсодержащие кислоты. 11 класс
Оксиды неметаллов и кислородсодержащие кислоты. 11 класс Алкадиены (диеновые углеводороды)
Алкадиены (диеновые углеводороды) Химикаты для сельского хозяйства
Химикаты для сельского хозяйства Алкадиены. Актуализация ранее полученных знаний
Алкадиены. Актуализация ранее полученных знаний Кристалічний і аморфний стани твердих речовин
Кристалічний і аморфний стани твердих речовин Своя игра Знаешь ли ты химические элементы?
Своя игра Знаешь ли ты химические элементы? История развития химии
История развития химии Углерод
Углерод