Содержание
- 2. Система — комплекс взаимодействующих компонентов. Система — совокупность элементов, находящихся в определённых отношениях друг с другом
- 3. Система – совокупность взаимодействующих частиц, условно или фактически отделенных от окружающей среды Фаза – гомогенная часть
- 4. Гомогенная (однородная) система имеет одинаковые физические и химические свойства во всем своем объеме Гетерогенная (неоднородная) система
- 5. Функции состояния – это такие характеристики системы, которые не зависят от пути процесса, а только от
- 6. Термохимическим называется уравнение, записанное с указанием агрегатных состояний веществ и энтальпии H2(г) + 0,5O2(г) = H2O(г)
- 7. Стандартные условия: Чтобы сопоставить тепловые эффекты хим. реакций, надо ввести точки отсчета – стандартные условия. Нормальные
- 8. Энтальпия – это функция состояния которая при постоянном давлении характеризует внутреннюю энергию системы и ее способность
- 9. Тепловой эффект реакции, протекающей при V,T = const или P,T = const зависит только от вида
- 10. Применение закона Гесса Na2CO3(к) +10H2O(ж) =Na2CO3·10H2O(к); ΔHх =? Na2CO3(к) +500H2O(ж) =Na2CO3(раствор); ΔH1 =-25,1 к Дж Na2CO3·10H2O(к)
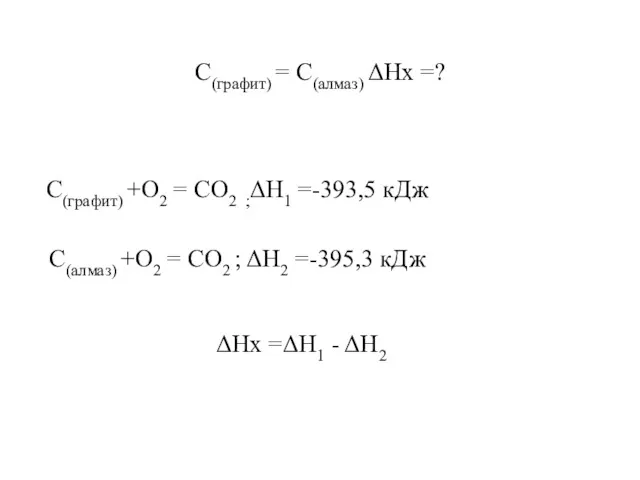
- 11. С(графит) = С(алмаз) ΔHх =? С(графит) +О2 = СО2 ;ΔH1 =-393,5 кДж С(алмаз) +О2 = СО2
- 12. Энтальпия связи – это энтальпия разрыва связей в 1 моле вещества, образующиеся при этом атомы разведены
- 13. Дано: N2 =2N(г) ΔH1 O2 =2O(г) ΔH2 1/2N2 +O2 =NO2(г) ΔH3 NО2 =N(г) +2O(г) ΔH=? ΔH=1/2ΔH1+
- 14. Тепловой эффект реакции горения моля жидкого бензола с образованием диокисда углерода (IV) и водяного пара равен
- 15. Энтропия – мера неупорядоченности системы, мера молекулярного беспорядка, мера хаотичности системы. ΔS0T = ΣST0(прод) – ΣSTO(исходных)
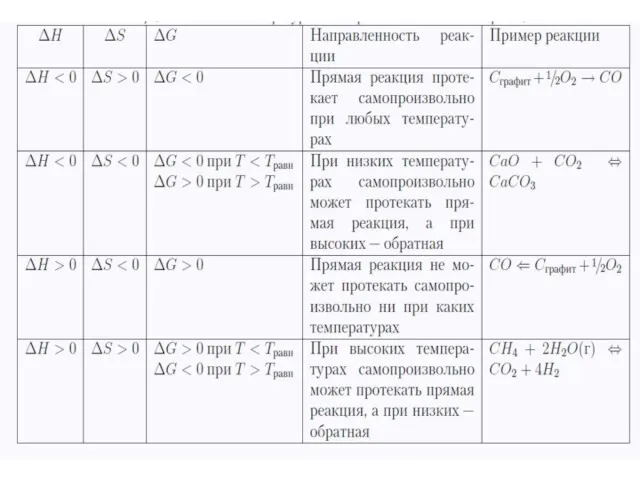
- 19. ΔS критерий самопроизвольности процесса ΔS>0 процесс самопроизвольный ΔS
- 20. На основании справочных данных по значениям энтропий соответствующих веществ вычислить энтропию реакции конверсии метана (Дж/моль∙K) ΔS0
- 21. ΔG° = ΣΔG°(прод)- ΣΔG°(исх. в-в) ΔG = ΔH – TΔS Свободная энергия Гиббса
- 24. Скачать презентацию










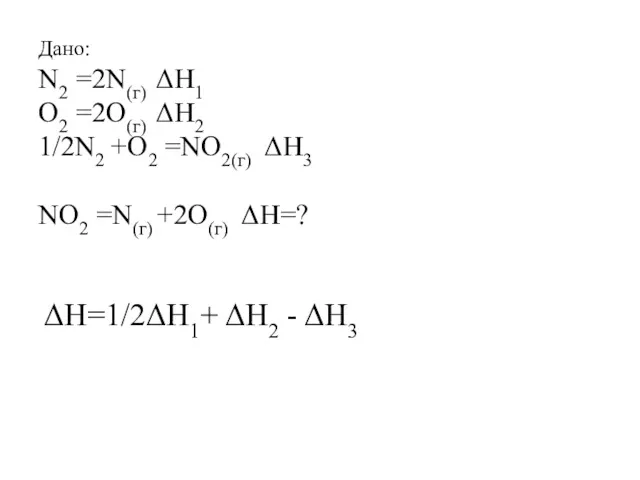








 Многоатомные спирты
Многоатомные спирты Моторные масла
Моторные масла Обмен липидов
Обмен липидов Детонаційна стійкість бензину
Детонаційна стійкість бензину Етери та естери
Етери та естери Вода. 8 класс
Вода. 8 класс Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Химическая связь
Химическая связь Производные хинолина и хинуклидина, производные 4-замещенных хинолина
Производные хинолина и хинуклидина, производные 4-замещенных хинолина Основные постулаты квантовой механики
Основные постулаты квантовой механики Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Алканы нефти. Содержание алканов в нефтяных фракциях
Алканы нефти. Содержание алканов в нефтяных фракциях Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1
Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1 Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10
Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10 Полимеры
Полимеры Металлы и неметаллы
Металлы и неметаллы Амины, аминокислоты; состав, получение, значение, применение
Амины, аминокислоты; состав, получение, значение, применение Теория электролитической диссоциации (ТЭД), ионные уравнения
Теория электролитической диссоциации (ТЭД), ионные уравнения Химическая технология органических веществ
Химическая технология органических веществ Полимеры. Полимерные материалы
Полимеры. Полимерные материалы Аномальные свойства воды
Аномальные свойства воды Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Геохимия. Геохимическая система элементов
Геохимия. Геохимическая система элементов Минеральные удобрения
Минеральные удобрения Чистые вещества и смеси
Чистые вещества и смеси Амины. Анилин
Амины. Анилин Кислотно-основное титрование
Кислотно-основное титрование Азот и его соединения
Азот и его соединения