Содержание
- 2. Ионная связь Возникает за счет электростатического притяжения + и – ионов друг к другу. Рассмотрим,как образуются
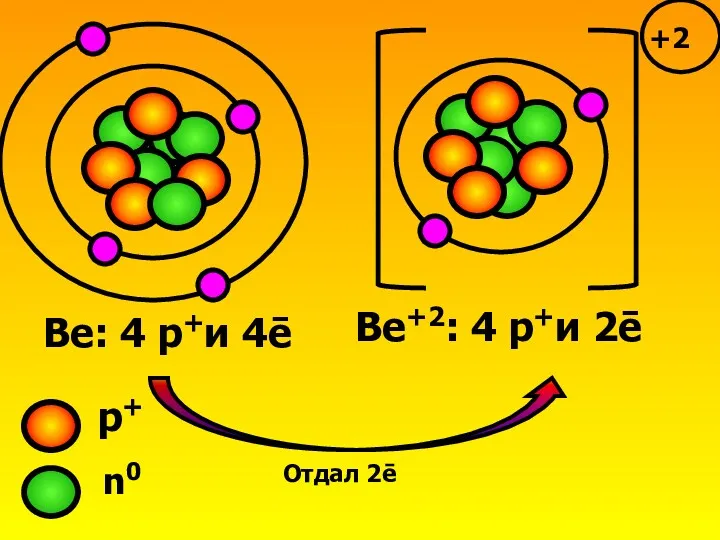
- 3. Ве: 4 р+и 4ē Ве+2: 4 р+и 2ē Отдал 2ē р+ n0 +2
- 4. Запомни! Бериллий приобрел ē-оболочку благородного газа гелия, но сам гелием не стал! У него остался прежним
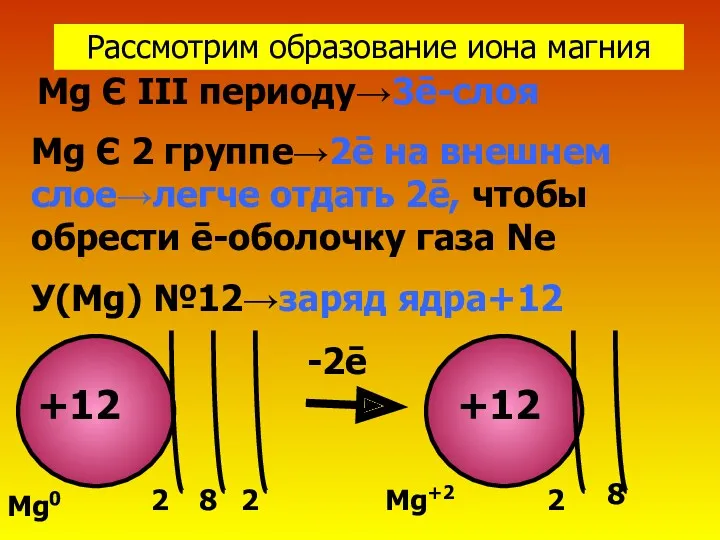
- 5. Рассмотрим образование иона магния Mg Є III периоду→3ē-слоя Mg Є 2 группе→2ē на внешнем слое→легче отдать
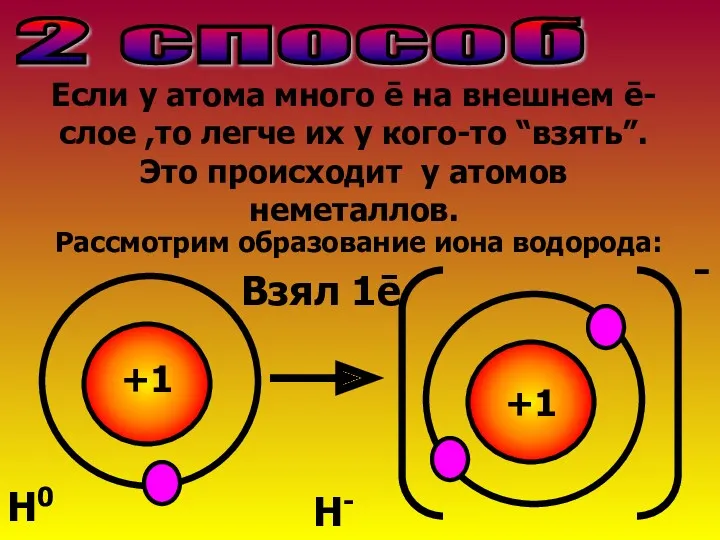
- 6. 2 способ Если у атома много ē на внешнем ē-слое ,то легче их у кого-то “взять”.Это
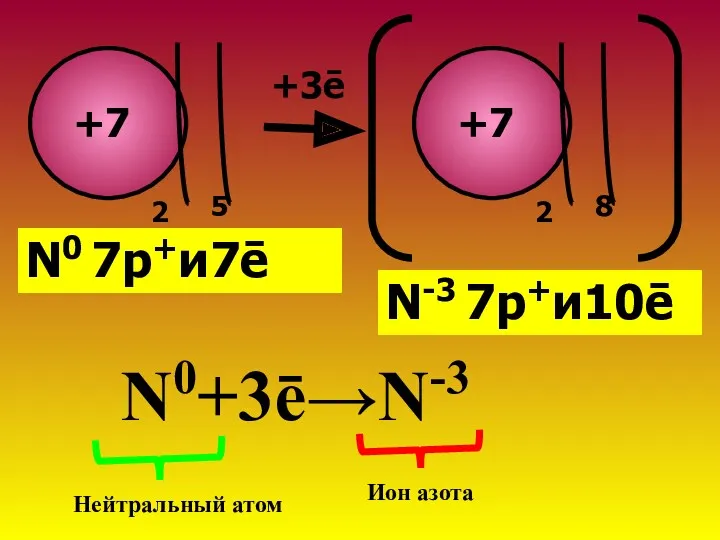
- 7. Атом водорода приобрел ē-оболочку благородного газа Не.У него ē>,чем р+→заряд частицы Рассмотрим образование иона азота: N
- 8. +7 2 5 +7 2 8 +3ē N0 7р+и7ē N-3 7р+и10ē N0+3ē→N-3 Нейтральный атом Ион азота
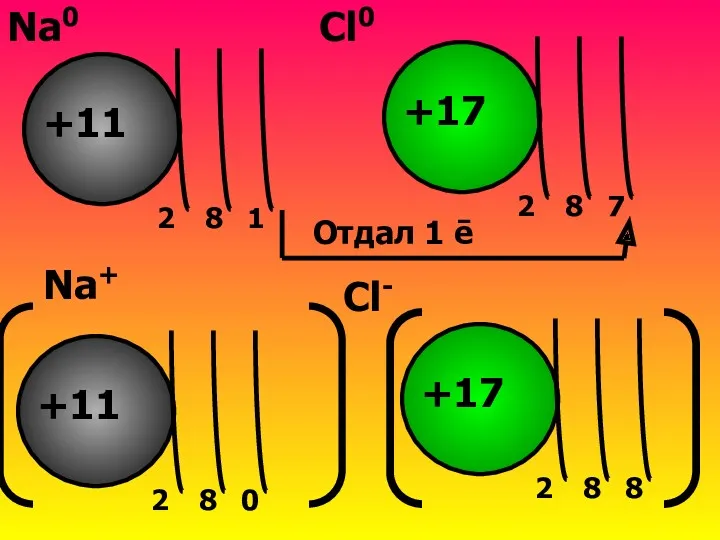
- 9. Встречаются атомы Na и Cl Na Є III периоду→3ē-слоя Na Є 1 группе→1ē на внешнем слое→легче
- 10. 8 2 1 +11 8 2 7 +17 Отдал 1 ē Na0 Cl0 8 2 0
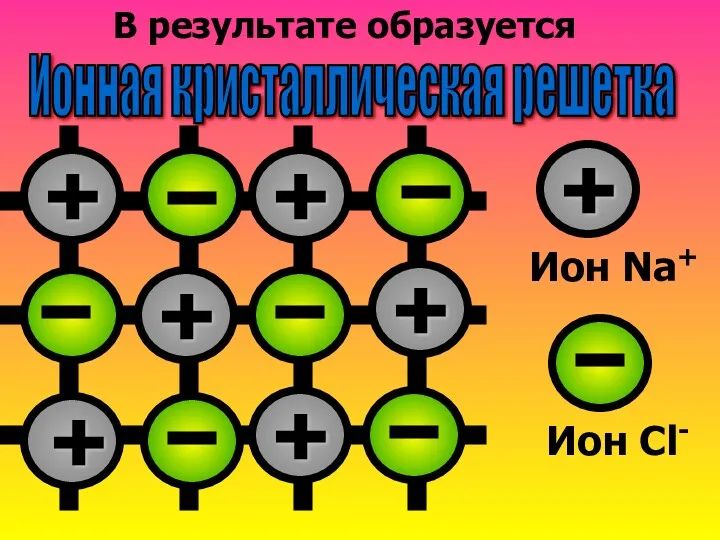
- 11. В результате образуется Ионная кристаллическая решетка + + + + + + + Ион Na+ Ион
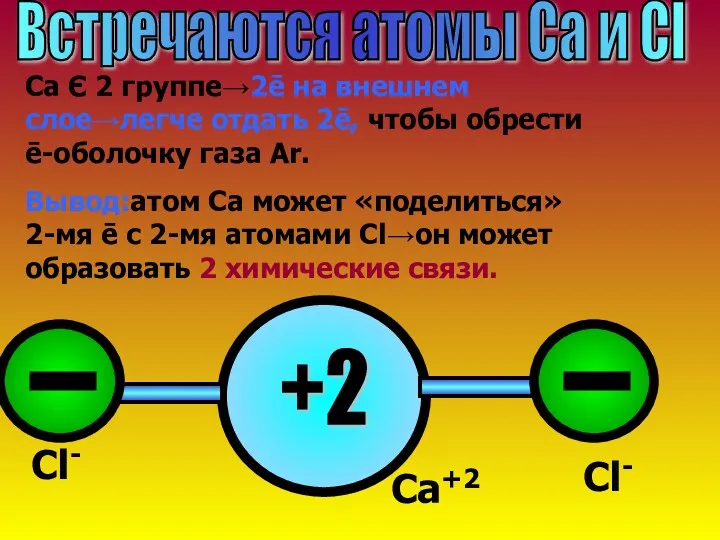
- 12. Встречаются атомы Ca и Cl Ca Є 2 группе→2ē на внешнем слое→легче отдать 2ē, чтобы обрести
- 13. Запомни! Ионная связь образуется по принципу «отдай-возьми ē»→атом может образовать столько химических связей, сколько может отдать
- 14. Запомни! «+» заряженный ион называется катион, а «-»заряженный ион называется анион. Для двух девчат подарков груз
- 15. Ковалентная связь Возникает за счет образования общих электронных пар. Запомни! Такой вид связи возникает между атомами
- 16. Встречаются атомы Cl Cl Є 7 группе→7ē на внешнем слое→ не хватает 1ē, чтобы обрести ē-оболочку
- 17. Запомни! Атом неметалла способен образовывать столько общих ē-пар(→химических связей), сколько у него имеется неспаренных ē-нов.Число неспаренных
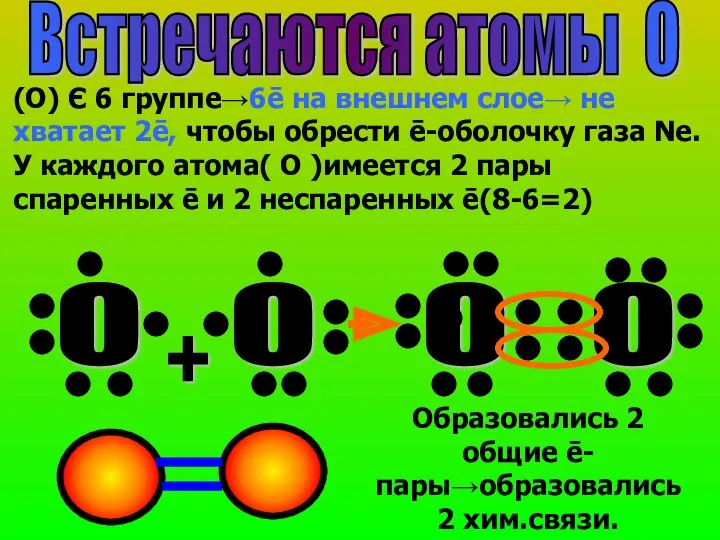
- 18. Встречаются атомы О (О) Є 6 группе→6ē на внешнем слое→ не хватает 2ē, чтобы обрести ē-оболочку
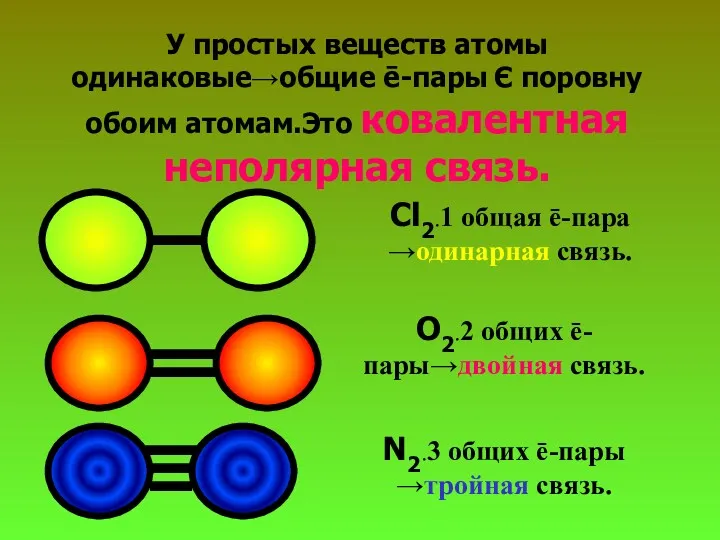
- 19. У простых веществ атомы одинаковые→общие ē-пары Є поровну обоим атомам.Это ковалентная неполярная связь. Cl2.1 общая ē-пара
- 20. У сложных веществ атомы разные→общие ē-пары Є непоровну обоим атомам.Это ковалентная полярная связь. Запомни! Для того,
- 21. электроотрицательность Это способность атомов притягивать к себе общие ē-пары.Полинг разработал шкалу ЭО для неметаллов. H, As,
- 22. Встречаются атомы Н и Сl ЭО (Сl)>ЭО(Н) →общая ē-пара будет смещена к атому (Сl)→на атоме (Сl)
- 23. Встречаются атомы Н и О (О) Є 6 группе→6ē на внешнем слое→ не хватает 2ē, чтобы
- 24. Запомни! Для удобства расчетов как в случае ионной, так и в случае ковалентной полярной связи принято
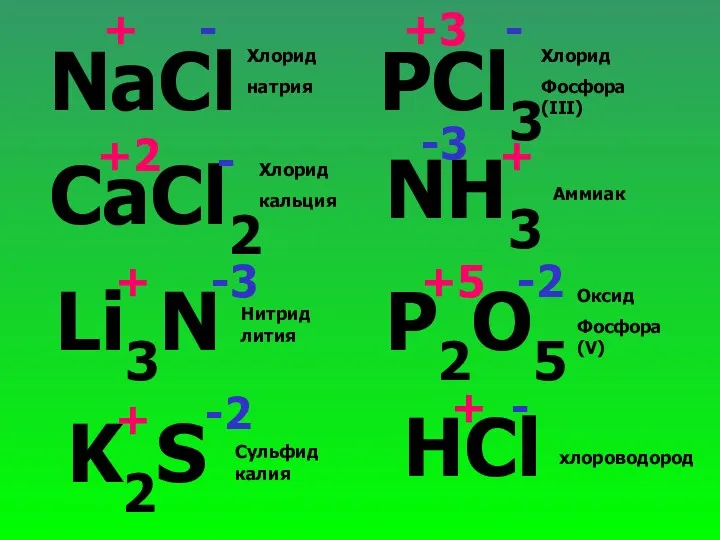
- 25. NaCl CaCl2 Li3N K2S PCl3 NH3 P2O5 HCl + + +2 + + + +3 +5
- 26. Кристаллические решетки веществ с ковалентной связью решетки атомные молекулярные У веществ с атомной решеткой в узлах
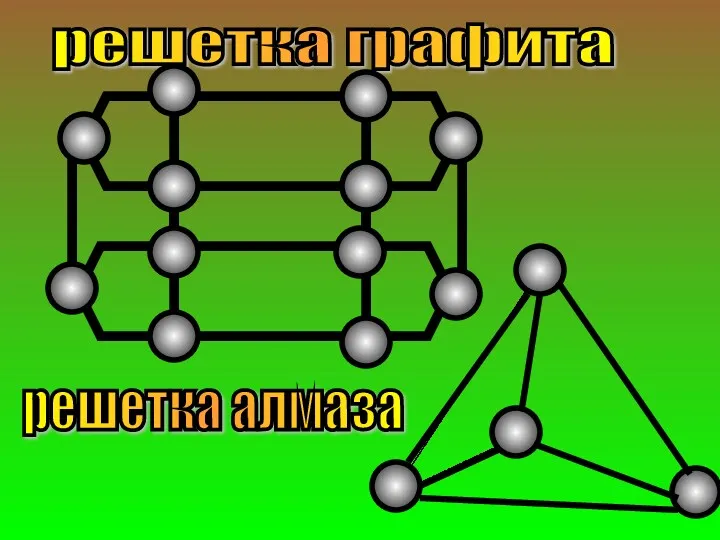
- 27. решетка графита решетка алмаза
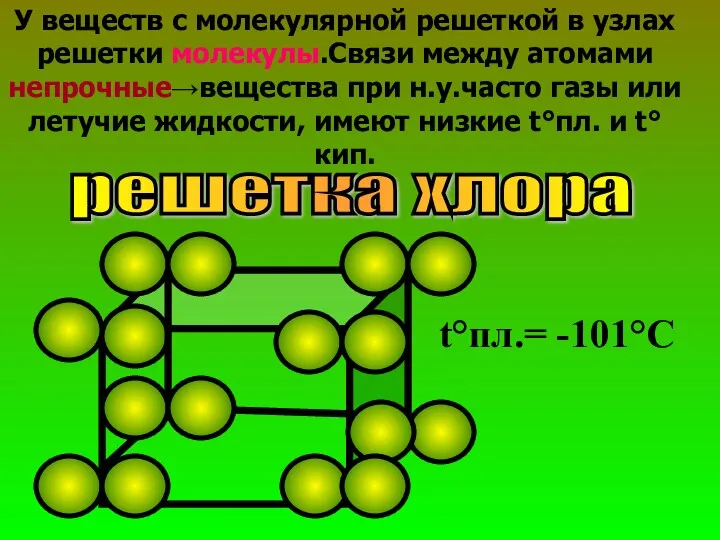
- 28. У веществ с молекулярной решеткой в узлах решетки молекулы.Связи между атомами непрочные→вещества при н.у.часто газы или
- 30. Скачать презентацию














 Хімія та їжа
Хімія та їжа Химия и сельское хозяйство
Химия и сельское хозяйство Пиролиз углеводородов
Пиролиз углеводородов Алкалоиды
Алкалоиды Химический диктант Алканы. Алкены
Химический диктант Алканы. Алкены Галогены
Галогены ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Водород
Водород Углерод. Элемент IV группы
Углерод. Элемент IV группы Подгруппа Азота
Подгруппа Азота Золото. История открытия
Золото. История открытия Мило. Мийні засоби
Мило. Мийні засоби Білки як високомолекулярні сполуки
Білки як високомолекулярні сполуки Минералы и Близнецы
Минералы и Близнецы Спирты
Спирты Основные свойства адсорбентов. Определение их параметров
Основные свойства адсорбентов. Определение их параметров Соли. 8 класс
Соли. 8 класс Геохимические классификации элементов
Геохимические классификации элементов Металловедение. Классификация металлов
Металловедение. Классификация металлов Молекулярно-кинетические свойства дисперсных систем
Молекулярно-кинетические свойства дисперсных систем Визначення іонів лужних і лужноземельних іонів у природних водах
Визначення іонів лужних і лужноземельних іонів у природних водах Литий. Физические и химические свойства. Получение и применение
Литий. Физические и химические свойства. Получение и применение Фотохимический смог и химизм его образования
Фотохимический смог и химизм его образования Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы
Көмірсутектер.Олардың жіктелуі, құрылысы,изомериясы және номенклатурасы Кислоты. Классификация кислот
Кислоты. Классификация кислот Химический элемент железо
Химический элемент железо Металлы. Общие свойства металлов
Металлы. Общие свойства металлов