ХИМИЧЕСКИЕ СВОЙСТВА
1.Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует
с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
2.При сильном нагревании (3000оС-5000оС или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом.
3.Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.










 Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Химическая коррозия. Методы защиты от химической коррозии
Химическая коррозия. Методы защиты от химической коррозии Дикарбоновые , гидроксикислоты
Дикарбоновые , гидроксикислоты Рафинирование металлических расплавов
Рафинирование металлических расплавов Бытовая химия
Бытовая химия Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Углеводы. Моносахариды
Углеводы. Моносахариды Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар Химические основы жизни
Химические основы жизни Значення хімічних процесів у природі
Значення хімічних процесів у природі Химические свойства металлов
Химические свойства металлов Полимеры и ЕГЭ
Полимеры и ЕГЭ Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов Кривые титрования: построение и анализ (лекция 6)
Кривые титрования: построение и анализ (лекция 6) Создание косметических средств
Создание косметических средств Окисно-відновні реакції. Гальванічні елементи
Окисно-відновні реакції. Гальванічні елементи Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Железо и его соединения
Железо и его соединения Непредельные углеводороды. Этиленовые углеводороды (алкены)
Непредельные углеводороды. Этиленовые углеводороды (алкены) Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода
Классификация и общая характеристика механизмов образования свободных радикалов и активных форм кислорода Алюминий и его соединения
Алюминий и его соединения Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Амины
Амины Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2 Непредельные углеводороды: этилен
Непредельные углеводороды: этилен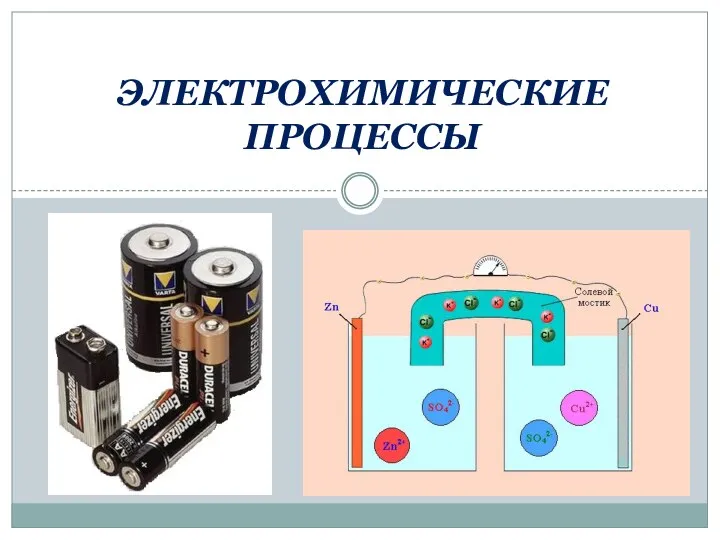 Электрохимические процессы
Электрохимические процессы Фибоначчи. Закономерности химических элементов ряда
Фибоначчи. Закономерности химических элементов ряда