Содержание
- 2. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ реакції, які відбуваються зі зміною ступенів окиснення елементів Fe2O3 + 3С = 2Fe +
- 3. ПРАВИЛА ВИЗНАЧЕННЯ СТУПЕНЯ ОКИСНЕННЯ Металічні елементи мають у сполуках лише позитивні ступені окиснення Гідроген у сполуках
- 4. Максимальний (позитивний) ступінь окиснення елемента збігається з номером групи, у якій він розміщений (виняток— О, F,
- 5. Процес окиснення – процес віддачі електронів атомами, молекулами або йонами
- 6. ПРОЦЕСИ ОКИСНЕННЯ СТУПІНЬ ОКИСНЕННЯ ЗБІЛЬШУЄТЬСЯ Ba ⁰ - 2e → Ba⁺² S ‾ ² - 2e
- 7. Процес відновлення – процес приєднання електронів атомами, молекулами або йонами
- 8. ПРОЦЕСИ ВІДНОВЛЕННЯ СТУПІНЬ ОКИСНЕННЯ ЗМЕНШУЄТЬСЯ P⁰ + 3e → P ‾³ Na⁺ + 1e → Na⁰
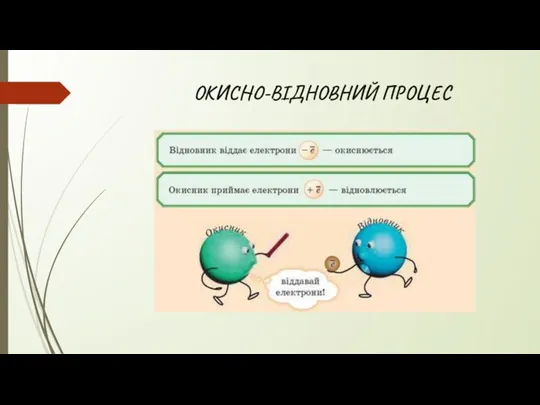
- 9. ОКИСНО-ВІДНОВНИЙ ПРОЦЕС
- 11. ТИПИ ОВР ОВР самоокиснення - самовідновлення
- 12. ОСНОВНІ ВІДНОВНИКИ Прості речовини неметали: S, Si, C, P, H2 Прості речовини метали та їх йони,
- 13. ОСНОВНІ ОКИСНИКИ Атоми неметалічних елементів. Найлегше приєднують електрони або утворюють спільні електронні пари елементи сьомої групи
- 14. 1 4 3 2 5
- 15. 6 8 9 7 10
- 16. 11 12 13
- 17. ГАЛЬВАНІЧНИЙ ЕЛЕМЕНТ хімічне джерело живлення, в якому використовується різниця електродних потенціалів двох металів, занурених у електроліт
- 18. Луіджі Гальвані. Засновник електрофізіології 1800 року Алессандро Вольта вперше презентував пристрій, що перетворює хімічну енергію безпосередньо
- 19. ВОЛЬТІВ СТОВП Це був немов товстий «бутерброд» iз металічних пластин (міді і цинку) i тканини, яка
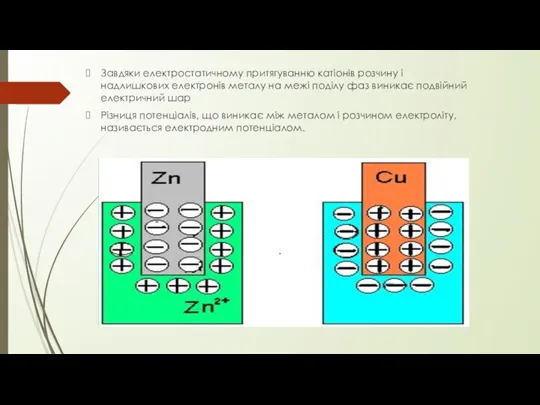
- 20. БУДОВА ПОДВІЙНОГО ЕЛЕКТРИЧНОГО ШАРУ Електронний шар сформований за рахунок переходу атомів металу в розчин у вигляді
- 21. Завдяки електростатичному притягуванню катіонів розчину і надлишкових електронів металу на межі поділу фаз виникає подвійний електричний
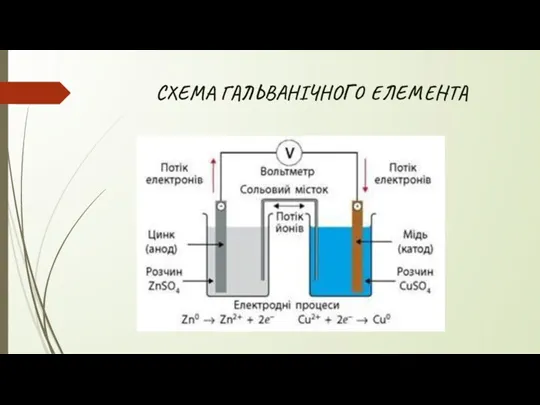
- 22. СХЕМА ГАЛЬВАНІЧНОГО ЕЛЕМЕНТА
- 23. ЕЛЕМЕНТ ЯКОБІ ДАНІЕЛЯ Цинк більш активний відновник і легше віддає електрони, ніж мідь. Відбувається спрямований рух
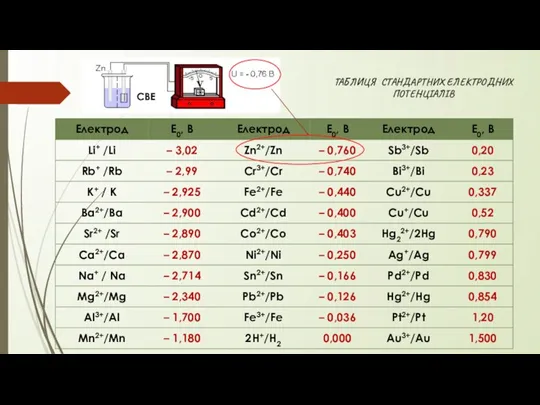
- 24. СВЕ СВЕ ТАБЛИЦЯ СТАНДАРТНИХ ЕЛЕКТРОДНИХ ПОТЕНЦІАЛІВ
- 25. ВИСНОВКИ Чим більший негативний електродний потенціал металу, тим більша його відновна здатність. Кожен метал здатний відновлювати
- 26. Овочі та фрукти мають свій сік, який можна використовувати як електроліт. Якщо встромити, наприклад, у яблуко
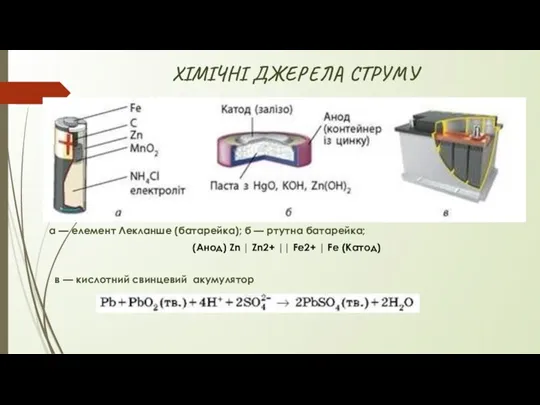
- 27. ХІМІЧНІ ДЖЕРЕЛА СТРУМУ а — елемент Лекланше (батарейка); б — ртутна батарейка; в — кислотний свинцевий
- 28. 1 2
- 29. 3 4
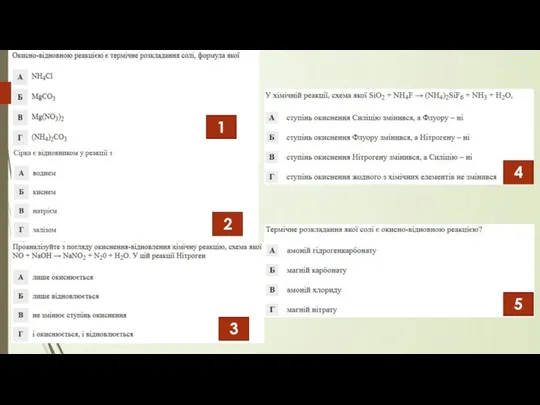
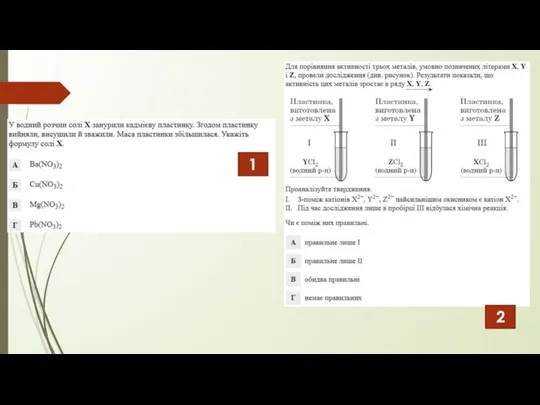
- 31. ТЕСТИ 1. Катодом у гальванічному елементі з нікелевим анодом може бути… А алюміній Б калій В
- 32. 4. Який метал утворить гальванічний елемент з максимальною ЕРС у парі з міддю: Bi Zn Pb
- 34. Скачать презентацию
























 Тепловой эффект химической реакции. Топливо. Водород. 8 класс
Тепловой эффект химической реакции. Топливо. Водород. 8 класс Бериллий, магний и щелочноземельные металлы. Главная подгруппа II группы
Бериллий, магний и щелочноземельные металлы. Главная подгруппа II группы Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Алканы
Алканы Основные классы неорганических соединений
Основные классы неорганических соединений Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Обмен липидов
Обмен липидов Степень окисления
Степень окисления Генетическая связь между классами веществ
Генетическая связь между классами веществ Химическая связь
Химическая связь Процессы и аппараты химических производств
Процессы и аппараты химических производств Электронные конфигурации атомов
Электронные конфигурации атомов Алканы. Получение, свойства и применение
Алканы. Получение, свойства и применение Хімічні формули речовин. Урок №14
Хімічні формули речовин. Урок №14 Петрография магматических пород
Петрография магматических пород Лекция 2 Периодический закон
Лекция 2 Периодический закон Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Кто хочет стать химиком
Кто хочет стать химиком Степень окисления ОВР
Степень окисления ОВР Особенности строения твердых тел
Особенности строения твердых тел Силіцій
Силіцій Химическая стойкость тугоплавких металлов в различных реагентах
Химическая стойкость тугоплавких металлов в различных реагентах Введение в органическую химию
Введение в органическую химию Синтетичні високомолекулярні речовини. Полімери. Реакції полімеризації і поліконденсації
Синтетичні високомолекулярні речовини. Полімери. Реакції полімеризації і поліконденсації Геохимия
Геохимия