Содержание
- 2. Тепловой эффект Экзотермические реакции – реакции проходящие с выделением тепла. С + О2 = СО2 +
- 3. Тепловой эффект Под действием постоянного тока, протекает реакция: 2H2O (ж) = 2H2(г) + O2(г) – 484
- 4. Тепловой эффект Под действием постоянного тока, протекает реакция: 2H2O (ж) = 2H2(г) + O2(г) – 484
- 5. Тепловой эффект Решим задачу: При взаимодействии 7г железа с серой выделилось 12.15 кДж. На основании этих
- 6. Топливо Человечество использует множество разных типов топлива. По агрегатному состоянии: твёрдое, жидкое, газообразное.
- 7. Топливо Человечество использует множество разных типов топлива. По агрегатному состоянии: твёрдое, жидкое, газообразное. Твёрдое топливо: антрацит,
- 8. Топливо Твёрдое топливо. Теплотворная способность – качество топлива, количество энергии, которое можно получить из 1 кг
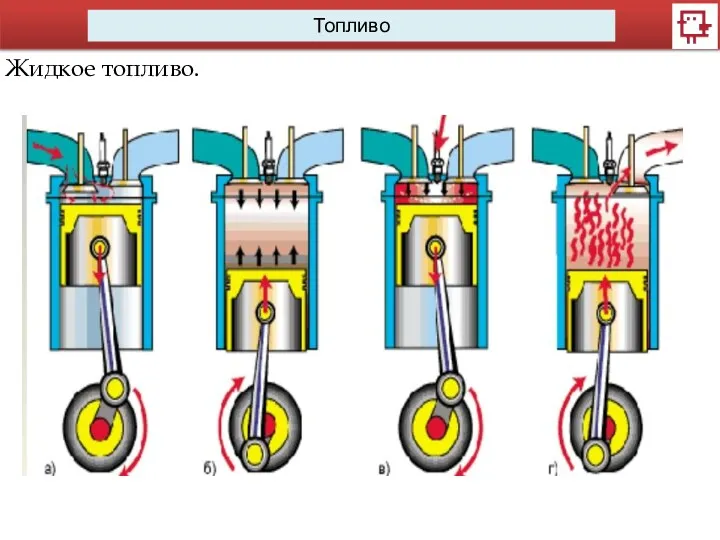
- 9. Топливо Жидкое топливо.
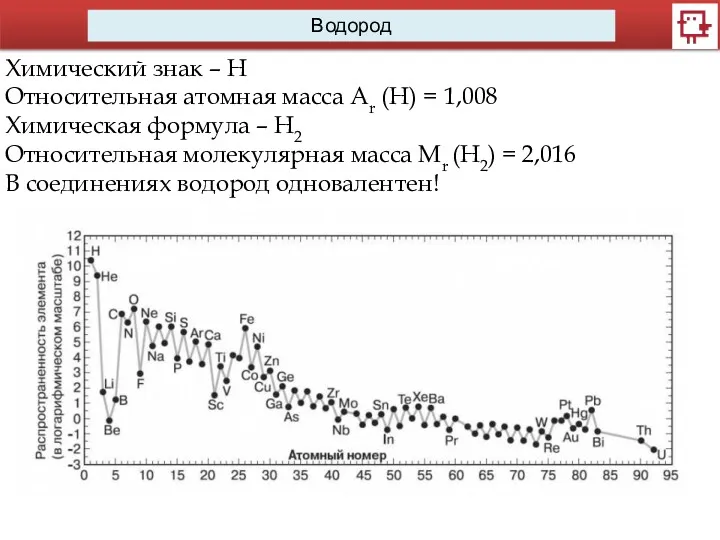
- 10. Водород Химический знак – Н Относительная атомная масса Аr (Н) = 1,008 Химическая формула – Н2
- 11. Водород Получение водорода: 2H2O (ж) = 2H2(г) + O2(г) – 484 кДж В лабораторных условиях водород
- 12. Водород. Физические свойства Водород – бесцветный самый легкий газ. Растворимость водорода в воде крайне мала. Температура
- 14. Скачать презентацию









 Химические источники тока. Электролиз
Химические источники тока. Электролиз Вуглеводи
Вуглеводи Термодинамика биологических процессов
Термодинамика биологических процессов Спирти
Спирти Классификация минералов
Классификация минералов Полипропилен
Полипропилен Tungsten. (Вольфрам)
Tungsten. (Вольфрам)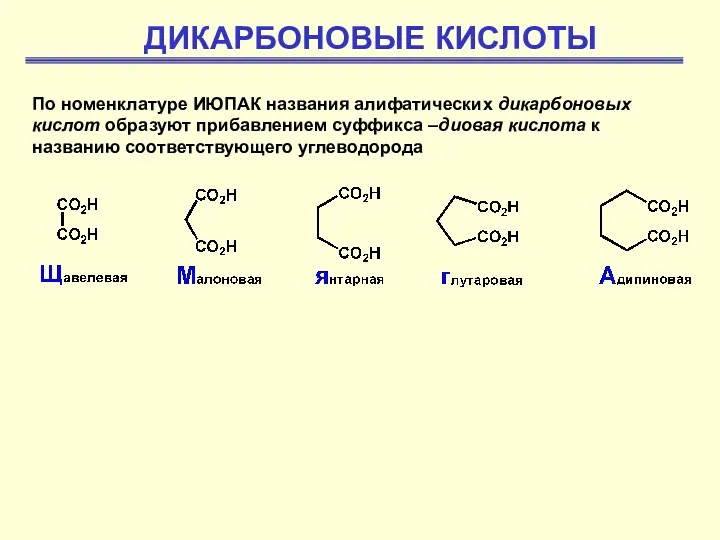 Дикарбоновые кислоты
Дикарбоновые кислоты Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Углерод, аллотропные модификации
Углерод, аллотропные модификации Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Фотохимический смог и химизм его образования
Фотохимический смог и химизм его образования Философы химии Кант и Гегель
Философы химии Кант и Гегель Строение атома. Лекция № 2
Строение атома. Лекция № 2 Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Спирты (алканолы)
Спирты (алканолы) Основные синтетические полимеры
Основные синтетические полимеры Изохинолин туындыларының дәрілік заттарын талдау
Изохинолин туындыларының дәрілік заттарын талдау Реакции ионного обмена
Реакции ионного обмена Химическая посуда и ее назначения (5)
Химическая посуда и ее назначения (5) Магматические горные породы
Магматические горные породы Соли
Соли Щелочные металлы
Щелочные металлы Химическая связь и ее типы. Основные классы неорганических соединений
Химическая связь и ее типы. Основные классы неорганических соединений Научно – исследовательская работа Газированная вода - вред или польза?
Научно – исследовательская работа Газированная вода - вред или польза? Серная кислота и её свойства
Серная кислота и её свойства Качественные реакции на органические вещества
Качественные реакции на органические вещества Валентність хімічних елементів
Валентність хімічних елементів