Слайд 2
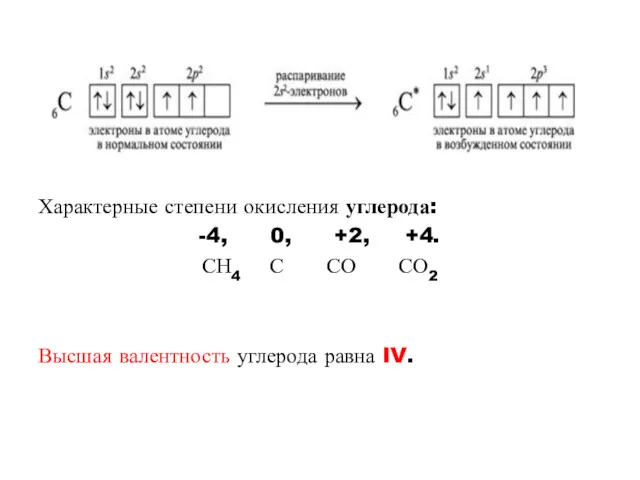
Характерные степени окисления углерода:
-4, 0, +2, +4.
СН4 С СО СО2
Высшая валентность углерода равна IV.
Слайд 3

Нахождение в природе.
Углерод в природе встречается:
в виде простых веществ – графита
и алмаза
в составе минералов – карбонатов кальция, магния, железа и др.
В воздухе – СО2 (углекислый газ).
Слайд 4

Аллотропные модификации углерода
1) Графит
Графит – темно-серое тугоплавкое вещество с металлическим блеском и
низкой твердостью, проводит электрический ток.
Слайд 5
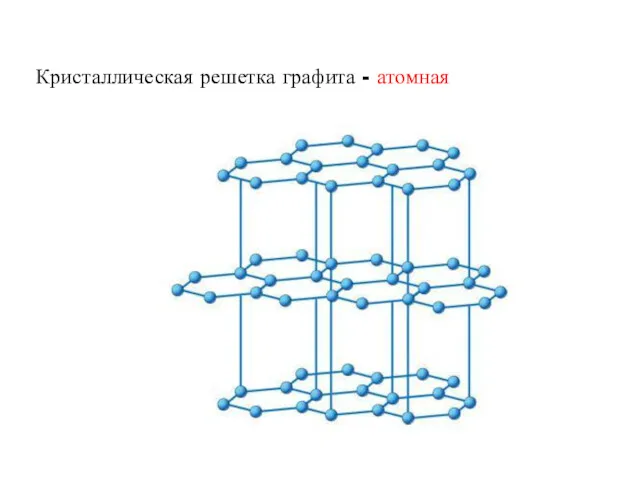
Кристаллическая решетка графита - атомная
Слайд 6

2) Алмаз
Алмаз – бесцветное тугоплавкое вещество, с самой высокой твердостью из всех
природных веществ.
Слайд 7
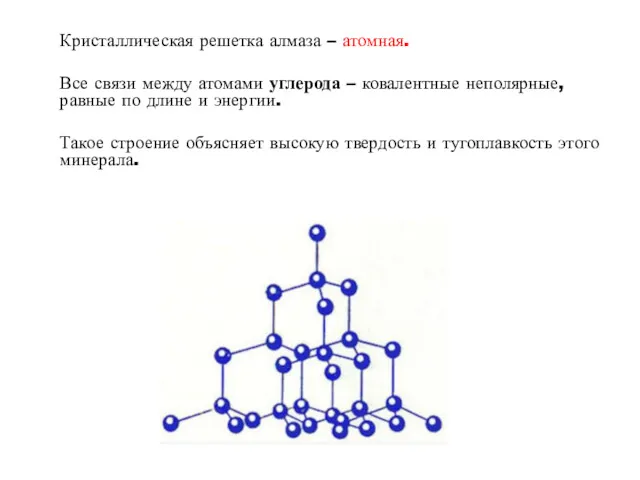
Кристаллическая решетка алмаза – атомная.
Все связи между атомами углерода – ковалентные неполярные,
равные по длине и энергии.
Такое строение объясняет высокую твердость и тугоплавкость этого минерала.
Слайд 8
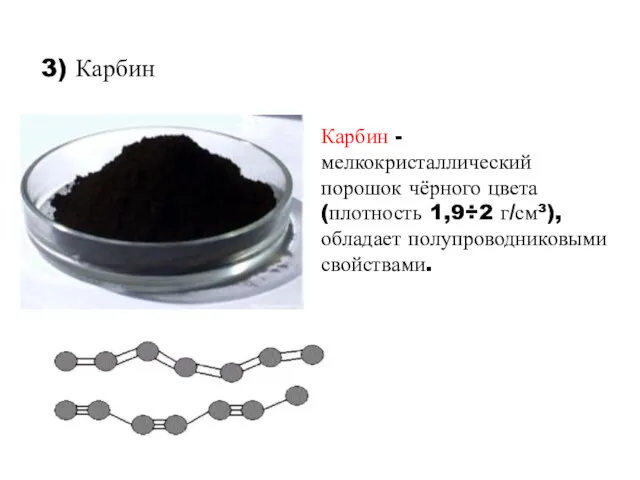
3) Карбин
Карбин - мелкокристаллический порошок чёрного цвета (плотность 1,9÷2 г/см³), обладает полупроводниковыми
свойствами.







 Смеси, растворы. Тест
Смеси, растворы. Тест Карбонові кислоти
Карбонові кислоти Гель-хроматография. Бумажная хроматография
Гель-хроматография. Бумажная хроматография Лекция 5. Коллигативные свойства растворов
Лекция 5. Коллигативные свойства растворов Химические свойства карбокатионов
Химические свойства карбокатионов Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Основные понятия и законы химии
Основные понятия и законы химии Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Периодическая система элементов Д. И. Менделеева. IA группа
Периодическая система элементов Д. И. Менделеева. IA группа Классы неорганических соединений
Классы неорганических соединений Материаловедение и методы диагностики микро- и наноструктурных материалов
Материаловедение и методы диагностики микро- и наноструктурных материалов Основные понятия и законы химии. Тема1
Основные понятия и законы химии. Тема1 Макро- и микроэлементы
Макро- и микроэлементы Химическая связь. 8 класс
Химическая связь. 8 класс Электрохимическая коррозия
Электрохимическая коррозия Галогени. Знаходження в природі
Галогени. Знаходження в природі Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Алкены. Номенклатура. Строение молекулы
Алкены. Номенклатура. Строение молекулы Типы расчетных задач, способы их решения. Задания 39-40
Типы расчетных задач, способы их решения. Задания 39-40 Алотропні модифікації фосфору
Алотропні модифікації фосфору Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Электролиз: опыты к заданиям ЕГЭ
Электролиз: опыты к заданиям ЕГЭ Механические свойства минералов
Механические свойства минералов Массовая доля элемента в веществе
Массовая доля элемента в веществе Качественные реакции
Качественные реакции Строение вещества. Строение атома и периодическая система элементов
Строение вещества. Строение атома и периодическая система элементов Оксиды и их свойства
Оксиды и их свойства Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие