Содержание
- 2. План Введение. Основные термины. Понятие о скорости гомогенных и гетерогенных реакций. Факторы, влияющие на скорость химических
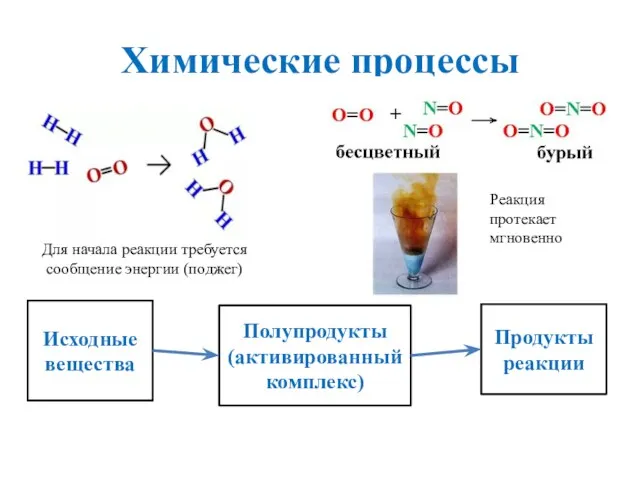
- 3. Химические процессы Исходные вещества Полупродукты (активированный комплекс) Продукты реакции Реакция протекает мгновенно Для начала реакции требуется
- 4. Основные термины Кинетика («kinẽtikos”= “движущийся”) – раздел физической химии, изучающий механизм и скорость протекания реакций Механизм
- 5. Основные термины Скорость химической реакции (W) – изменение концентрации (∆C) исходных реагентов или продуктов за единицу
- 6. Химические процессы Гомогенные процессы, протекающие в одной фазе (газ, раствор, расплав) Гетерогенные есть граница раздела фаз
- 7. Скорость химической реакции в гомогенных системах гетерогенных системах где S – площадь поверхности фазы; Δn –
- 8. Факторы, влияющие на скорость реакции: концентрация реагентов, температура, давление, агрегатное состояние реагентов, наличие специфических добавок (катализаторов,
- 9. выражается законом действующих масс (ЗДМ) Влияние концентрации на скорость химической реакции В 1864 – 1867 годах
- 10. Закон действующих масс Для реакции вида аА + bB = cC + dD закон действующих масс
- 11. Закон действующих масс Важно! Концентрация конденсированной фазы не включается в выражение ЗДМ, т.к. она является постоянной
- 12. ЗАВИСИМОСТЬ СКОРОСТИ ОТ ТЕМПЕРАТУРЫ ПРАВИЛО ВАНТ-ГОФФА где γ – температурный коэффициент, принимающий значения от 2 до
- 13. Энергия активации – избыточное количество энергии, которой должна обладать молекула в момент столкновения, чтобы быть способной
- 14. УРАВНЕНИЕ АРРЕНИУСА А – частотный фактор (связывает частоту столкновений частиц с вероятностью того, что столкновения будут
- 15. Влияние давления Бенуа́ Поль Эми́ль Клапейро́н (1799 —1864) французский физик Менделеев Дмитрий Иванович (1834—1907)
- 16. Влияние степени дисперсности Чем выше степень дисперсности вещества, тем больше площадь его поверхности, тем выше скорость
- 17. Влияние специфических добавок Катализатор (Kat) – вещество, которое ускоряет химический процесс, участвуя в нем на этапе
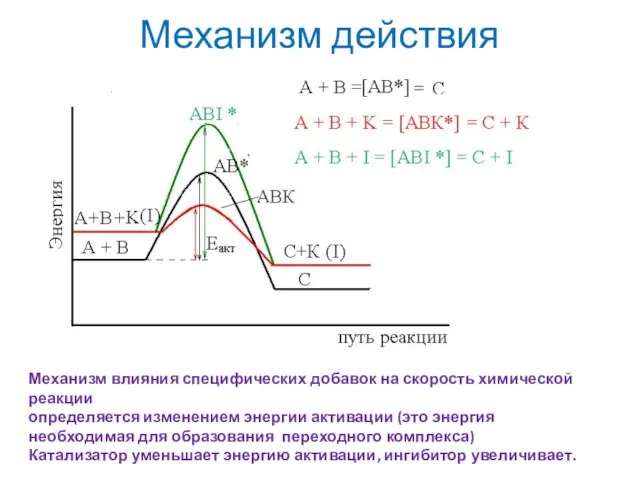
- 18. Механизм действия Механизм влияния специфических добавок на скорость химической реакции определяется изменением энергии активации (это энергия
- 19. Типы катализаторов
- 20. Гетерогенный катализ активные центры (группы атомов, метастабильные участки, дефекты, аморфные образования) специфичность катализатор составляет самостоятельную фазу
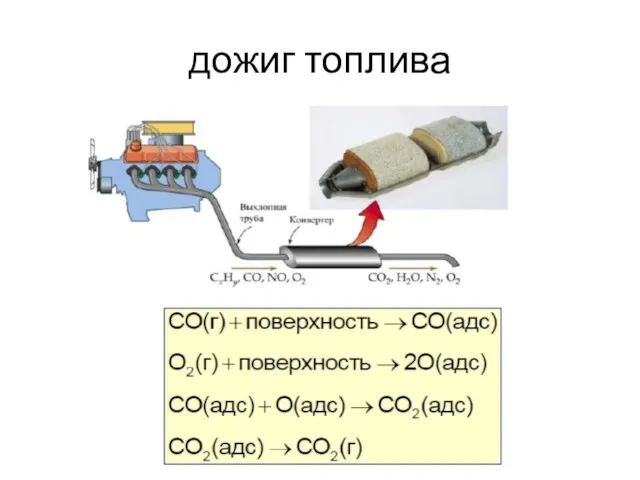
- 21. дожиг топлива
- 22. Влияние специфических добавок Вещества, не являющиеся катализаторами, но увеличивающие каталитическую активность называются промоторами Вещества, не являющиеся
- 23. Равновесие
- 24. Химическое равновесие υ пр = υ обр Химическое равновесие – такое состояние системы, при котором скорость
- 25. Константа равновесия , где в [] приведены концентрации веществ
- 26. Принцип сдвига химического равновесия Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие из
- 27. Факторы, влияющие на равновесие 2СО(г) + О2(г) 2 СО2(г) , ΔH N2O4(г) 2 NО2(г) , ΔH
- 28. Факторы, влияющие на равновесие 1 Увеличение давления, смещает химическое равновесие в сторону меньшего числа молей газообразных
- 30. Скачать презентацию




















![Константа равновесия , где в [] приведены концентрации веществ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/425722/slide-24.jpg)



 Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Алюминий, его амфотерные свойства
Алюминий, его амфотерные свойства Крахмал. Физические свойства
Крахмал. Физические свойства Оксид углерода II. Угарный газ
Оксид углерода II. Угарный газ Нано-порошки. Способы получения нано-порошков
Нано-порошки. Способы получения нано-порошков Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5) Стратегия химической промышленности
Стратегия химической промышленности Своя игра Знаешь ли ты химические элементы?
Своя игра Знаешь ли ты химические элементы? Олимпиадные задачи муниципального этапа по химии
Олимпиадные задачи муниципального этапа по химии Хімічний зв'язок і будова речовини
Хімічний зв'язок і будова речовини Типы химических реакций
Типы химических реакций Виды химической связи
Виды химической связи Теплота горения
Теплота горения Химические свойства альдегидов
Химические свойства альдегидов Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1
Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1 Признаки химических реакций. (Практическая работа 5,4)
Признаки химических реакций. (Практическая работа 5,4) Галогены. Нахождение в природе
Галогены. Нахождение в природе Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Природные источники углеводородов
Природные источники углеводородов Химия элементов VA группы (пниктогены или пникти́ды)
Химия элементов VA группы (пниктогены или пникти́ды) Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах
Трансформация ионной химической связи в металлическую при восстановлении металлов в комплексных оксидах Бытовая химия
Бытовая химия Химия элементов VIA группы
Химия элементов VIA группы Р-элементы IV группы
Р-элементы IV группы Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Использование информационных технологий при обучении химии
Использование информационных технологий при обучении химии Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7