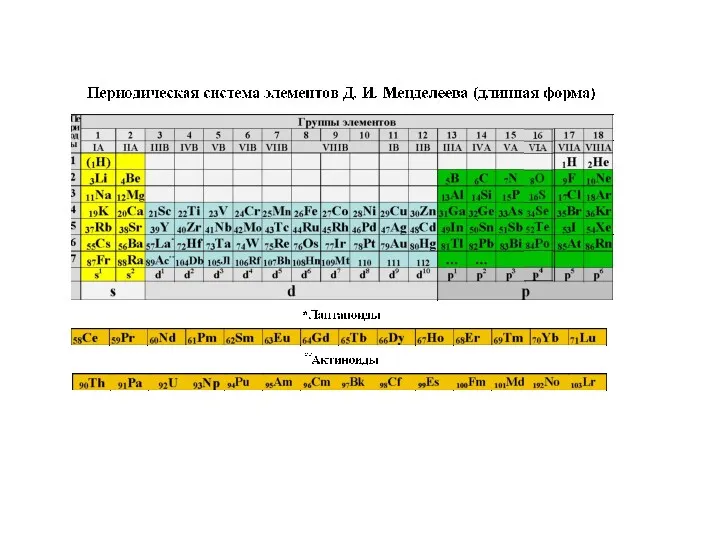
Содержание
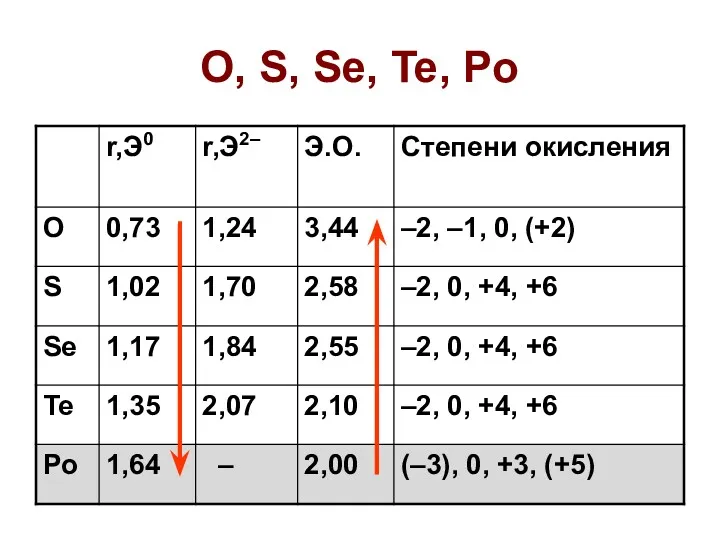
- 3. O, S, Se, Te, Po
- 4. Содержание в земной коре и минералы O – 1 место (49,3 масс.% земной коры; 21% атмосферы)
- 5. Открытие элементов O – 1774 г. англ. Пристли, 1772 г. швед Шееле, 1775 г. француз Лавуазье;
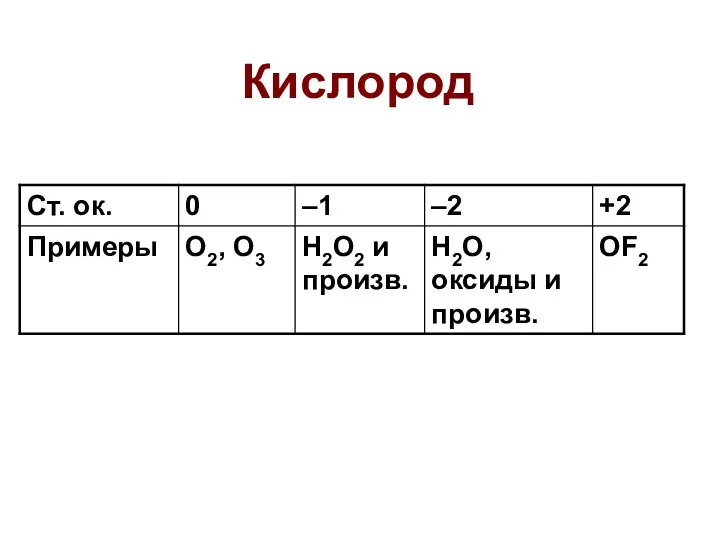
- 6. Кислород
- 7. Аллотропные модификации О O2 – б/ц газ, Ткип = –183 оС, голубая жидкость О3 – озон,
- 8. Получение О2 В природе: воздух, вода, оксидные минералы. ПОЛУЧЕНИЕ: В промышленности: 1) фракционная перегонка жидкого воздуха
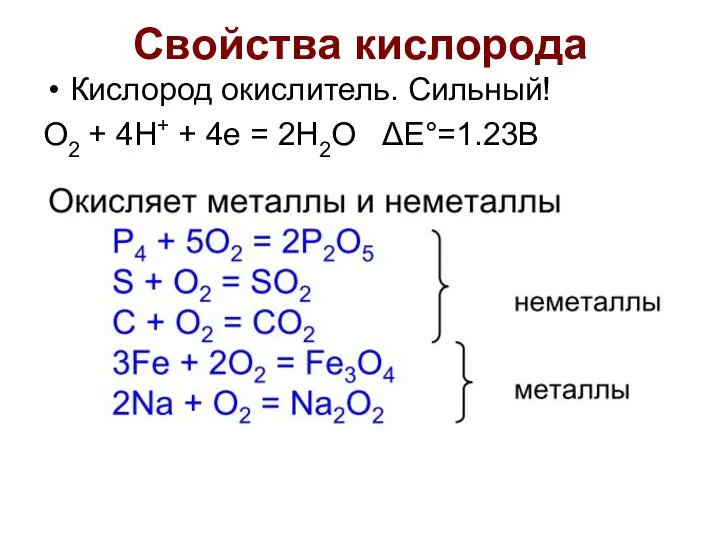
- 9. Свойства кислорода Кислород окислитель. Сильный! O2 + 4H+ + 4e = 2H2O ΔE°=1.23В
- 10. Свойства кислорода Восстановительные свойства (см. получение или химию фтора):
- 11. Вода и ее свойства
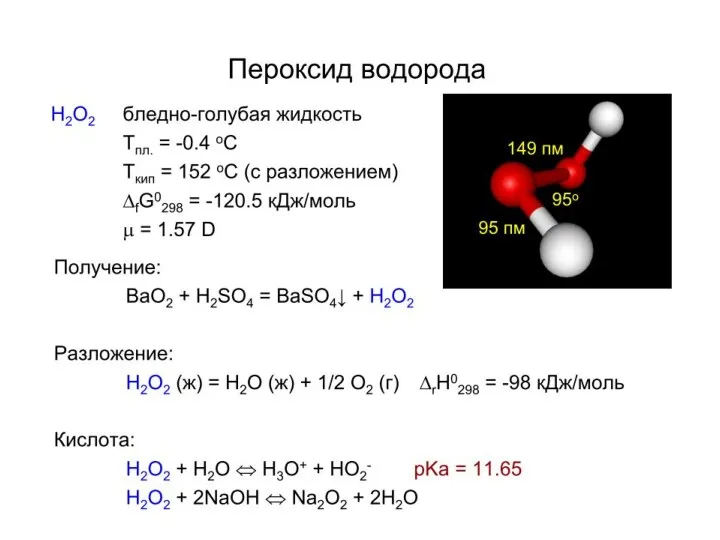
- 13. Пероксиды, надпероксиды, озониды 2Na + O2 = Na2O2 (пероксид) Na + O2 (300 атм) = NaO2
- 14. (реставрация картин)
- 15. ПОДГРУППА СЕРЫ
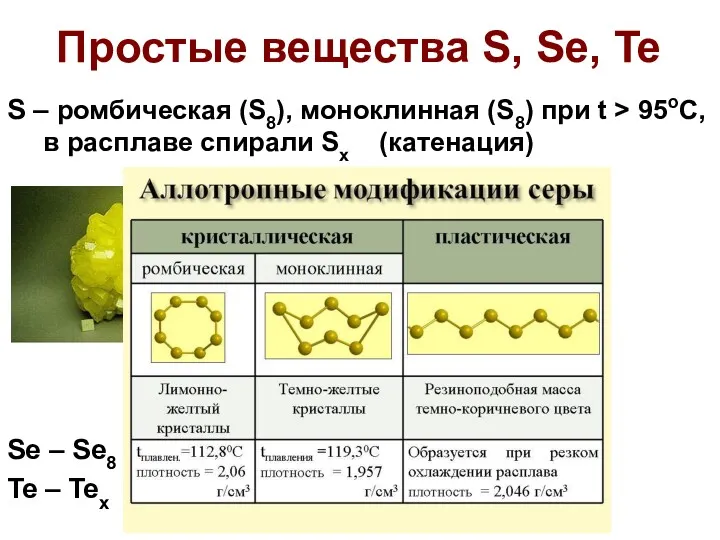
- 16. Простые вещества S, Se, Te S – ромбическая (S8), моноклинная (S8) при t > 95oC, в
- 17. Сера ДОБЫЧА Вручную Из по земли FeS2 → FeS + S t 4FeS2 + 11O2 →
- 18. Серная кислота – кровь химической промышленности
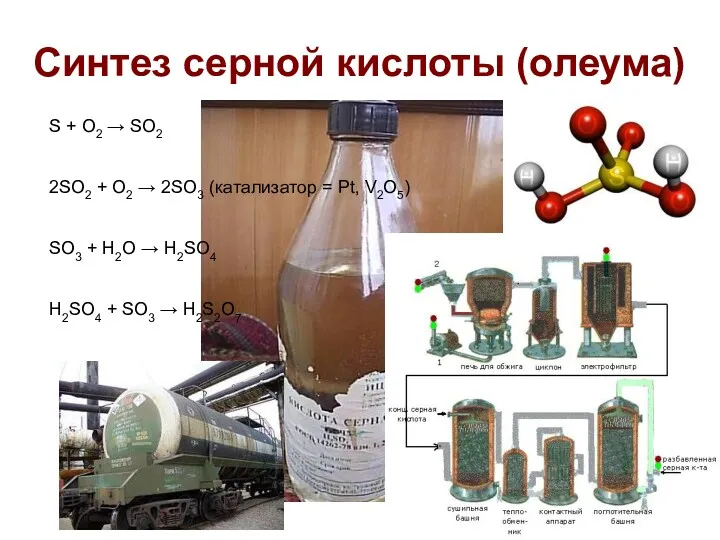
- 19. Синтез серной кислоты (олеума) S + O2 → SO2 2SO2 + O2 → 2SO3 (катализатор =
- 20. Еще о серной кислоте H2SO4 (p-p) 2H+ + SO42– Не реагирует с неметаллами и металлами стоящими
- 21. Свойства S, Se, Te Восстановительные: Э + О2 = ЭО2 (Э = S, Se, Te) Окислительные:
- 22. Реакции с кислотами Кислоты–неокислители: Э + HCl = нет реакции (Э = S, Se, Te) Кислоты–окислители:
- 23. Кислотно-основные свойства Сила кислоты растет Сила кислоты уменьшается
- 24. H2S Сероводород представляет собой бесцветный и весьма ядовитый газ, уже 1 часть которого на 100 000
- 25. Получение: H2 + S = H2S (300 oC) (промышленное) Al2S3 тв + 6H2O = 2Al(OH)3 +
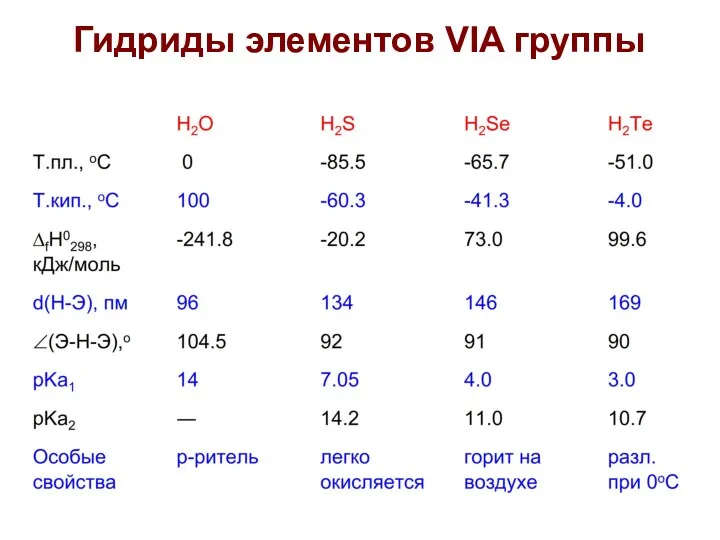
- 26. Гидриды элементов VIA группы
- 28. Скачать презентацию

















 Кислоты. Состав кислот
Кислоты. Состав кислот Реакції йонного обміну. Йонно-молекулярні рівняння
Реакції йонного обміну. Йонно-молекулярні рівняння Амфотерные соединения
Амфотерные соединения Гетероциклические соединения
Гетероциклические соединения Фенолы. Химические свойства и способы получения
Фенолы. Химические свойства и способы получения Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Товары бытовой химии
Товары бытовой химии Кристаллофизика_часть_1
Кристаллофизика_часть_1 Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов
Электронные конфигурации атомов химических элементов. Графическое изображение электронных конфигураций атомов Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Химические соединения в организме человека
Химические соединения в организме человека Способы и степень дробления
Способы и степень дробления Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Химическая термодинамика
Химическая термодинамика Свойства воды. Оценка качества
Свойства воды. Оценка качества Состав и свойства сжиженного газа. Вопрос №1
Состав и свойства сжиженного газа. Вопрос №1 Химический элемент фосфор
Химический элемент фосфор Углерод и его соединения
Углерод и его соединения Характеристика металу Ферум
Характеристика металу Ферум Separation amp confirmation
Separation amp confirmation Оксиды. Физические свойства
Оксиды. Физические свойства Галогены. Нахождение в природе
Галогены. Нахождение в природе Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Алкины. Гомологический ряд, получение, свойства и применение
Алкины. Гомологический ряд, получение, свойства и применение Биоорганическая химия
Биоорганическая химия