Содержание
- 2. Фенолы; Классификация; Химические свойства; Способы получения; Применение; Использованная литература. План:
- 3. ФЕНОЛЫ – класс органических соединений. Содержат одну или несколько группировок С–ОН, при этом атом углерода входит
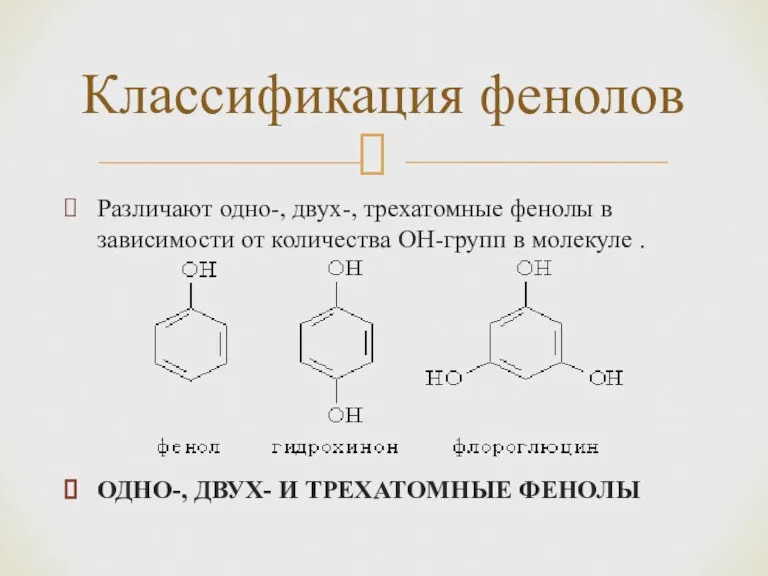
- 4. Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле . ОДНО-, ДВУХ- И
- 5. В фенолах p-орбиталь атома кислорода образует с ароматическим кольцом единую p-систему. Вследствие такого взаимодействия электронная плотность
- 6. 1. Кислотность фенола существенно выше, чем у предельных спиртов; он реагирует как с щелочными металлами: С6Н5ОН
- 7. 2. Образование сложных эфиров. В отличие от спиртов, фенолы не образуют сложных эфиров при действии на
- 8. 3. Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах. Поскольку ОН группа
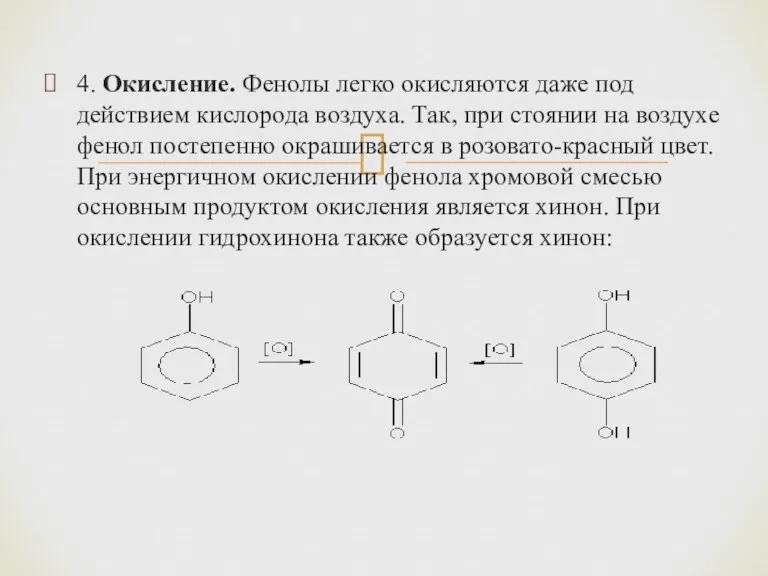
- 9. 4. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол
- 10. 1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при
- 11. 2. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха образуются фенол и ацетон: Это — основной промышленный
- 12. 3. Получение из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот с щелочами. Первоначально образующиеся феноксиды обрабатывают
- 13. Фенол используют как полупродукт при получении фенолформальдегидных смол, синтетических волокон, красителей, лекарственных средств и многих других
- 15. Скачать презентацию










 Коллоидные ПАВ
Коллоидные ПАВ Теории кислот и оснований
Теории кислот и оснований α-Аминокислоты и белки
α-Аминокислоты и белки Реакции ионного обмена
Реакции ионного обмена Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Природные источники углеводородов
Природные источники углеводородов Мембранное материаловедение. Топливные элементы
Мембранное материаловедение. Топливные элементы Атом – сложная частица
Атом – сложная частица Каликсарены
Каликсарены Основания. 8 класс
Основания. 8 класс 20230419_izomery
20230419_izomery Газовая хроматография
Газовая хроматография Кислоты и их свойства
Кислоты и их свойства Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Классы неорганических веществ
Классы неорганических веществ Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Гидролиз солей
Гидролиз солей Високомолекулярні сполуки
Високомолекулярні сполуки Общая характеристика неметаллов
Общая характеристика неметаллов Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Три элемента таблицы Менделеева
Три элемента таблицы Менделеева Роль хімії у житті суспільства
Роль хімії у житті суспільства Подгруппа меди. Элементы 11 группы (Cu,Ag,Au)
Подгруппа меди. Элементы 11 группы (Cu,Ag,Au) Бұл суреттерді не біріктіреді деп ойлайсыздар?
Бұл суреттерді не біріктіреді деп ойлайсыздар? Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Классификация, строение и номенклатура органически. Предмет органической химии
Классификация, строение и номенклатура органически. Предмет органической химии Органикалық заттардың ерекшелігі
Органикалық заттардың ерекшелігі Сложные эфиры. Жиры
Сложные эфиры. Жиры