Содержание
- 2. Медико-биологическое значение темы Из остатков аминокислот построены такие важные соединения как белки, которые участвуют практически во
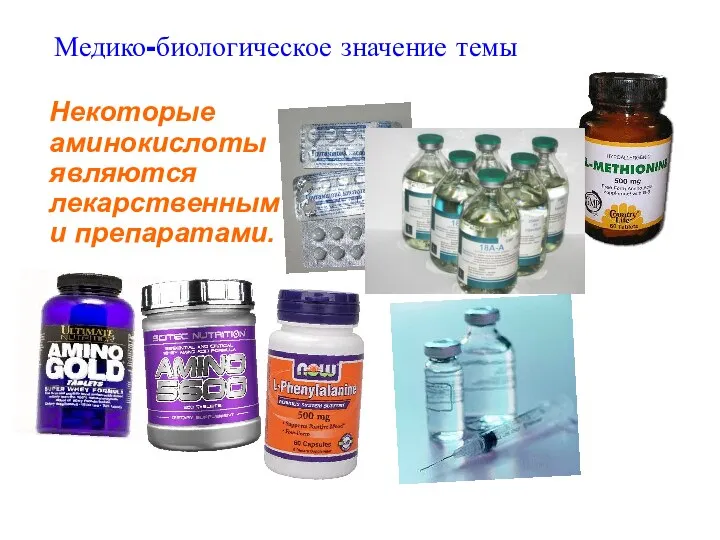
- 3. Некоторые аминокислоты являются лекарственными препаратами. Медико-биологическое значение темы
- 4. Медико-биологическое значение темы
- 5. Пептиды и белки построены из 20 α-аминокислот, информация о положении которых в белковой молекуле записана цифровым
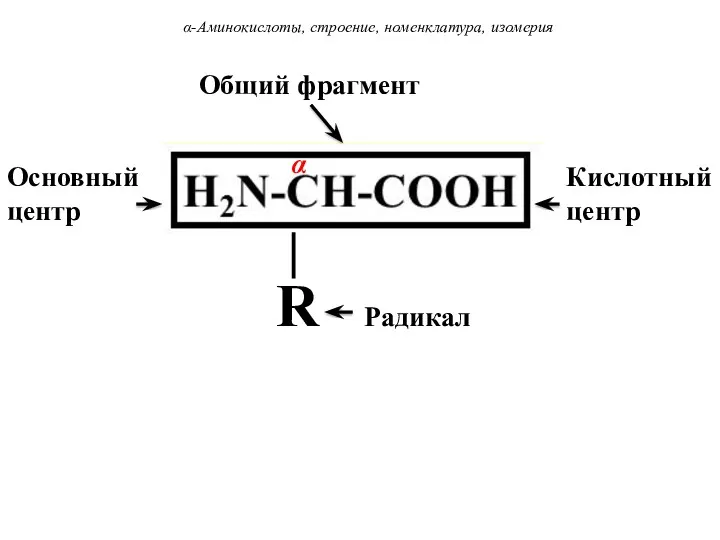
- 6. α-Аминокислоты, строение, номенклатура, изомерия Основный центр Кислотный центр Общий фрагмент ⏐ R Радикал α
- 7. α-Аминокислоты, строение, номенклатура, изомерия I. По строению углеводородного радикала α-аминокислоты делят на 7 групп: I. Моноаминомонокарбоновые
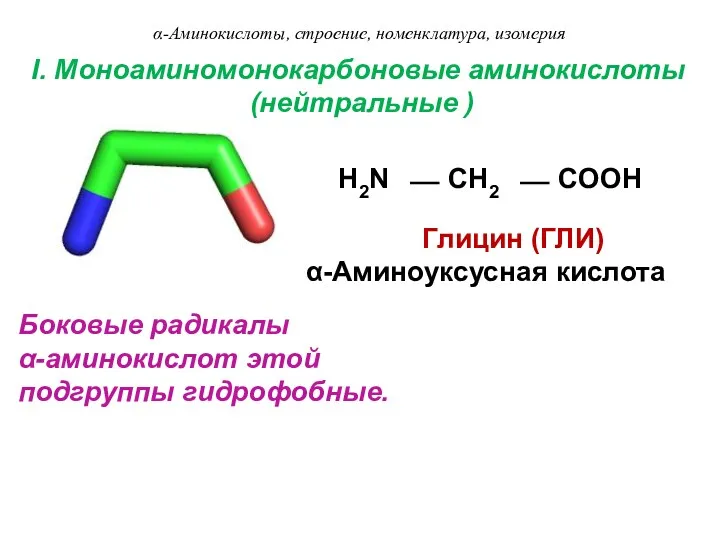
- 8. I. Моноаминомонокарбоновые аминокислоты (нейтральные ) H2N ⎯ CH2 ⎯ COOH Глицин (ГЛИ) α-Аминоуксусная кислота Боковые радикалы
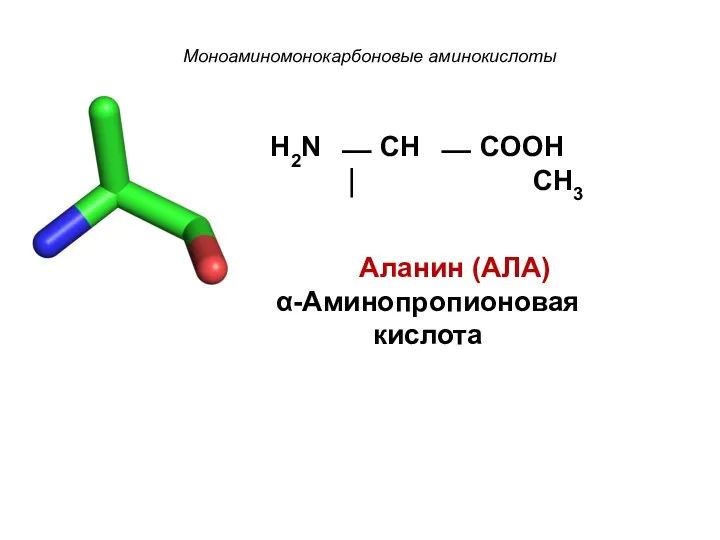
- 9. Моноаминомонокарбоновые аминокислоты H2N ⎯ CH ⎯ COOH ⏐ CH3 Аланин (АЛА) α-Аминопропионовая кислота
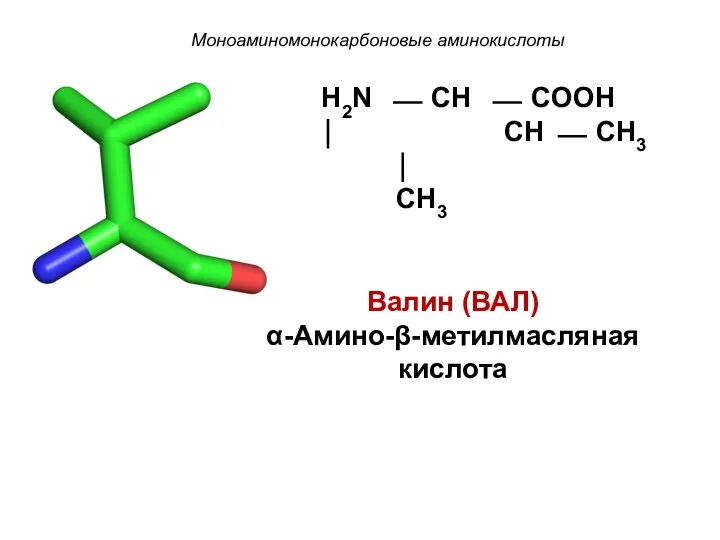
- 10. Моноаминомонокарбоновые аминокислоты H2N ⎯ CH ⎯ COOH ⏐ CH ⎯ CH3 ⏐ CH3 Валин (ВАЛ) α-Амино-β-метилмасляная
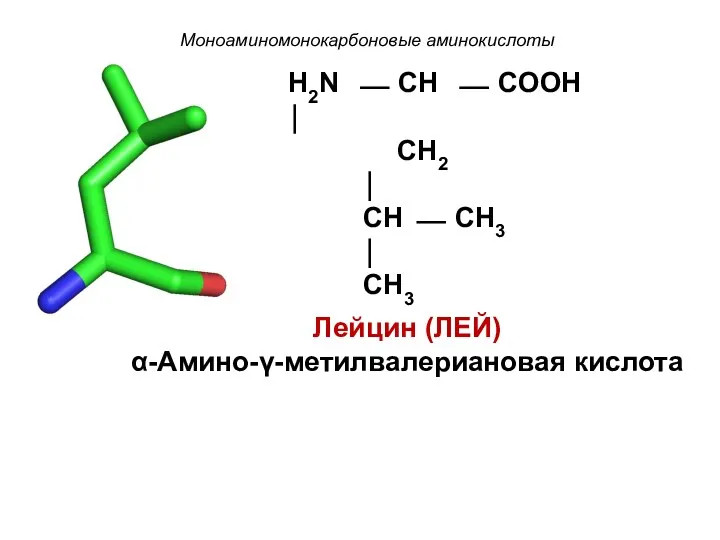
- 11. Моноаминомонокарбоновые аминокислоты H2N ⎯ CH ⎯ COOH ⏐ CH2 ⏐ CH ⎯ CH3 ⏐ CH3 Лейцин
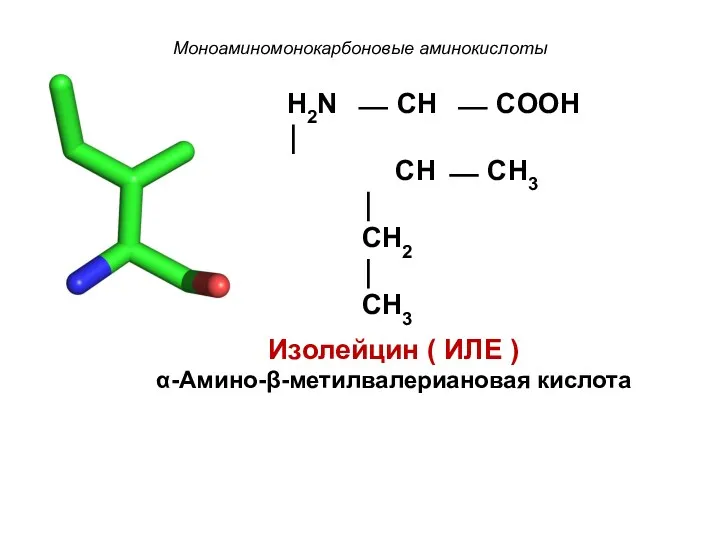
- 12. Моноаминомонокарбоновые аминокислоты H2N ⎯ CH ⎯ COOH ⏐ CH ⎯ CH3 ⏐ CH2 ⏐ CH3 Изолейцин
- 13. II. Моноаминодикарбоновые аминокислоты (кислые) H2N ⎯ CH ⎯ COOH ⏐ CH2 ⏐ COOH Аспарагиновая кислота (АСП)
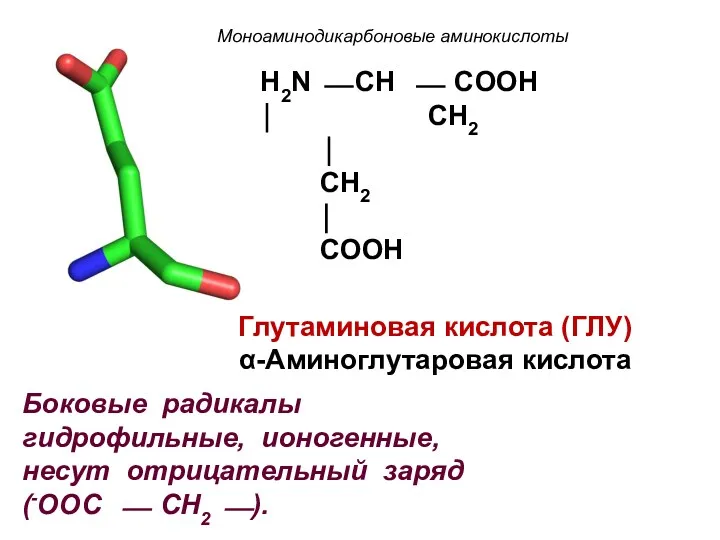
- 14. Моноаминодикарбоновые аминокислоты H2N ⎯ CH ⎯ COOH ⏐ CH2 ⏐ CH2 ⏐ COOH Глутаминовая кислота (ГЛУ)
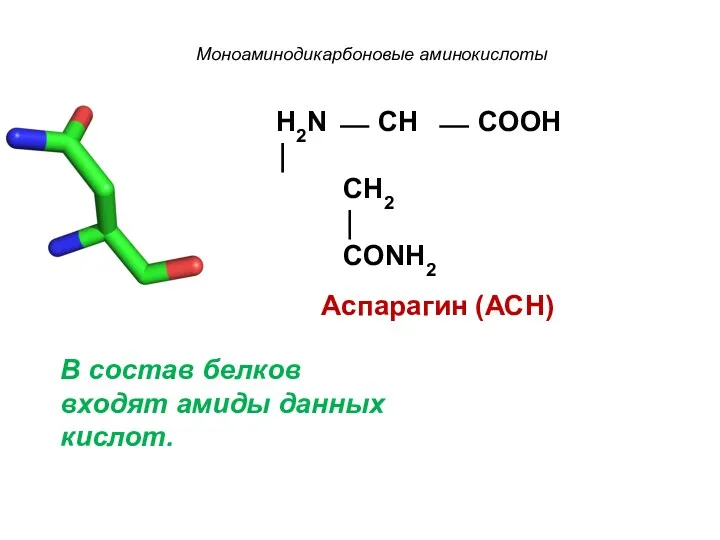
- 15. Моноаминодикарбоновые аминокислоты H2N ⎯ CH ⎯ COOH ⏐ CH2 ⏐ CONH2 Аспарагин (АСН) В состав белков
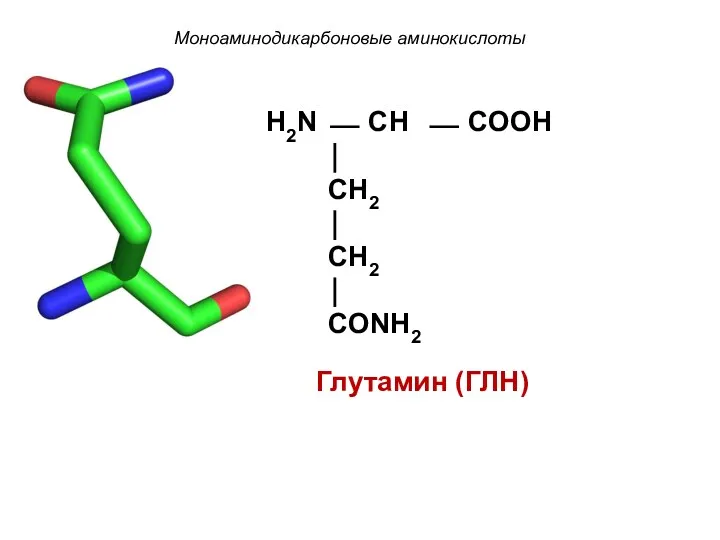
- 16. Моноаминодикарбоновые аминокислоты Глутамин (ГЛН) H2N ⎯ CH ⎯ COOH ⏐ CH2 ⏐ CH2 ⏐ CONH2
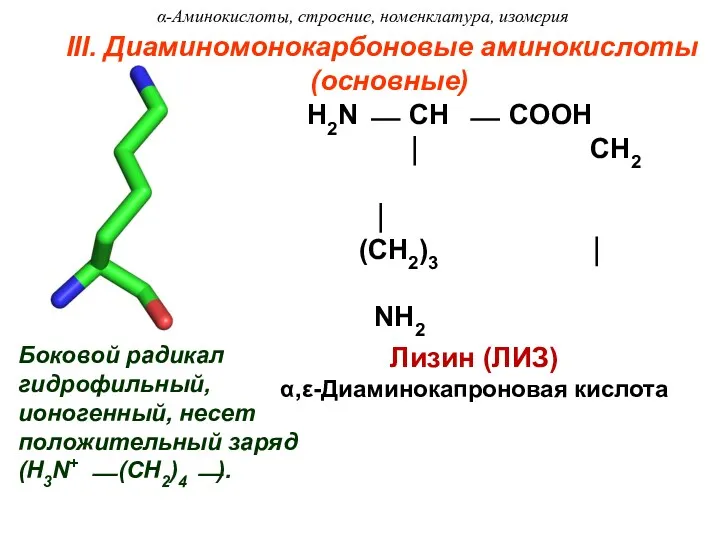
- 17. III. Диаминомонокарбоновые аминокислоты (основные) Лизин (ЛИЗ) α,ε-Диаминокапроновая кислота Боковой радикал гидрофильный, ионогенный, несет положительный заряд (H3N+
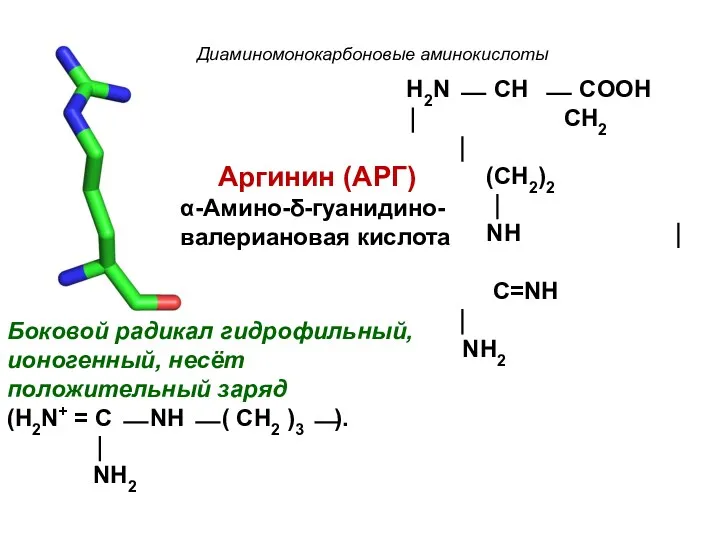
- 18. Диаминомонокарбоновые аминокислоты Аргинин (АРГ) α-Амино-δ-гуанидино- валериановая кислота Боковой радикал гидрофильный, ионогенный, несёт положительный заряд (H2N+ =
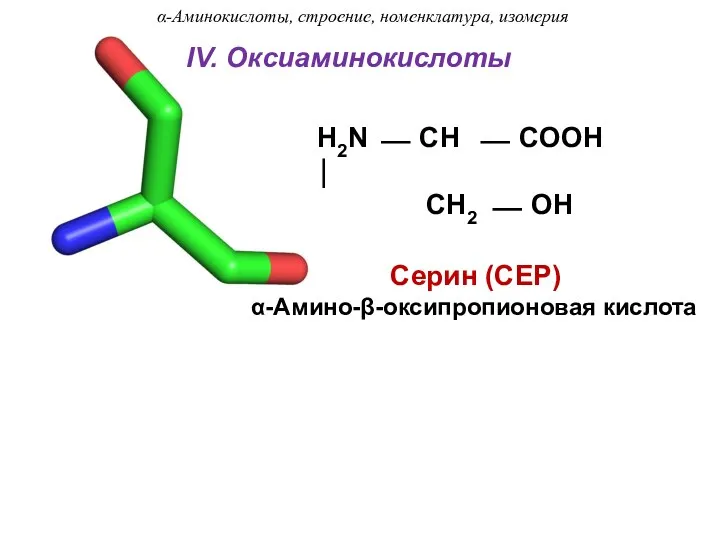
- 19. IV. Оксиаминокислоты Серин (СЕР) α-Амино-β-оксипропионовая кислота H2N ⎯ CH ⎯ COOH ⏐ CH2 ⎯ OH α-Аминокислоты,
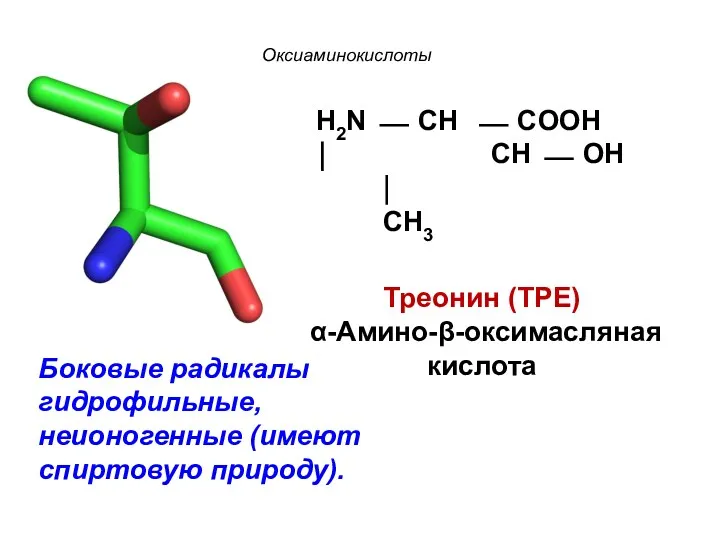
- 20. Оксиаминокислоты H2N ⎯ CH ⎯ COOH ⏐ CH ⎯ OH ⏐ CH3 Треонин (ТРЕ) α-Амино-β-оксимасляная кислота
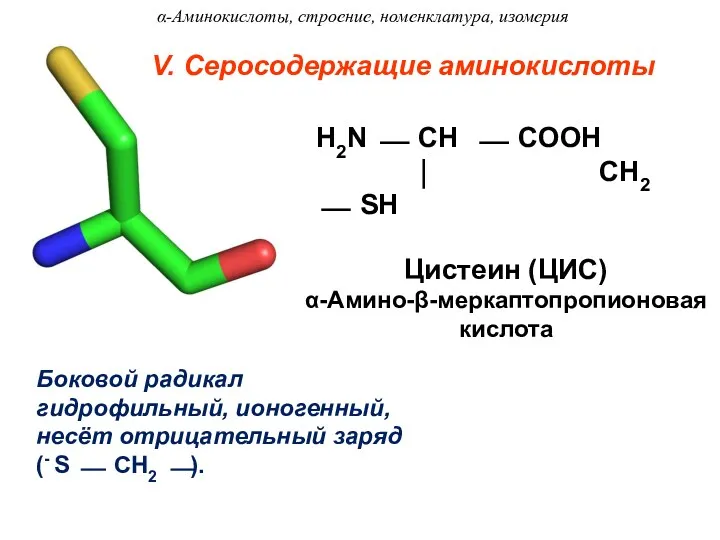
- 21. V. Серосодержащие аминокислоты Боковой радикал гидрофильный, ионогенный, несёт отрицательный заряд (- S ⎯ CH2 ⎯). H2N
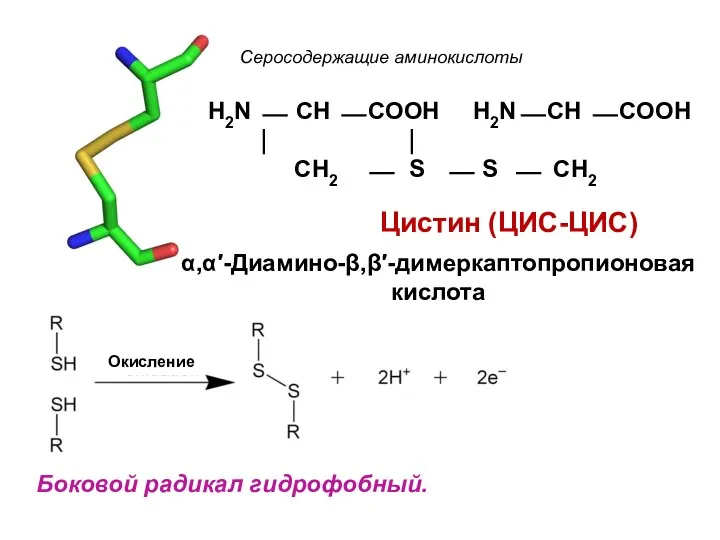
- 22. Окисление Боковой радикал гидрофобный. Серосодержащие аминокислоты Цистин (ЦИС-ЦИС) H2N ⎯ CH ⎯ COOH H2N⎯ CH ⎯
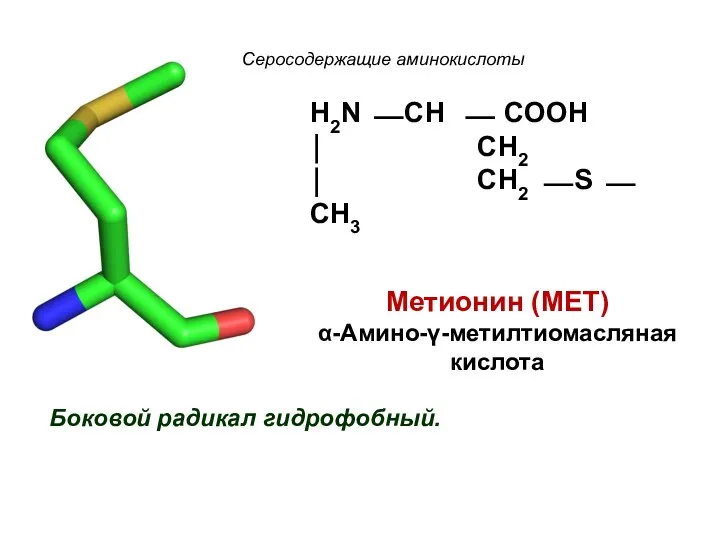
- 23. Серосодержащие аминокислоты Боковой радикал гидрофобный. H2N ⎯ CH ⎯ COOH ⏐ CH2 ⏐ CH2 ⎯ S
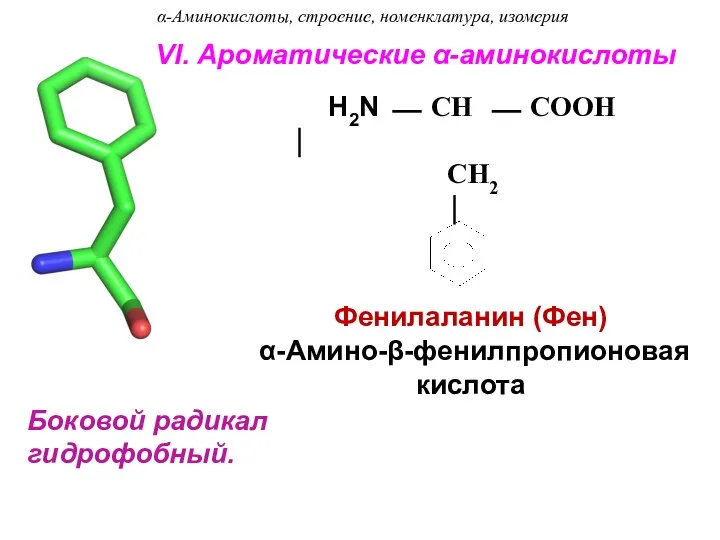
- 24. Боковой радикал гидрофобный. Фенилаланин (Фен) α-Амино-β-фенилпропионовая кислота H2N ⎯ CH ⎯ COOH ⏐ CH2 ⏐ VI.
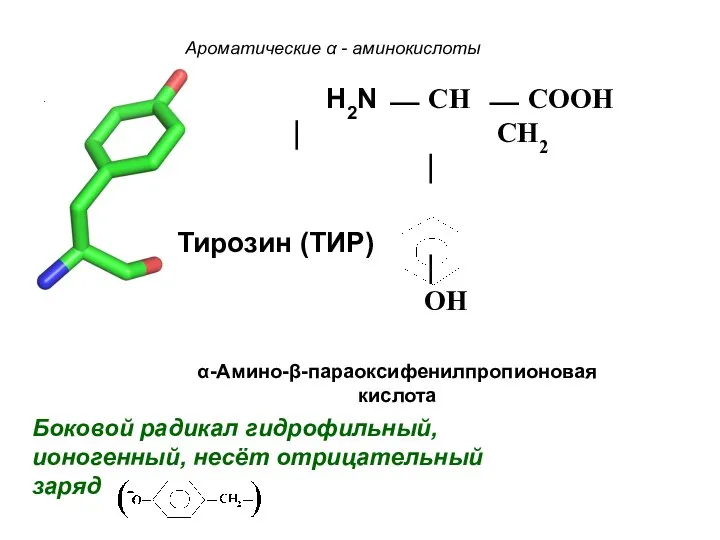
- 25. Ароматические α - аминокислоты Боковой радикал гидрофильный, ионогенный, несёт отрицательный заряд . α-Амино-β-параоксифенилпропионовая кислота H2N ⎯
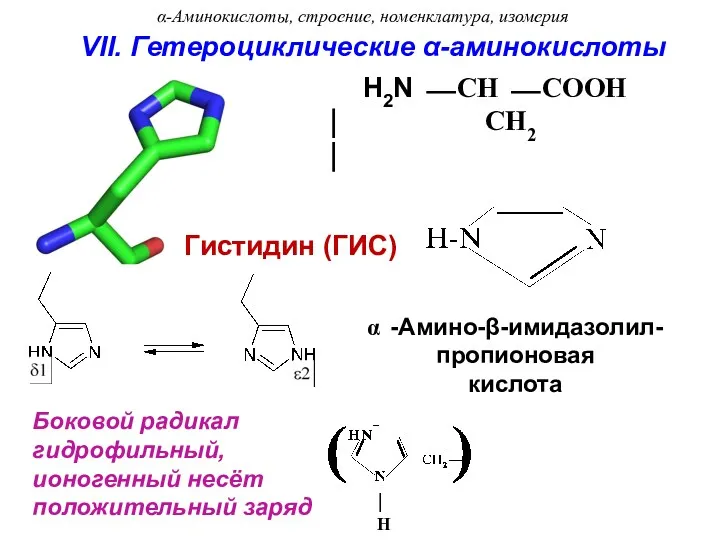
- 26. Боковой радикал гидрофильный, ионогенный несёт положительный заряд ⏐ H -Амино-β-имидазолил- пропионовая кислота Гистидин (ГИС) H2N ⎯
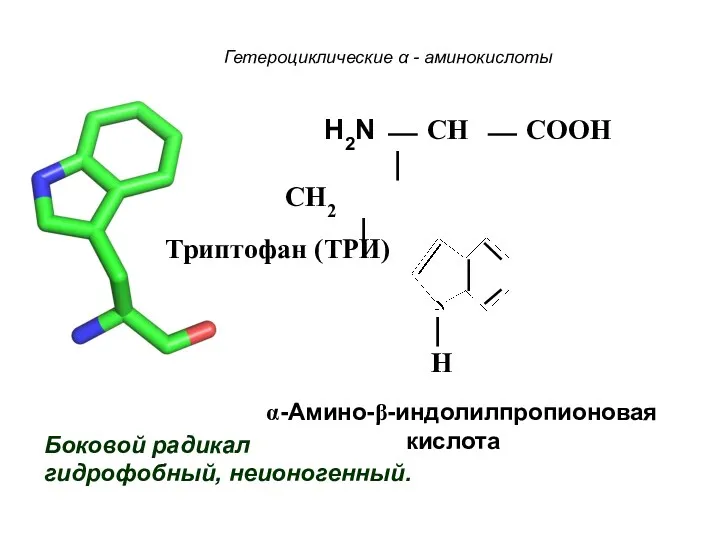
- 27. Гетероциклические α - аминокислоты Боковой радикал гидрофобный, неионогенный. H2N ⎯ CH ⎯ COOH ⏐ CH2 ⏐
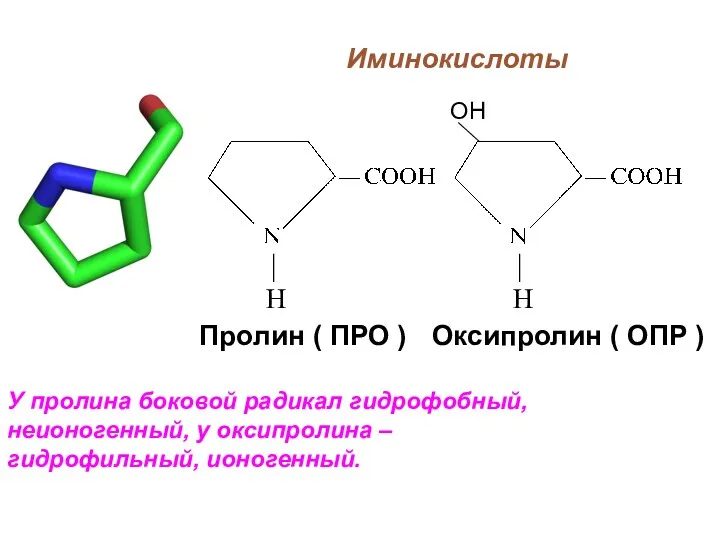
- 28. Иминокислоты У пролина боковой радикал гидрофобный, неионогенный, у оксипролина – гидрофильный, ионогенный. Пролин ( ПРО )
- 29. II. По способности синтезироваться в организме аминокислоты делятся на заменимые и незаменимые. α-Аминокислоты, строение, номенклатура, изомерия
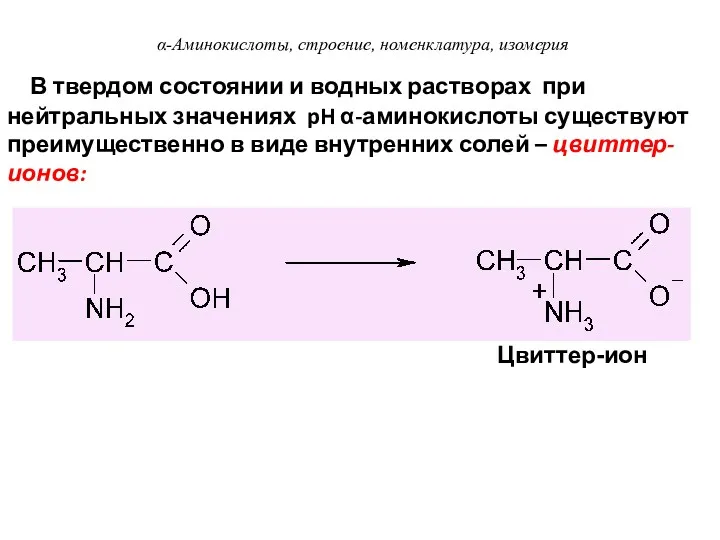
- 30. В твердом состоянии и водных растворах при нейтральных значениях pH α-аминокислоты существуют преимущественно в виде внутренних
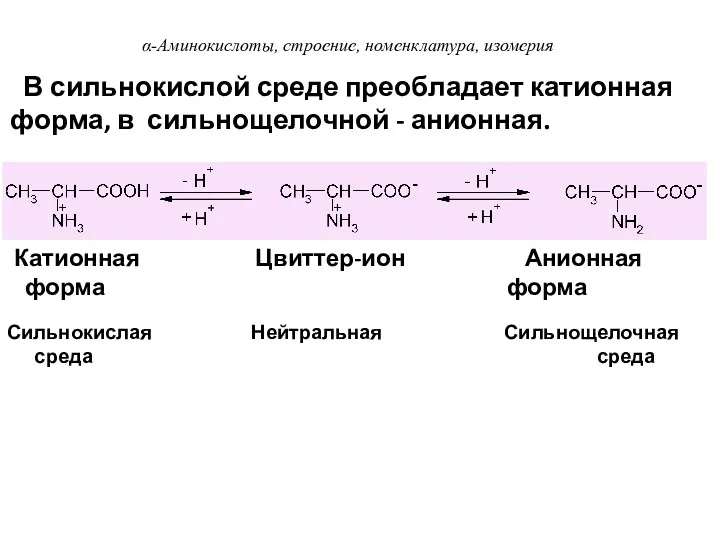
- 31. Сильнокислая Нейтральная Сильнощелочная среда среда В сильнокислой среде преобладает катионная форма, в сильнощелочной - анионная. Катионная
- 32. α-Аминокислоты, строение, номенклатура, изомерия Значение pH, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных
- 33. α-Аминокислоты, строение, номенклатура, изомерия Для моноаминомонокарбоновых кислот pI ≈ 5-6, pI моноаминодикарбоновых кислот (Asp, Glu) ≈
- 34. α-Аминокислоты, строение, номенклатура, изомерия На этом основано разделение α-аминокислот методом электрофореза.
- 35. α-Аминокислоты, строение, номенклатура, изомерия In vivo при физиологических значения рН=7,34-7,36 α-аминокислоты и белки находятся в анионной
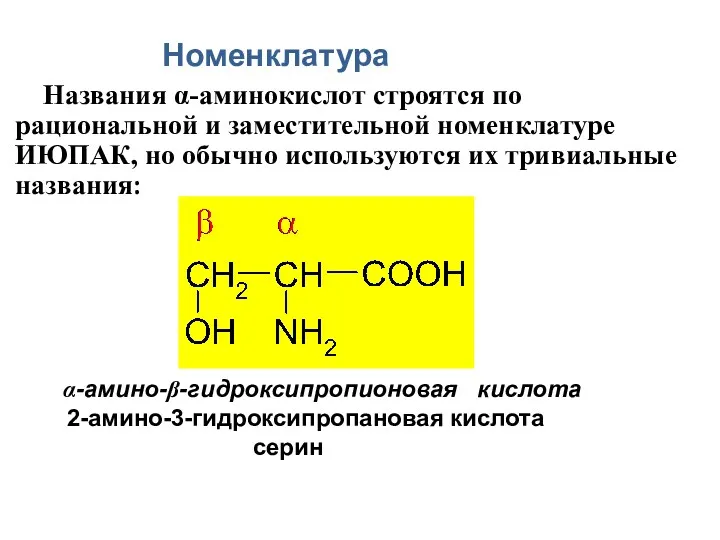
- 36. Номенклатура Названия α-аминокислот строятся по рациональной и заместительной номенклатуре ИЮПАК, но обычно используются их тривиальные названия:
- 37. Изомерия Структурная изомерия лейцин изолейцин аланин β-аланин
- 38. Стереоизомерия α - Аминокислоты - хиральные соединения, обладающие оптической активностью. Исключение составляет глицин: H2N ⎯ CH2
- 39. Стереоизомерия Относительная конфигурация α-аминокислот определяется по положению –NН2 группы у α-углеродного звена. Расположение аминогруппы слева соответствует
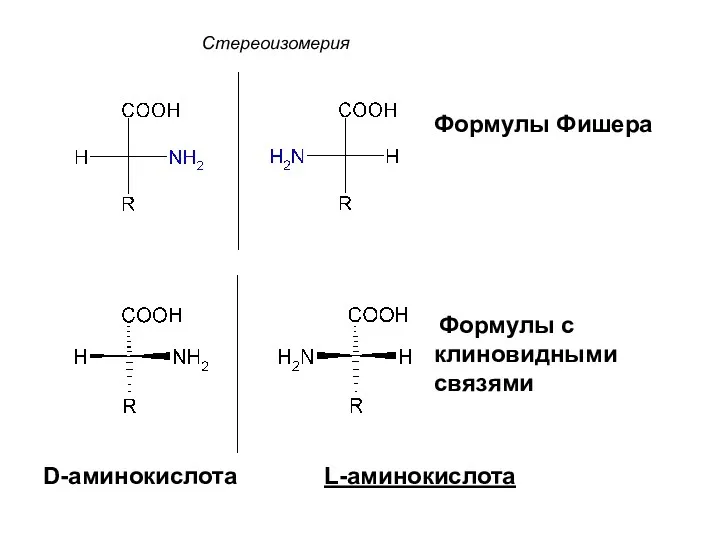
- 40. Стереоизомерия D-аминокислота L-аминокислота Формулы Фишера Формулы с клиновидными связями
- 41. Аминокислоты, строение, номенклатура, изомерия, классификация CH3 COOH CH3 L - треонин D - треонин COOH COOH
- 42. Физические свойства α-Аминокислоты - кристаллические вещества. Имеют высокие температуры плавления (выше 200° С), нелетучие, растворимые в
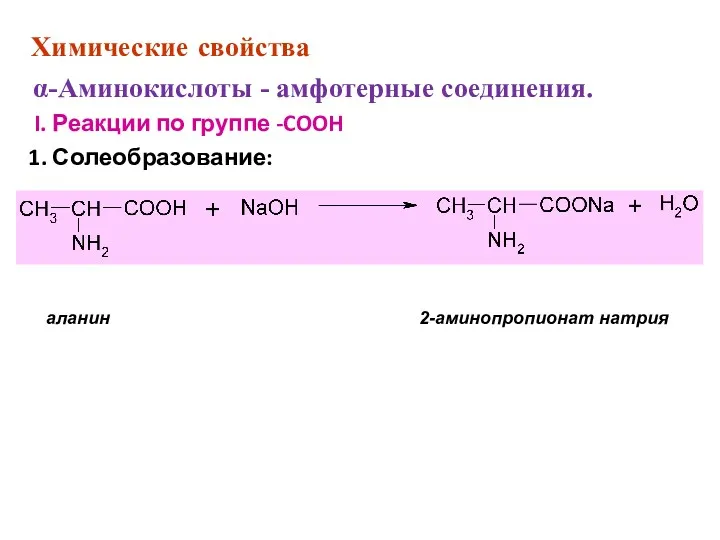
- 43. Химические свойства α-Аминокислоты - амфотерные соединения. I. Реакции по группе -COOH 1. Солеобразование: аланин 2-аминопропионат натрия
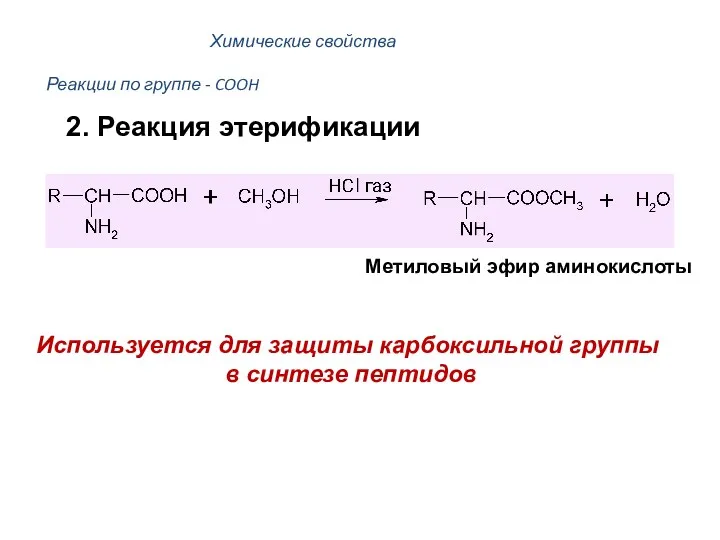
- 44. Реакции по группе - COOH Метиловый эфир аминокислоты Используется для защиты карбоксильной группы в синтезе пептидов
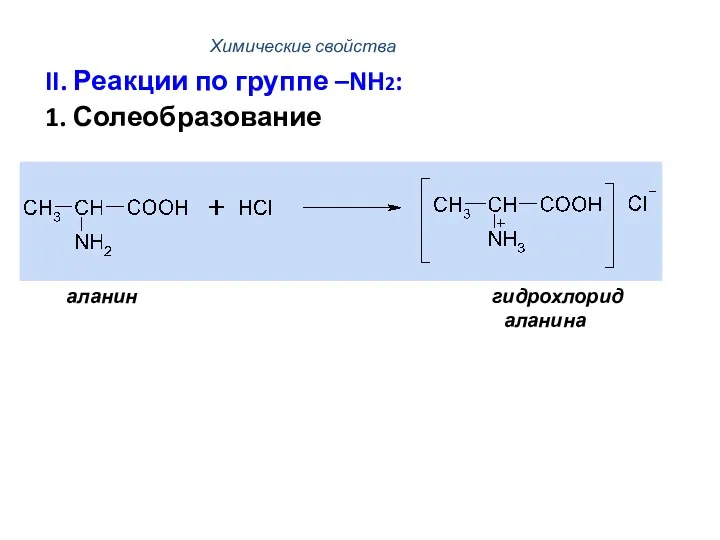
- 45. Химические свойства II. Реакции по группе –NH2: 1. Солеобразование аланин гидрохлорид аланина
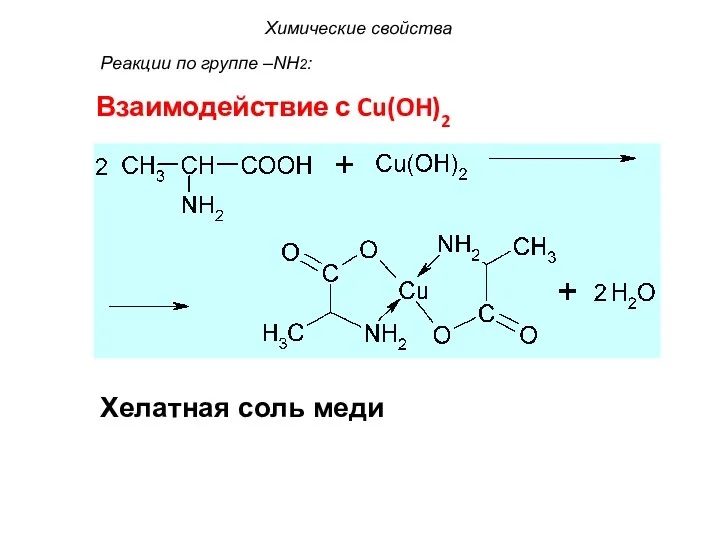
- 46. Взаимодействие с Cu(OH)2 Хелатная соль меди Химические свойства Реакции по группе –NH2:
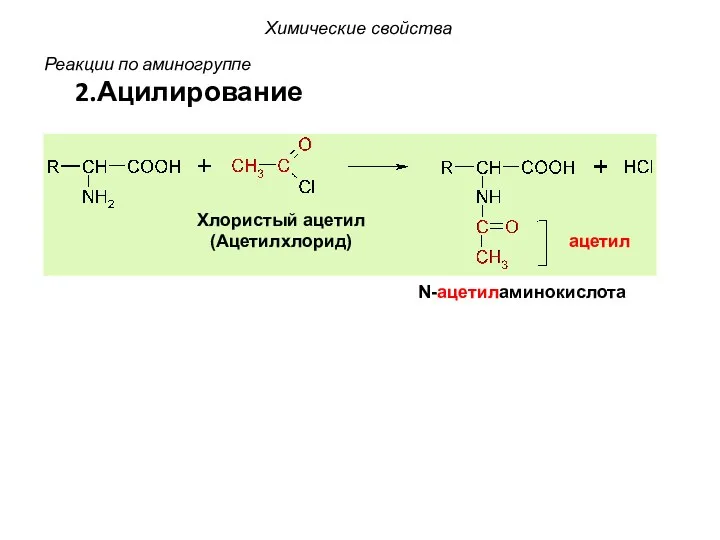
- 47. Реакции по аминогруппе 2.Ацилирование Хлористый ацетил (Ацетилхлорид) N-ацетиламинокислота ацетил Химические свойства
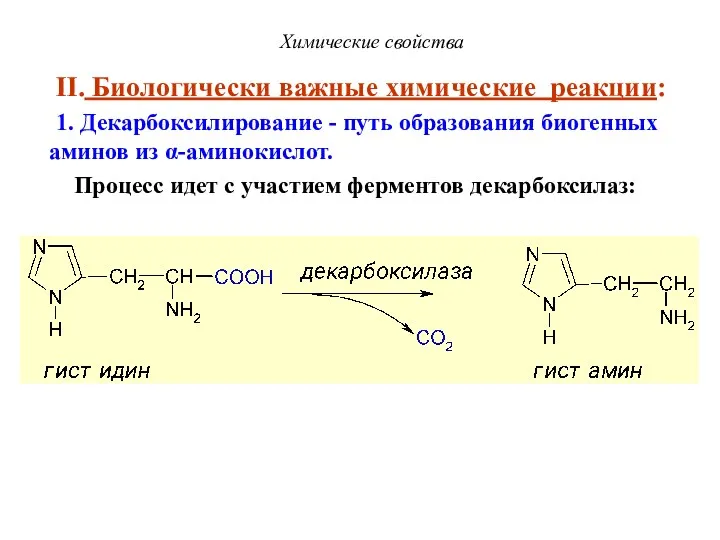
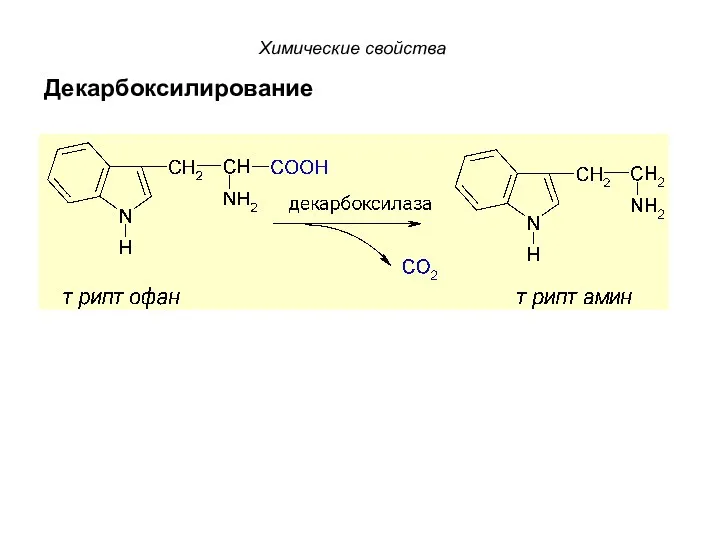
- 48. Химические свойства II. Биологически важные химические реакции: 1. Декарбоксилирование - путь образования биогенных аминов из α-аминокислот.
- 49. Декарбоксилирование Химические свойства
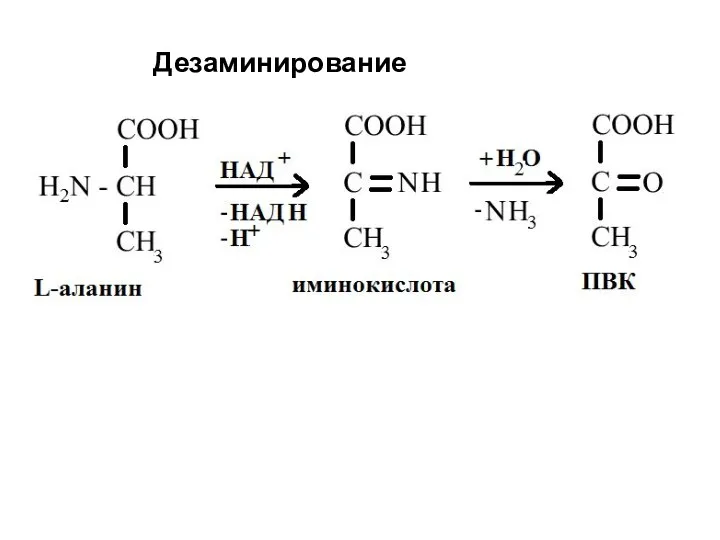
- 50. 2. Дезаминирование - это реакция удаления аминогруппы путем окислительного, восстановительного, гидролитического или внутримолекулярного дезаминирования. В организме
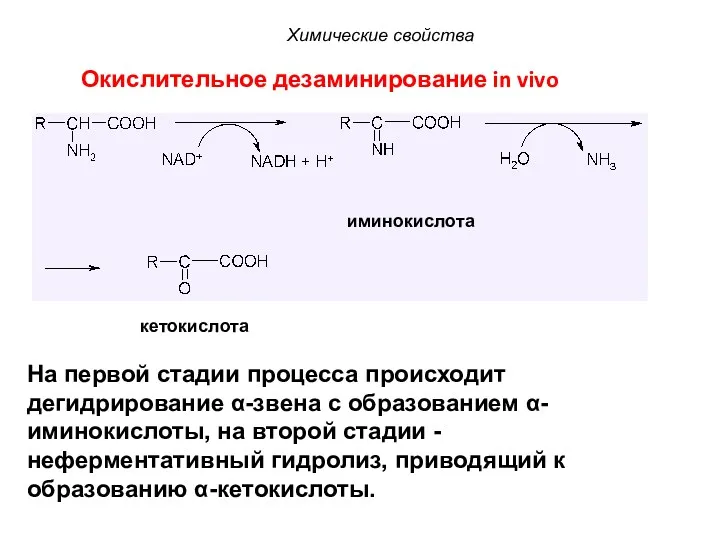
- 51. Окислительное дезаминирование in vivo иминокислота кетокислота Химические свойства На первой стадии процесса происходит дегидрирование α-звена с
- 52. Дезаминирование
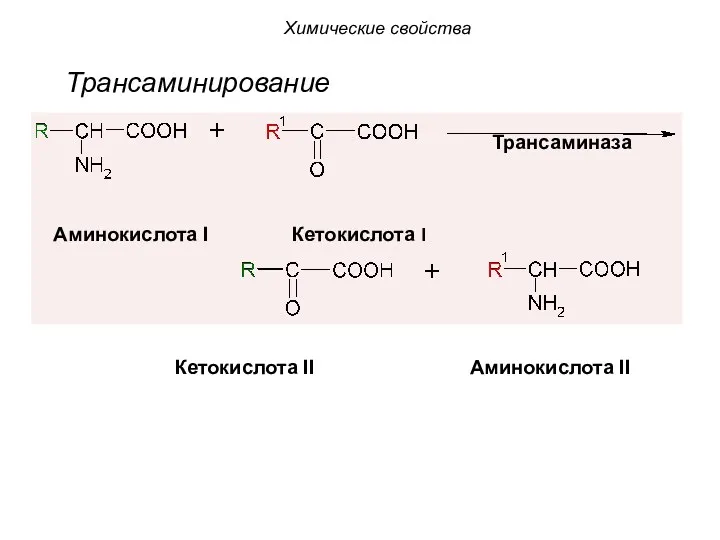
- 53. 3. Трансаминирование (переаминирование) - это путь синтеза необходимых α-аминокислот из α-кетонокислот. При этом донором аминогруппы является
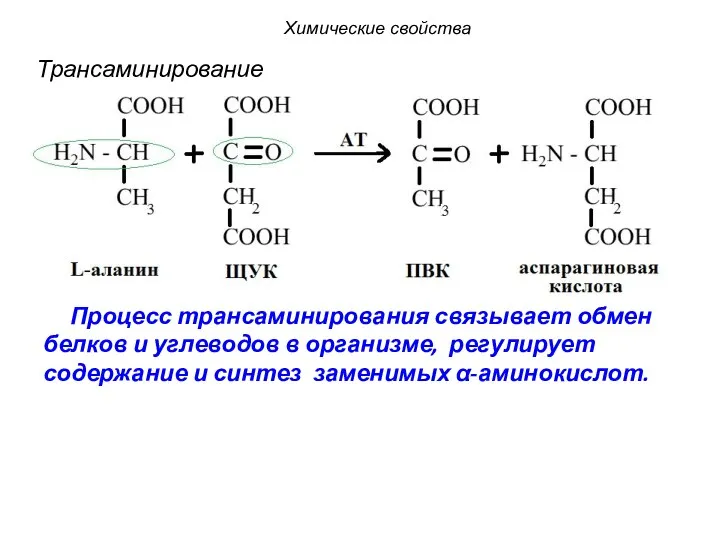
- 54. Трансаминирование Аминокислота I Кетокислота I Кетокислота II Аминокислота II Трансаминаза Химические свойства
- 55. Процесс трансаминирования связывает обмен белков и углеводов в организме, регулирует содержание и синтез заменимых α-аминокислот. Трансаминирование
- 56. Пептиды и белки Пептиды (греч. πεπτος — питательный) и белки - биополимеры, построенные из α-аминокислот. Пептиды
- 57. Функции белков 1. Ферментативная 2. Структурная 3. Питательная 4. Защитная функция 5. Транспортная 6. Регуляторная 7.
- 58. Классификация пептидов и белков II. По составу белки делят на простые (неконъюгированные) и сложные (конъюгированные). Сложные
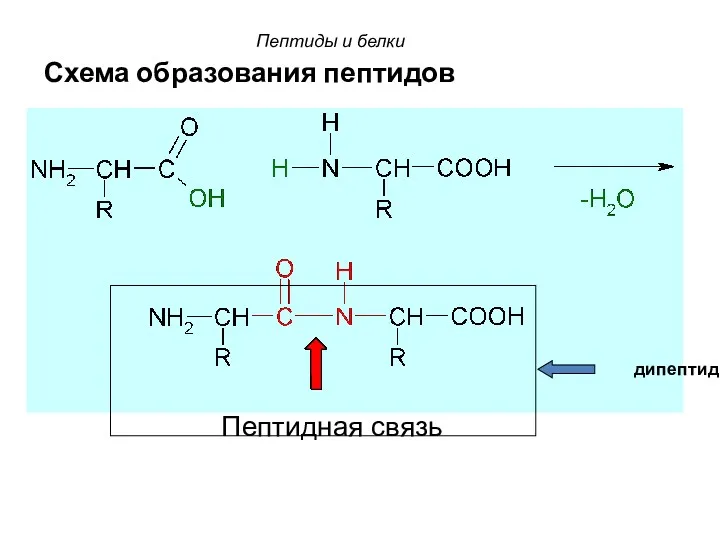
- 59. Схема образования пептидов Пептидная связь дипептид Пептиды и белки
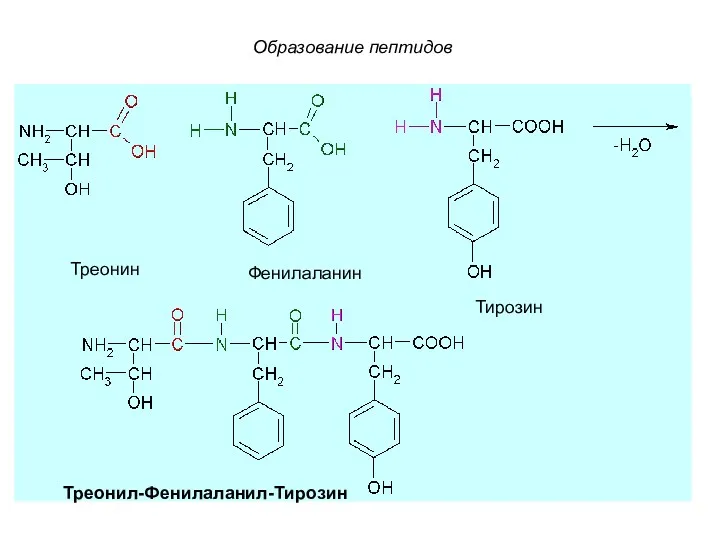
- 60. Треонин Фенилаланин Тирозин Треонил-Фенилаланил-Тирозин Образование пептидов
- 61. Пептиды и белки Названия пептидов строятся путём последовательного перечисления аминокислотных остатков, начиная с N-конца, с добавлением
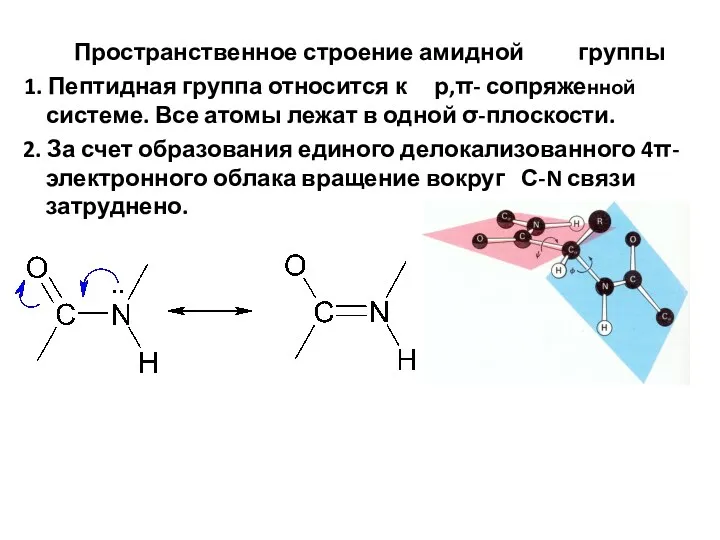
- 62. Пространственное строение амидной группы 1. Пептидная группа относится к р,π- сопряженной системе. Все атомы лежат в
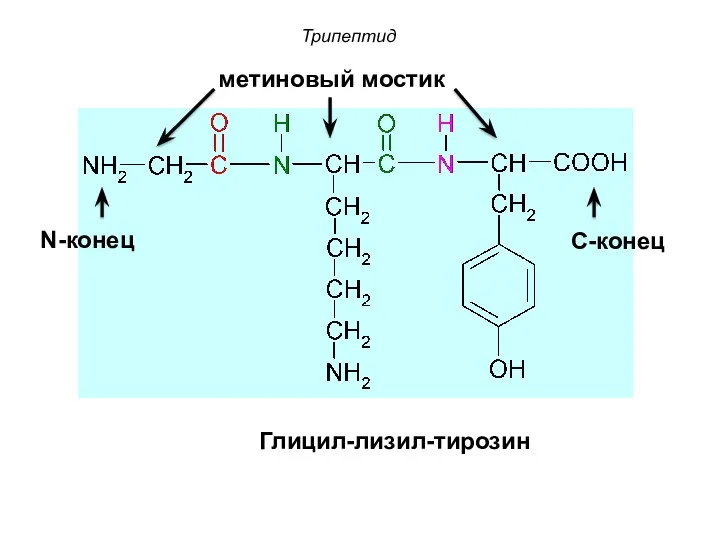
- 63. Глицил-лизил-тирозин Трипептид N-конец С-конец метиновый мостик
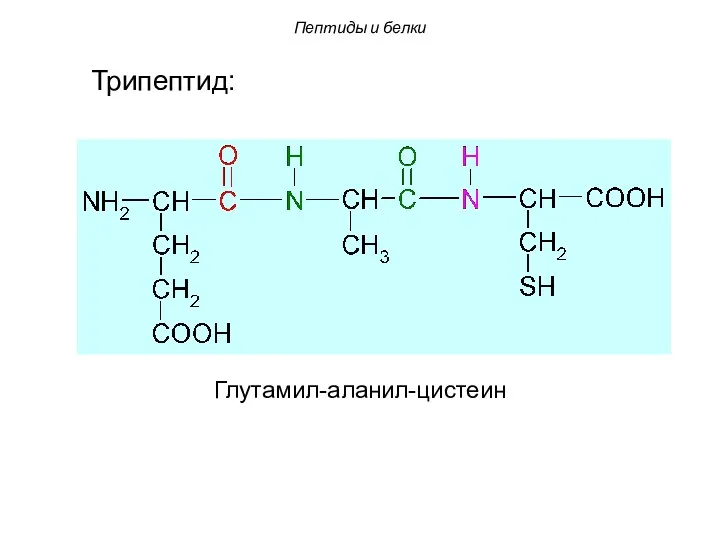
- 64. Глутамил-аланил-цистеин Трипептид: Пептиды и белки
- 65. Изоэлектрическая точка белка (pI) Молекула белка имеет электрический заряд. В нейтральной среде заряд белковой молекулы определяется
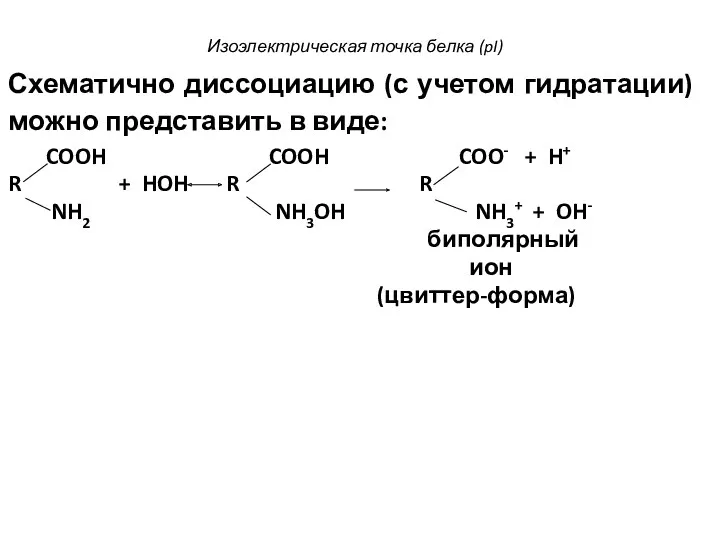
- 66. Изоэлектрическая точка белка (pI) Схематично диссоциацию (с учетом гидратации) можно представить в виде: COOH COOH COO-
- 67. Изоэлектрическая точка белка Чем больше –COOH, –OH, –SH групп, тем выше отрицательный заряд, и белок будет
- 68. I. Аминокислоты, пептиды и белки являются амфотерными соединениями, содержащими и кислотные группы (–COOH) и оснóвные группы
- 69. Химические свойства II. По месту пептидных связей молекулы белков гидролизуются: а) in vivo с участием ферментов
- 70. Химические свойства пептидов и белков б) Гидролиз in vitro происходит в сильнокислой или сильнощелочной среде и
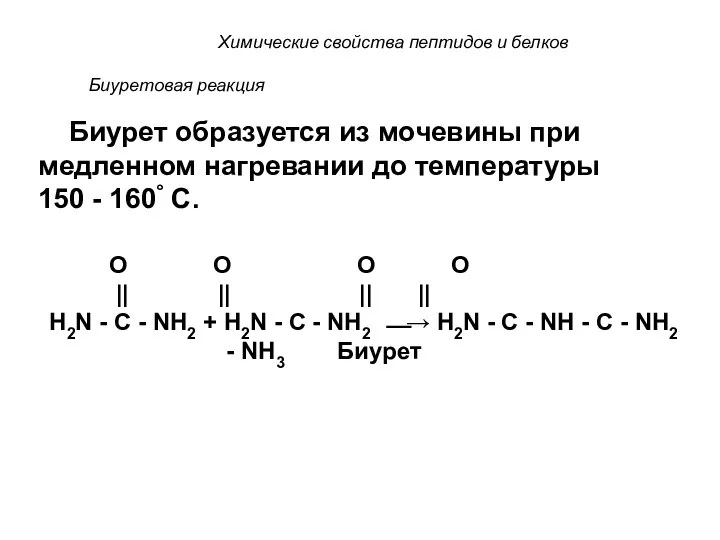
- 71. Биуретовая реакция В реакцию вступают все пептиды и белки, содержащие не менее двух пептидных связей. Реактив
- 72. Биуретовая реакция Биурет образуется из мочевины при медленном нагревании до температуры 150 - 160° С. O
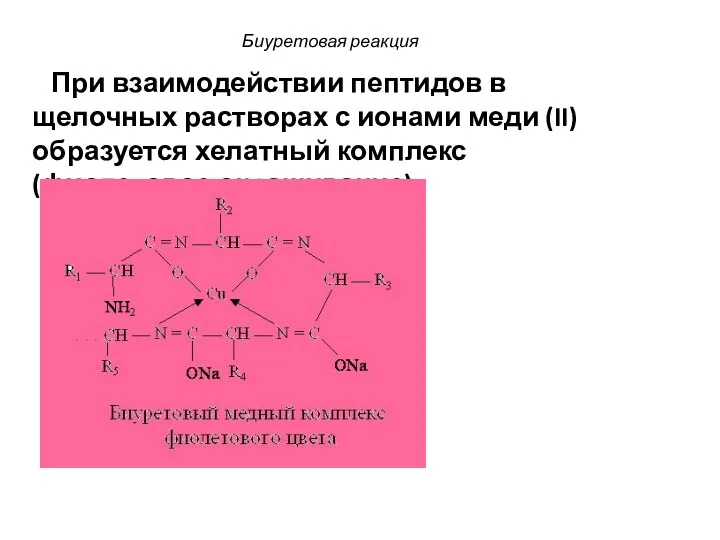
- 73. Биуретовая реакция При взаимодействии пептидов в щелочных растворах с ионами меди (II) образуется хелатный комплекс (фиолетовое
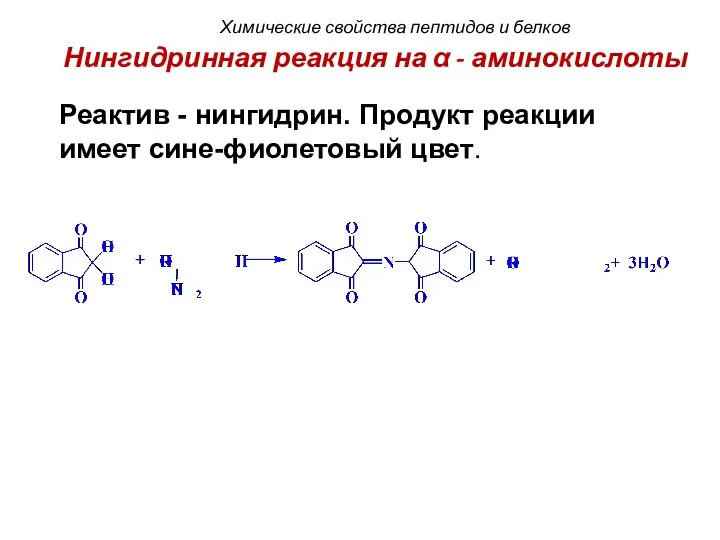
- 74. Нингидринная реакция на α - аминокислоты Реактив - нингидрин. Продукт реакции имеет сине-фиолетовый цвет. Химические свойства
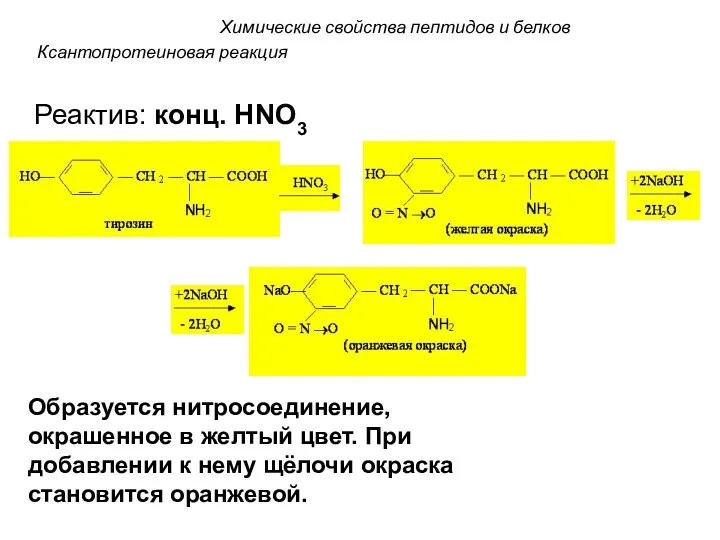
- 75. Ксантопротеиновая реакция Определяет присутствие в белке ароматических и гетероциклических α - аминокислот: триптофана, фенилаланина, тирозина, гистидина.
- 76. Ксантопротеиновая реакция Реактив: конц. HNO3 Образуется нитросоединение, окрашенное в желтый цвет. При добавлении к нему щёлочи
- 77. Реакция Миллона на тирозин Реактив Миллона: раствор HgNO3 и Hg(NO2)2 в разбавленной HNO3, содержащей примесь HNO2.
- 78. Реакция Миллона Реактив Миллона взаимодействует с тирозином с образованием ртутной соли нитропроизводного тирозина, окрашенной в розовато-красный
- 79. Реакция Фоля Это реакция на цистеин и цистин. Химические свойства пептидов и белков
- 80. Реакция Фоля При щелочном гидролизе цистеина или цистина образуется сероводород, который, реагируя со щелочью, дает сульфиды
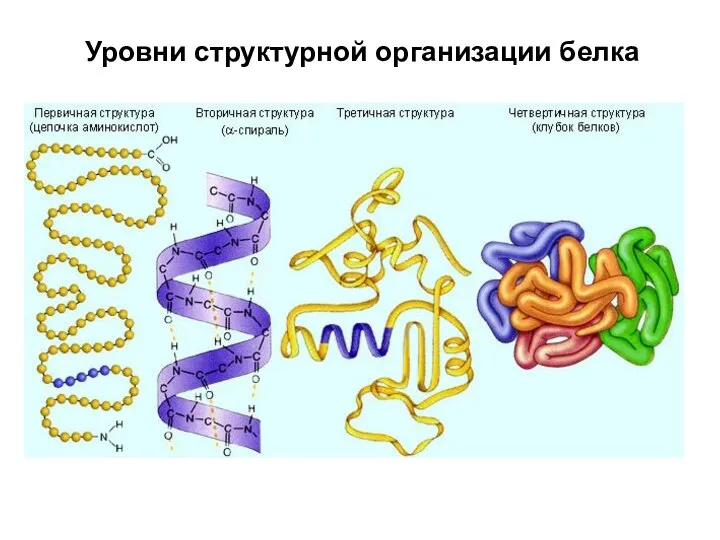
- 81. Уровни структурной организации белка
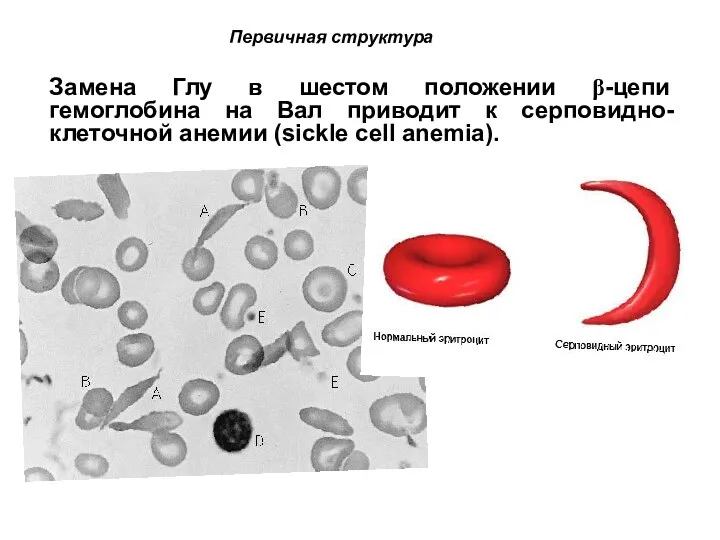
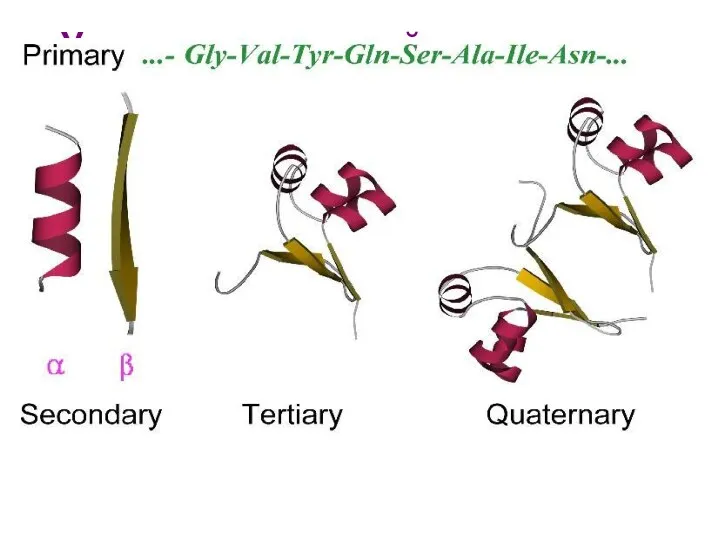
- 82. Первичная структура NH2-Tyr-Pro-Lys-Gly-Phe-Tyr-Lys-COOH. Первичная структура определяет уровни структурной организации белка. Первичная структура – последовательность аминокислотных остатков
- 83. Замена Глу в шестом положении β-цепи гемоглобина на Вал приводит к серповидно-клеточной анемии (sickle cell anemia).
- 84. 20 аминокислот могут дать примерно 100000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000 белков. Это астрономическое число – число гугол умноженное на число
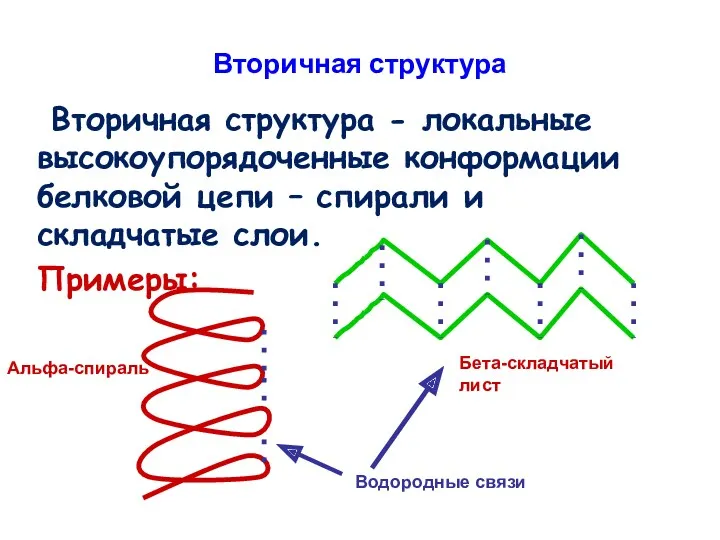
- 85. Вторичная структура Вторичная структура - локальные высокоупорядоченные конформации белковой цепи – спирали и складчатые слои. Примеры:
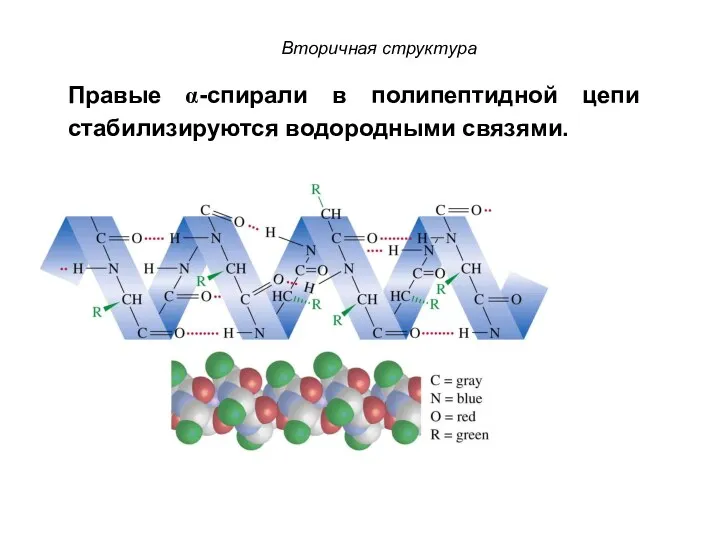
- 86. Правые α-спирали в полипептидной цепи стабилизируются водородными связями. Вторичная структура
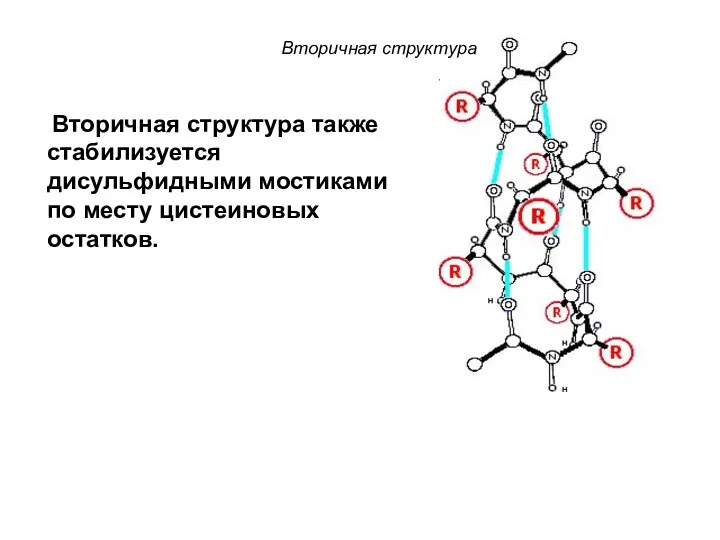
- 87. Вторичная структура также стабилизуется дисульфидными мостиками по месту цистеиновых остатков. Вторичная структура
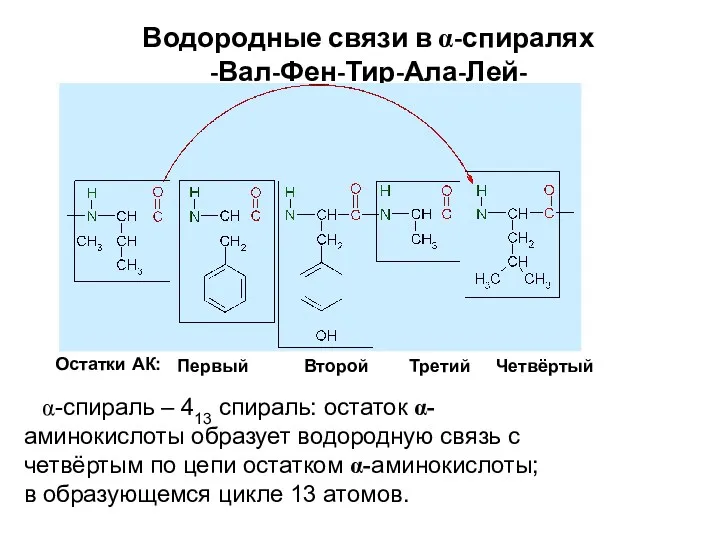
- 88. Водородные связи в α-спиралях -Вал-Фен-Тир-Ала-Лей- Первый Второй Третий Четвёртый Остатки АК: α-спираль – 413 спираль: остаток
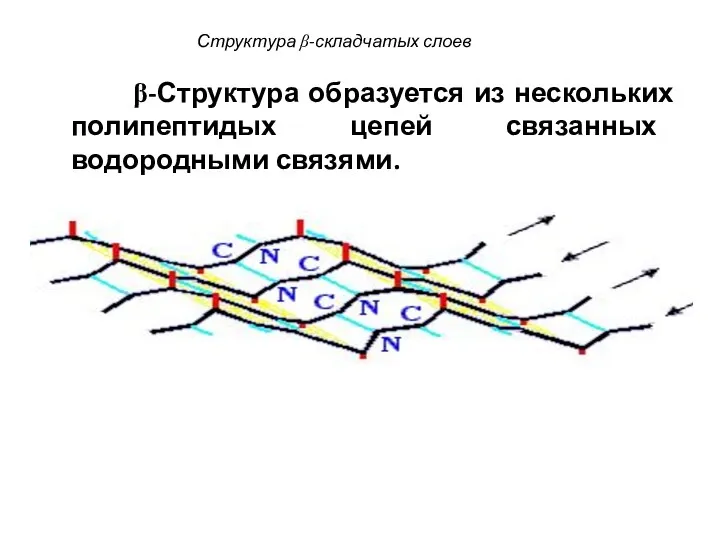
- 89. Структура β-складчатых слоев β-Структура образуется из нескольких полипептидых цепей связанных водородными связями.
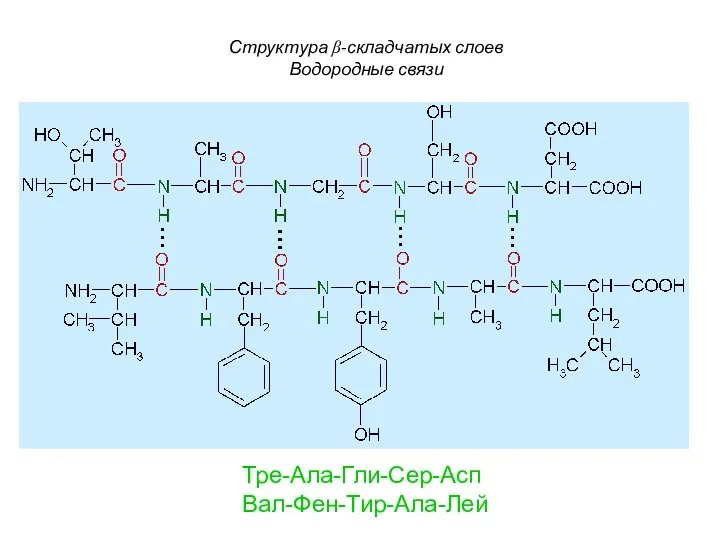
- 90. Структура β-складчатых слоев Водородные связи Тре-Ала-Гли-Сер-Асп Вал-Фен-Тир-Ала-Лей
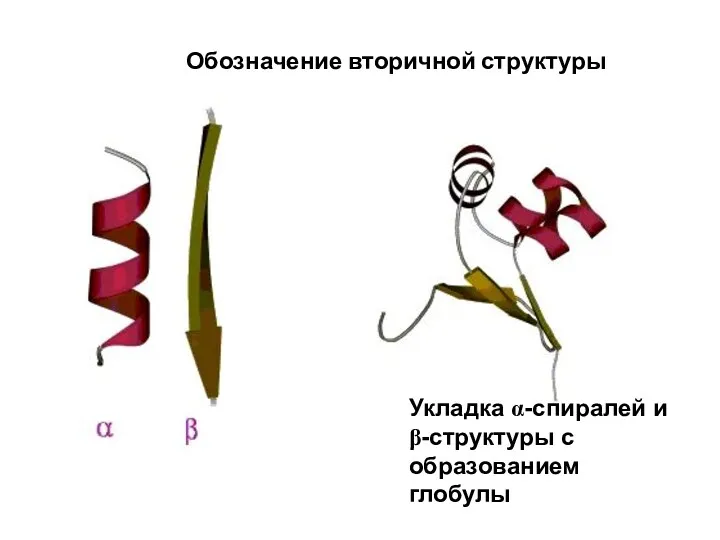
- 91. Обозначение вторичной структуры Укладка α-спиралей и β-структуры с образованием глобулы
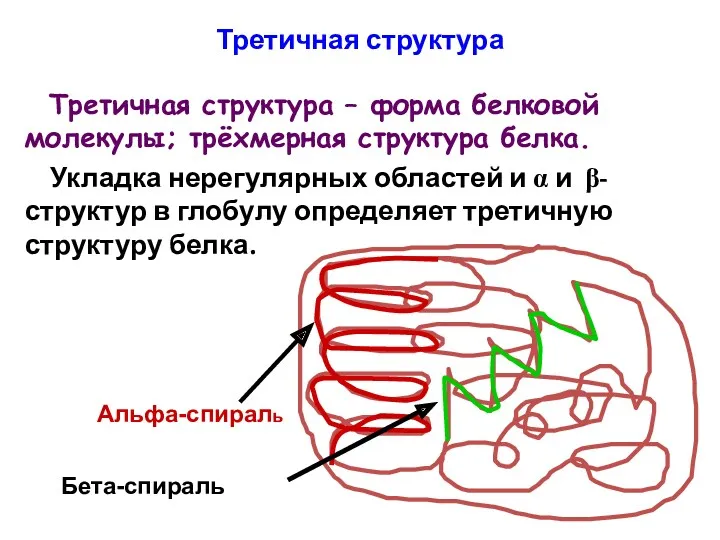
- 92. Третичная структура Третичная структура – форма белковой молекулы; трёхмерная структура белка. Укладка нерегулярных областей и α
- 93. Третичная структура α-Аминокислоты в белковой глобуле взаимодействуют за счёт: Ковалентных связей (дисульфидные –S–S– связи в цистине)
- 94. Уровни структурной организации белка
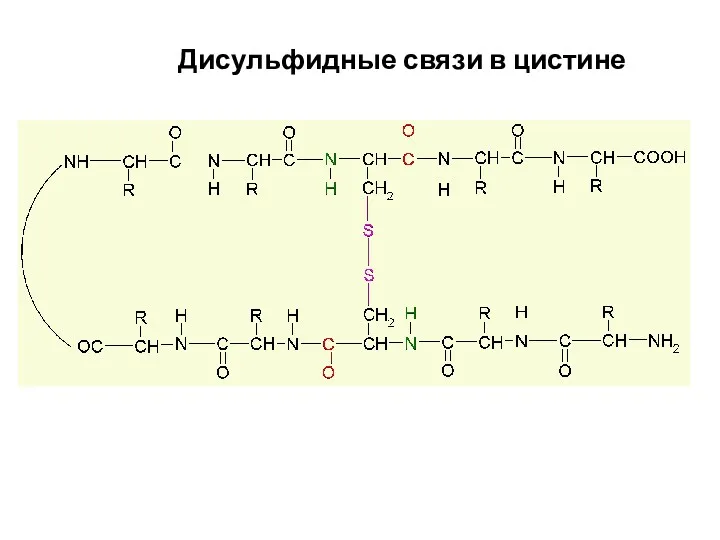
- 95. Дисульфидные связи в цистине
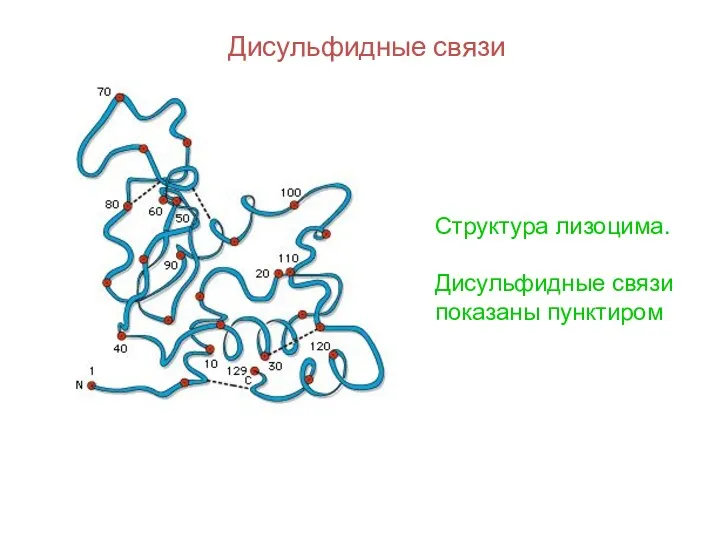
- 96. Дисульфидные связи Структура лизоцима. Дисульфидные связи показаны пунктиром
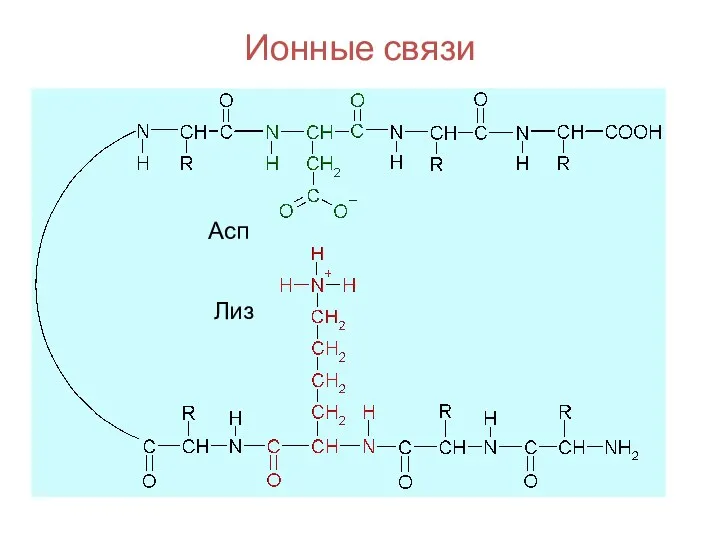
- 97. Ионные связи Асп Лиз
- 98. Третичная структура По третичной структуре белки делят на: глобулярные - для них характерна α-спиральная структура (яичный
- 99. Пептиды и белки Глобулярные белки выполняют функции, требующие подвижности и, следовательно, растворимости. Они участвуют в регуляции
- 100. Пептиды и белки Фибриллярные белки нерастворимы, склонны к образованию волокон и потому служат основным строительным материалом
- 101. Третичная структура Сериновая протеиназа - трипсин Родопсин
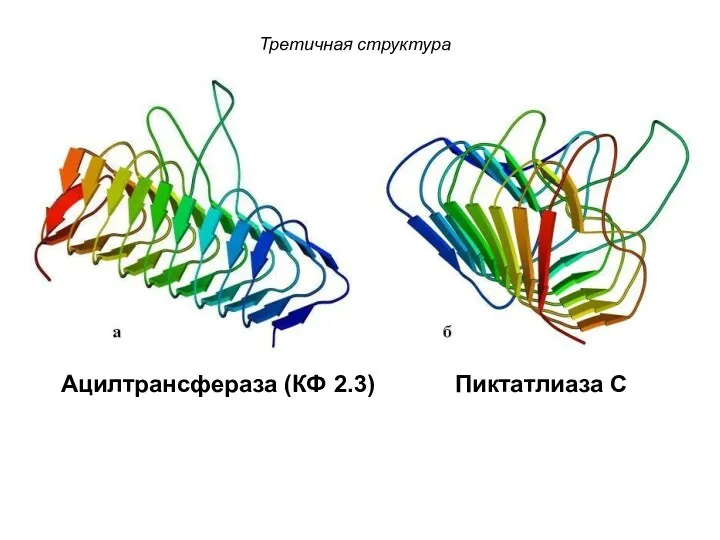
- 102. Третичная структура Ацилтрансфераза (КФ 2.3) Пиктатлиаза С
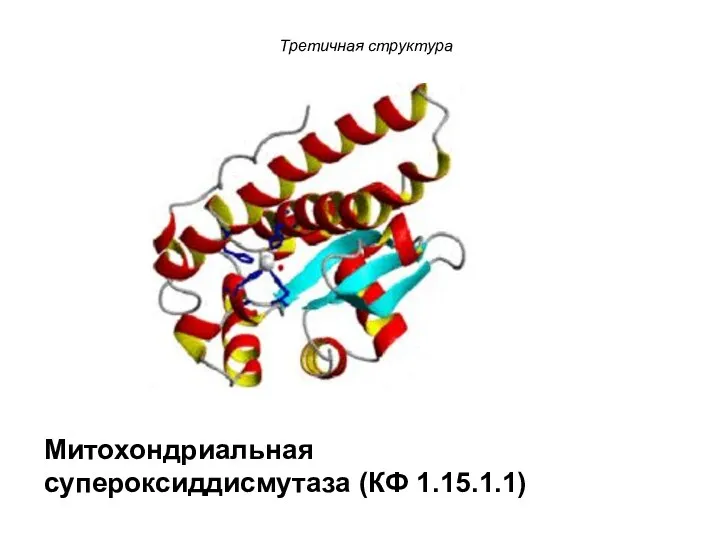
- 103. Третичная структура Митохондриальная супероксиддисмутаза (КФ 1.15.1.1)
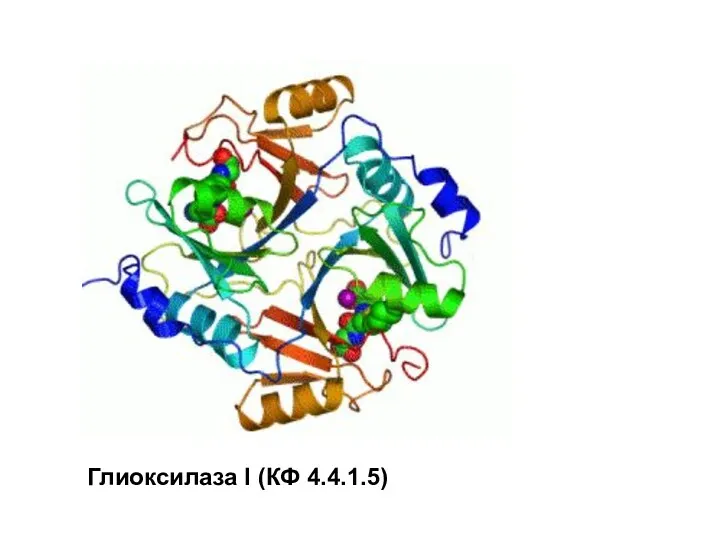
- 104. Figura 4: Cofactores Глиоксилаза I (КФ 4.4.1.5)
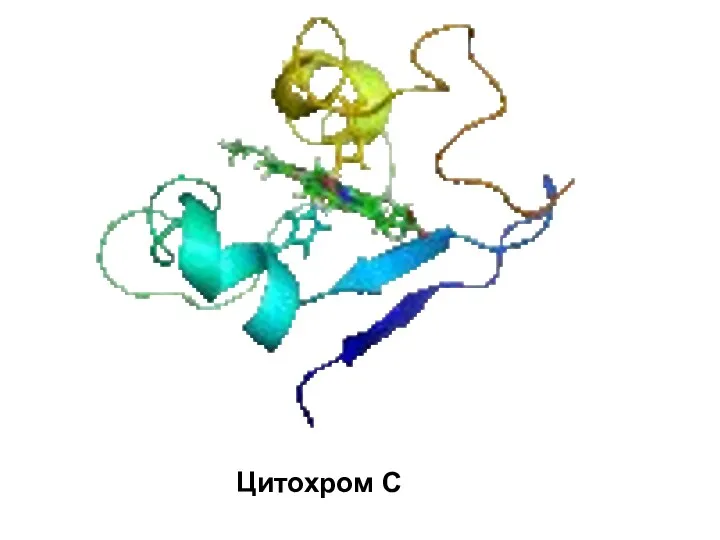
- 105. Цитохром C
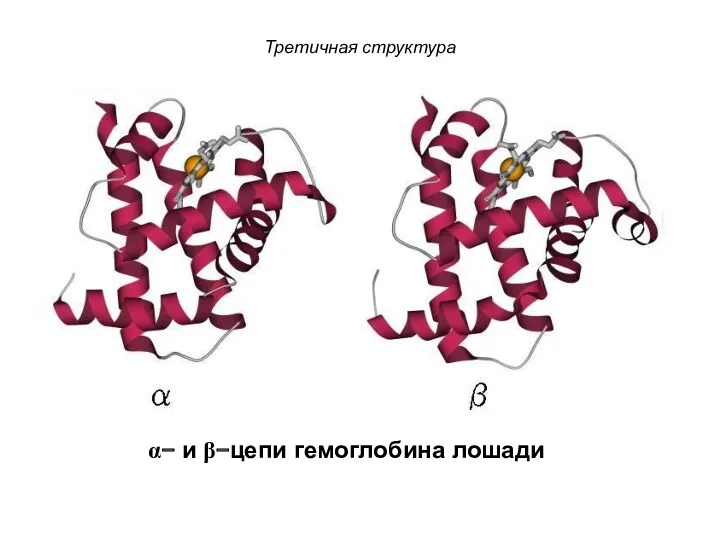
- 106. Третичная структура α− и β−цепи гемоглобина лошади
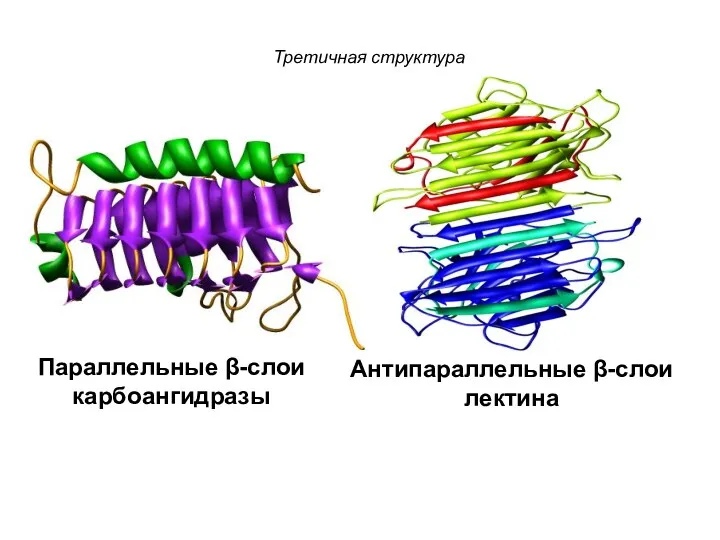
- 107. Третичная структура Параллельные β-слои карбоангидразы Антипараллельные β-слои лектина
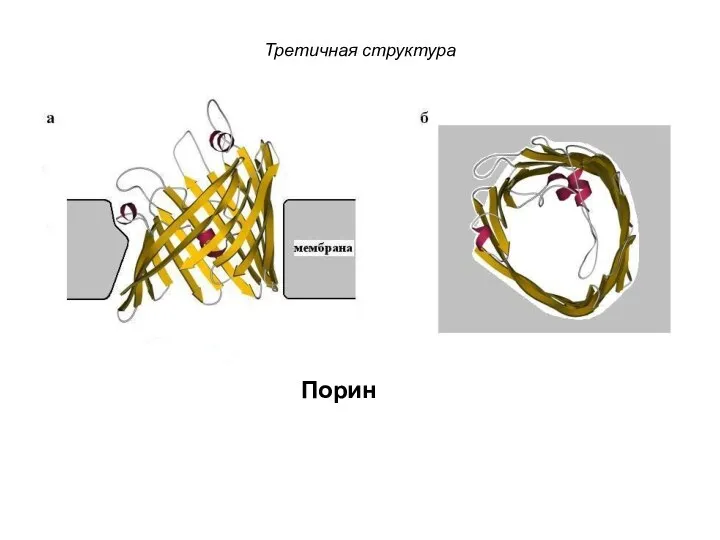
- 108. Третичная структура Порин
- 109. Фолдинг – сворачивание белковой цепи с образованием нативной структуры.
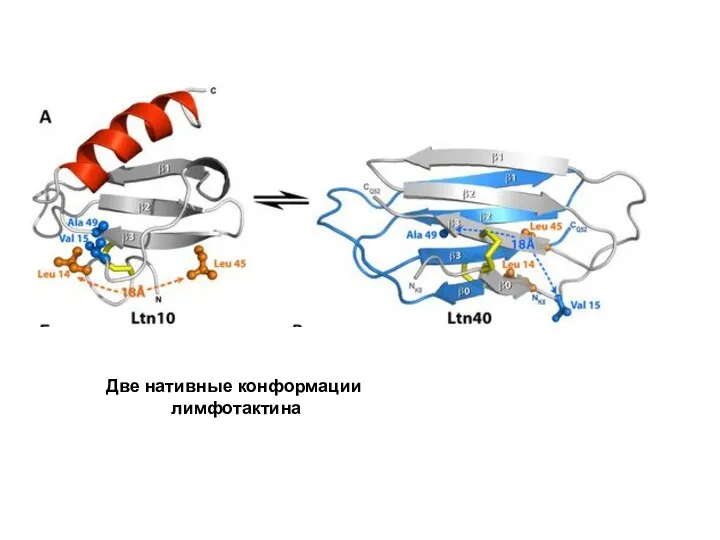
- 110. Две нативные конформации лимфотактина
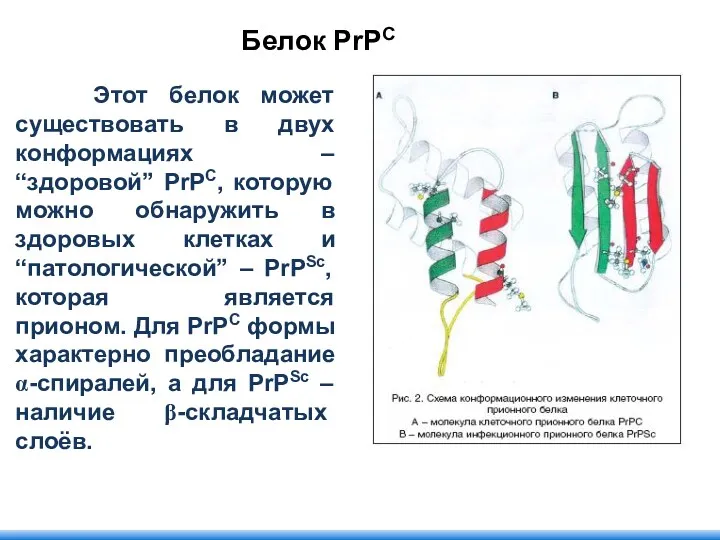
- 111. Этот белок может существовать в двух конформациях – “здоровой” PrPC, которую можно обнаружить в здоровых клетках
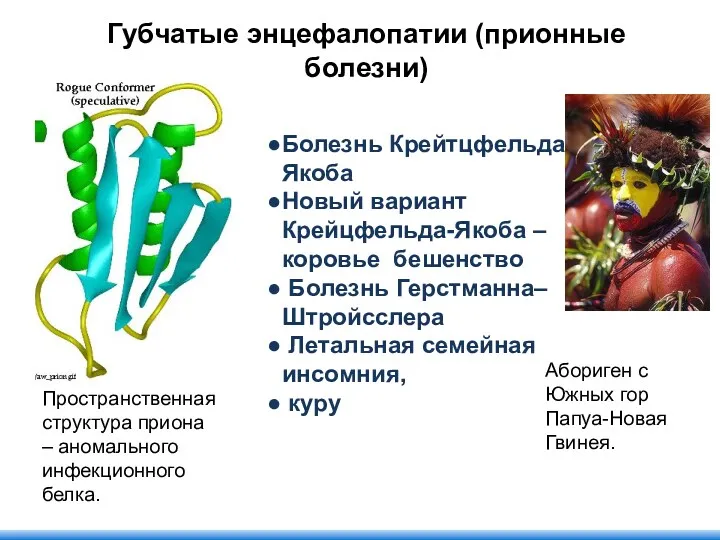
- 112. Болезнь Крейтцфельда-Якоба Новый вариант Крейцфельда-Якоба – коровье бешенство Болезнь Герстманна–Штройсслера Летальная семейная инсомния, куру Абориген с
- 113. Домены Домены – глобулярные области в пределах одной белковой молекулы. Домены соединены шарнирным участком. Доменная структура
- 114. Четвертичная структура Четвертичная структура - агрегат нескольких белковых молекул, образующих одну структуру. Взаимодействия: ионные, водородные, гидрофобные,
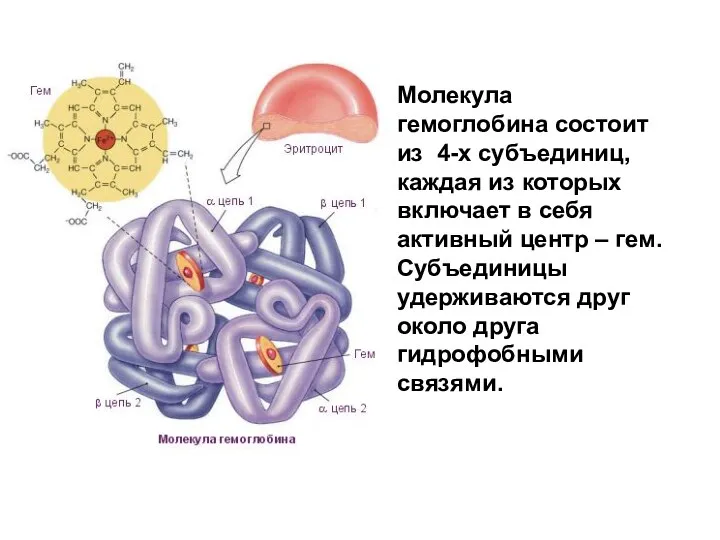
- 115. Молекула гемоглобина состоит из 4-х субъединиц, каждая из которых включает в себя активный центр – гем.
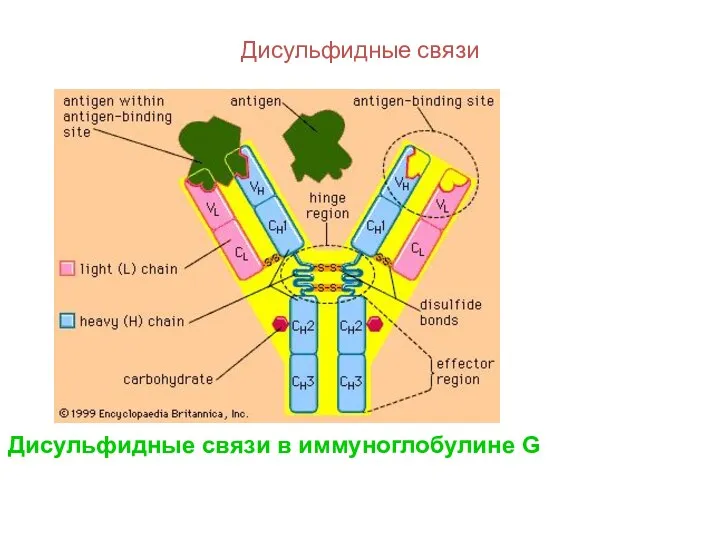
- 116. Дисульфидные связи Дисульфидные связи в иммуноглобулине G
- 117. Четвертичная структура Лактатдегидрогеназа (КФ 1.1.1.27) Фермент состоит из полипептидных цепей двух типов — М (от англ.
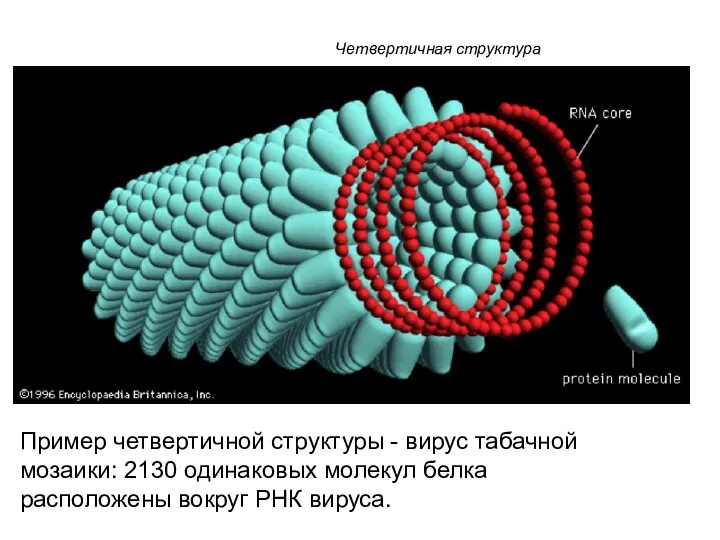
- 118. Четвертичная структура Пример четвертичной структуры - вирус табачной мозаики: 2130 одинаковых молекул белка расположены вокруг РНК
- 119. Вопросы для самоконтроля Приведите классификацию α-аминокислот в зависимости от характера радикала. Охарактеризуйте химические свойства α-аминокислот. Перечислите
- 121. Скачать презентацию











































 Геохимия природных процессов
Геохимия природных процессов Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Энергетика химических процессов. Химическая термодинамика
Энергетика химических процессов. Химическая термодинамика Алканы
Алканы Способы раскисления и модифицирования стали
Способы раскисления и модифицирования стали Ионоселективные электроды
Ионоселективные электроды План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Полисахариды. Крахмал
Полисахариды. Крахмал Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Начала органической химии
Начала органической химии Оксиды. Химические свойства оксидов
Оксиды. Химические свойства оксидов Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6)
Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6) Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс
Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс Химические и физические свойства кремния
Химические и физические свойства кремния Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Исследование процесса диффузии на примере движения частиц в жидкостях и газах
Исследование процесса диффузии на примере движения частиц в жидкостях и газах Минералы. Свойства минералов
Минералы. Свойства минералов Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов
Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов Побочная подгруппа VI группы периодической системы
Побочная подгруппа VI группы периодической системы Обчислення за хімічними рівняннями відносного виходу продукту реакції (11 клас)
Обчислення за хімічними рівняннями відносного виходу продукту реакції (11 клас) Электрометрические методы анализа ЛВ. Термографические методы
Электрометрические методы анализа ЛВ. Термографические методы Способы выражения концентрации растворов
Способы выражения концентрации растворов Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром Алкадиены (диены)
Алкадиены (диены) Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки