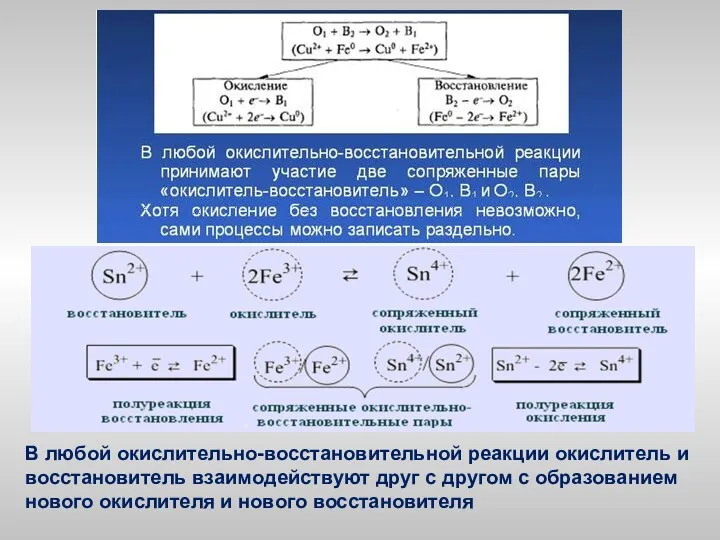
Стандартный водородный электрод
Потенциал отдельной редокс-пары измерить невозможно
Потенциал стандартного водородного электрода
принимают равным нулю
ЭДС = Е1 – Е2; Е2 = 0
ЭДС = Е1
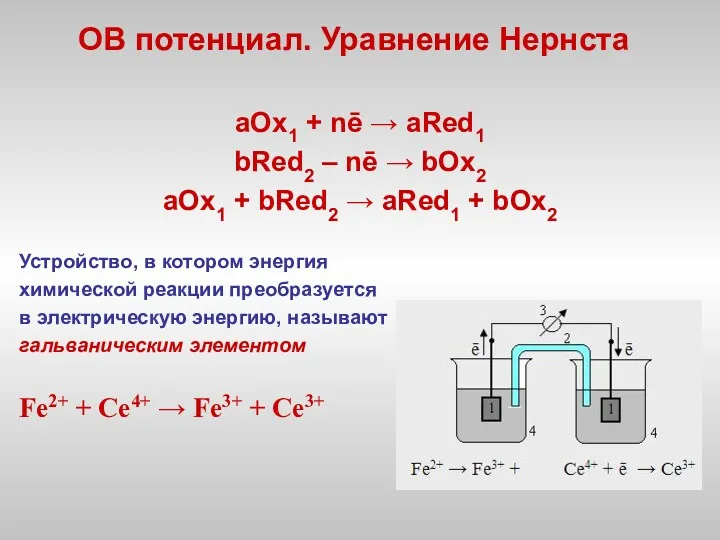
На практике для определения окислительно-восстановительного потенциала строят электрохимические цепи из некоторого стандартного электрода и электрода, на котором протекает соответствующий редокс-процесс. В водных растворах в качестве стандартного используют водородный электрод.
В такой цепи ЭДС приравнивается к значению
окислительно-восстановительного потенциала и выражается уравнением Нернста:
Немецкий физикохимик
Вальтер Нернст
(1864-1941).
Е° - стандартный электродный потенциал









 Соединения водорода
Соединения водорода Химическая промышленность
Химическая промышленность Химические свойства неорганических соединений
Химические свойства неорганических соединений Алкины — углеводороды, содержащие тройную связь между атомами углерода
Алкины — углеводороды, содержащие тройную связь между атомами углерода Арены. Бензол
Арены. Бензол Практическая работа №2. Наблюдение за горящей свечой
Практическая работа №2. Наблюдение за горящей свечой Флотационные реагенты. Активаторы
Флотационные реагенты. Активаторы Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Получение, собирание и распознавание газов. Практическая работа
Получение, собирание и распознавание газов. Практическая работа Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Химическая посуда
Химическая посуда Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Производство серной кислоты
Производство серной кислоты Химические свойста воды
Химические свойста воды Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Гидросульфит натрия (пищевая добавка Е222)
Гидросульфит натрия (пищевая добавка Е222) Гетерофункциональные производные бензольного ряда как лекарственные средства. Гетероциклические соединения. Алкалоиды
Гетерофункциональные производные бензольного ряда как лекарственные средства. Гетероциклические соединения. Алкалоиды Бром. Общие сведения
Бром. Общие сведения Эко-упаковка
Эко-упаковка Проект Получение пресной и чистой воды
Проект Получение пресной и чистой воды Строение атома
Строение атома Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Изомерия. (11 класс)
Изомерия. (11 класс) Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Алмазы. Бриллианты
Алмазы. Бриллианты Использование горюче-смазочных материалов в автотранспорте
Использование горюче-смазочных материалов в автотранспорте Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия