Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов презентация
Содержание
- 2. Что такое «размерные эффекты?» Размерный эффект – зависимость удельной характеристики (или интенсивного параметра) вещества от размера
- 3. Поверхностные свойства и термодинамика малых частиц Изменение энергии Гиббса при образовании N частиц радиуса r равно:
- 4. Закон Томсона (Кельвина). Повышенное равновесное давление над каплей жидкости. Химический потенциал вещества в газе Химический потенциал
- 5. Уравнение Гиббса-Фрейндлиха-Оствальда. Повышенная растворимость веществ. Химический потенциал вещества в растворе Химический потенциал вещества в кристаллической фазе
- 6. Термодинамический подход к описанию размерных эффектов. 1. Однокомпонентные системы. Изобарно-изотермический потенциал (энергия Гиббса) вещества описывается общим
- 7. Что такое размер частицы? Определение характерного размера частицы произвольной формы предложено А.И.Русановым для трехмерных систем: L
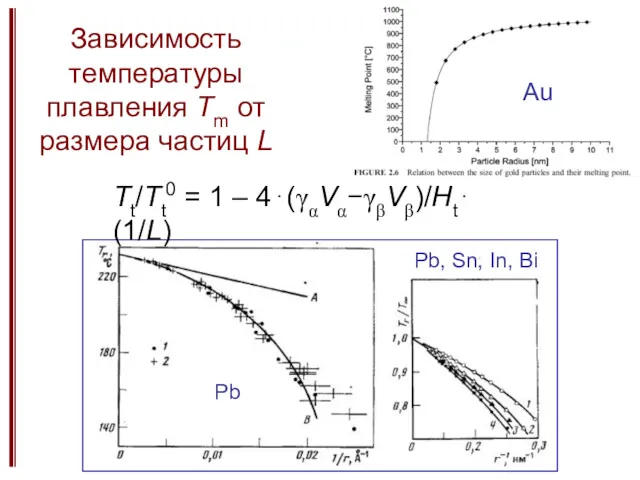
- 8. Зависимость температуры плавления Tm от размера частиц L Au Pb Pb, Sn, In, Bi Tt/Tt0 =
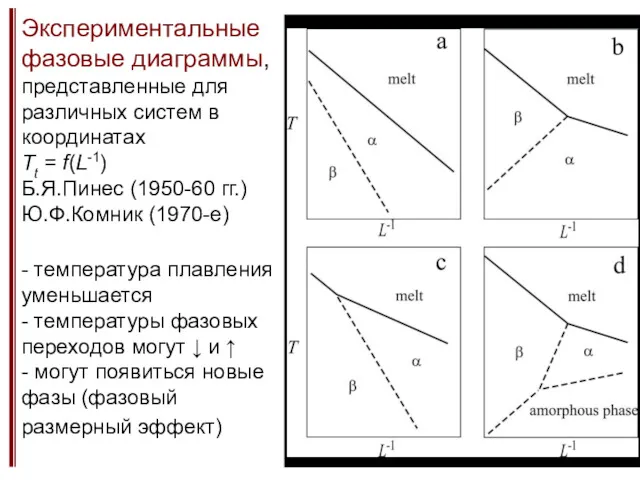
- 9. Экспериментальные фазовые диаграммы, представленные для различных систем в координатах Tt = f(L-1) Б.Я.Пинес (1950-60 гг.) Ю.Ф.Комник
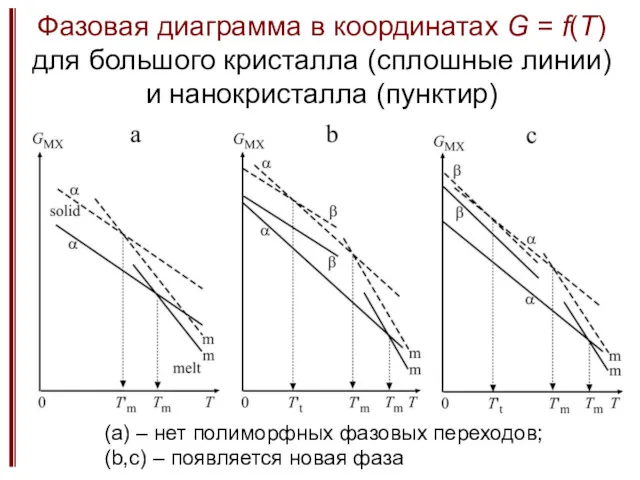
- 10. Фазовая диаграмма в координатах G = f(T) для большого кристалла (сплошные линии) и нанокристалла (пунктир) (а)
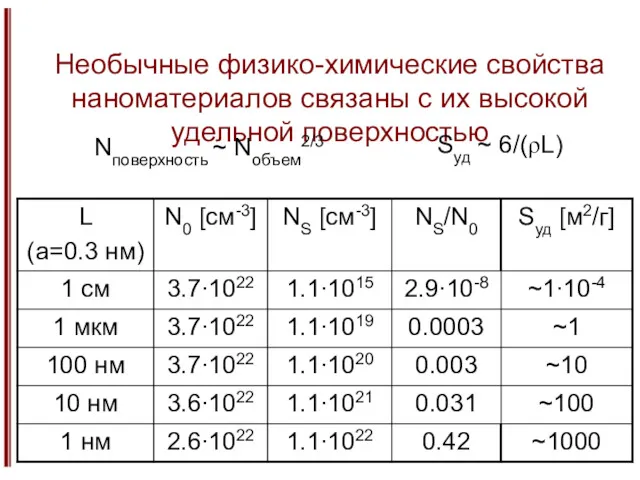
- 11. Необычные физико-химические свойства наноматериалов связаны с их высокой удельной поверхностью Nповерхность ~ Nобъем2/3 Sуд ~ 6/(ρL)
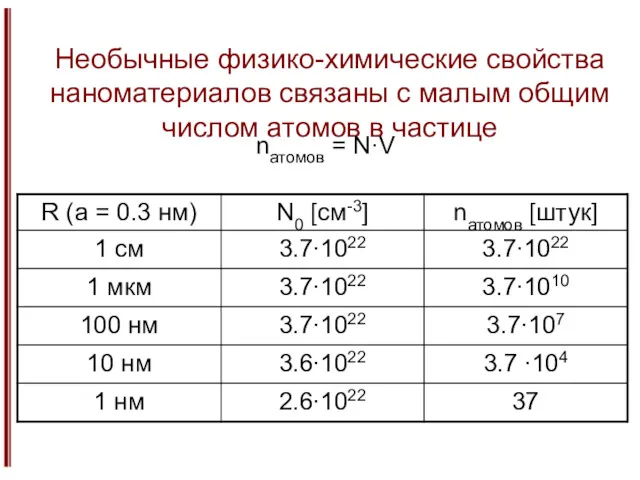
- 12. Необычные физико-химические свойства наноматериалов связаны с малым общим числом атомов в частице nатомов = N·V
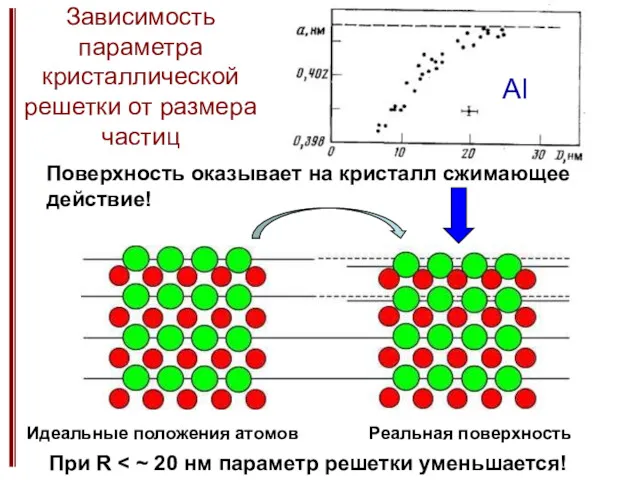
- 13. Зависимость параметра кристаллической решетки от размера частиц Pb Pb, Sn, In, Bi Поверхность оказывает на кристалл
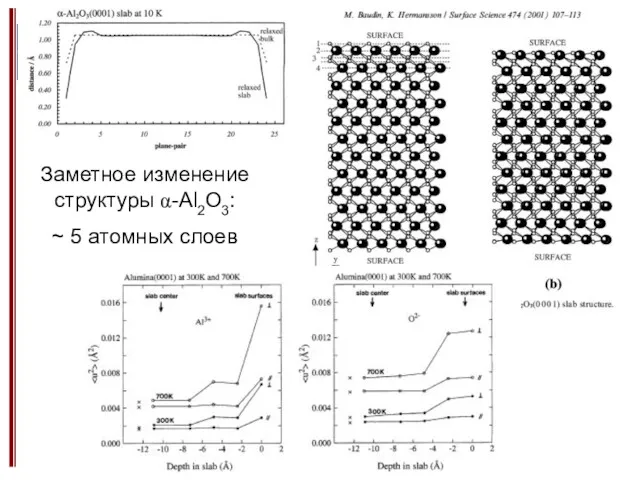
- 14. Заметное изменение структуры α-Al2O3: ~ 5 атомных слоев
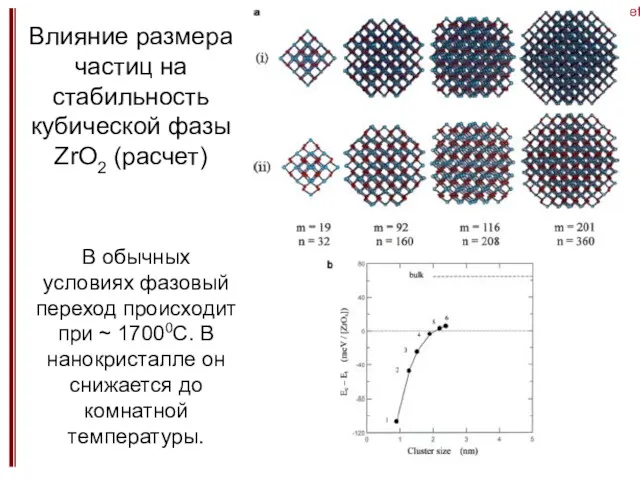
- 15. Size effect5 Влияние размера частиц на стабильность кубической фазы ZrO2 (расчет) В обычных условиях фазовый переход
- 16. Размерные эффекты в гомогенных системах: 1. «Обычные» размерные эффекты, связанные с вкладом поверхностной энергии или размерные
- 17. Нанокластеры (размер - менее 1-3 нм)
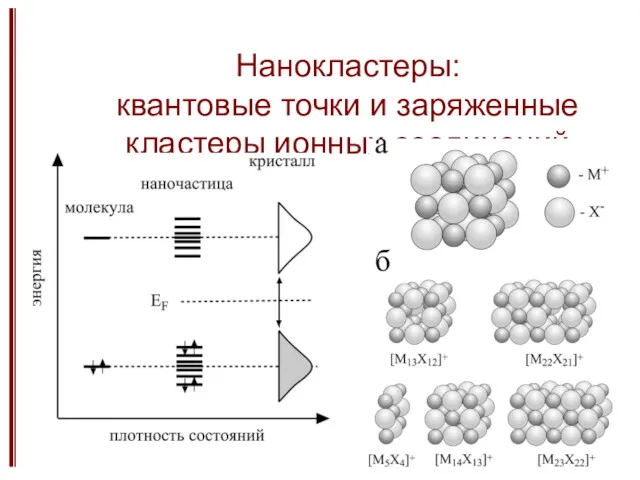
- 18. Нанокластеры: квантовые точки и заряженные кластеры ионных соединений
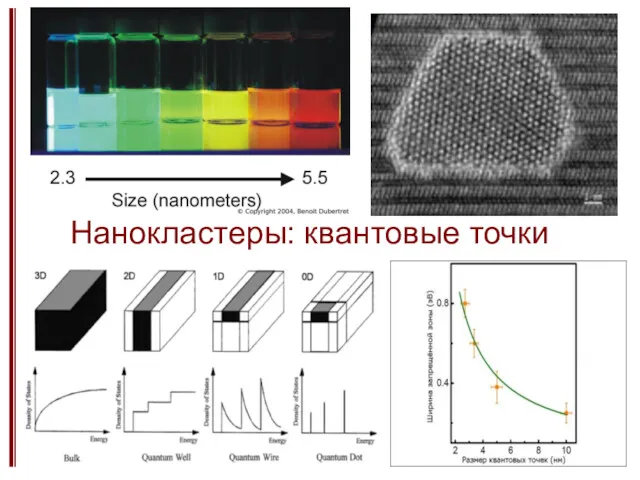
- 19. Нанокластеры: квантовые точки
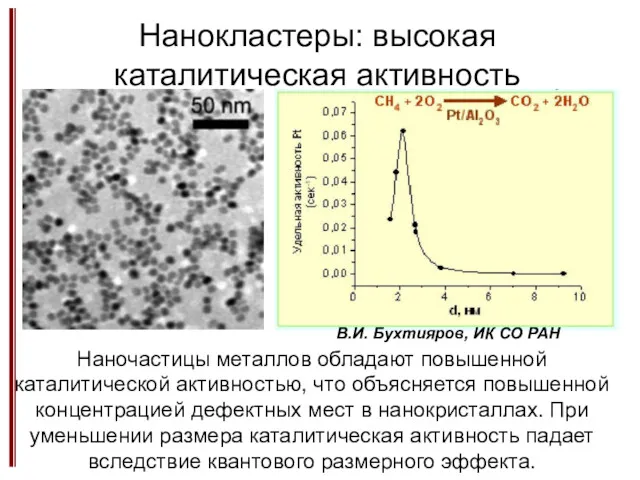
- 20. Нанокластеры: высокая каталитическая активность В.И. Бухтияров, ИК СО РАН Наночастицы металлов обладают повышенной каталитической активностью, что
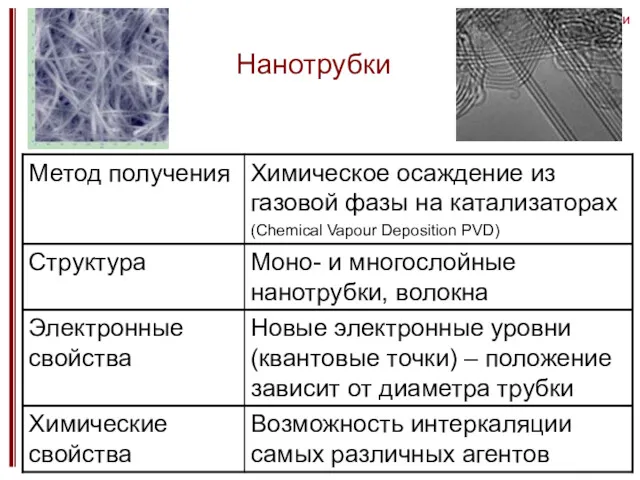
- 21. нанотрубки Нанотрубки
- 22. Нанокерамика – Плотная или пористая керамика с размером зерен менее 100 нм Нанокерамика CaF2 Размерные эффекты:
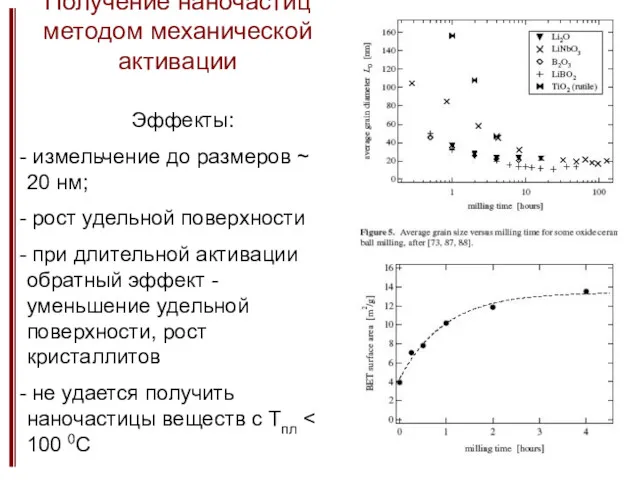
- 23. Получение наночастиц методом механической активации Эффекты: измельчение до размеров ~ 20 нм; рост удельной поверхности при
- 24. Мезопористые материалы (MMM: MCM-41, SBA-16) Синтез: осаждение из раствора с поверхностно-активной добавкой Упорядоченные поры, параметр «решетки»
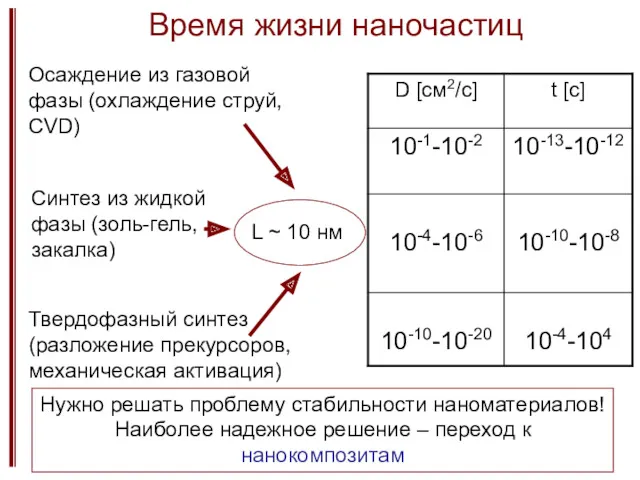
- 25. Время жизни наночастиц Твердофазный синтез (разложение прекурсоров, механическая активация) Осаждение из газовой фазы (охлаждение струй, CVD)
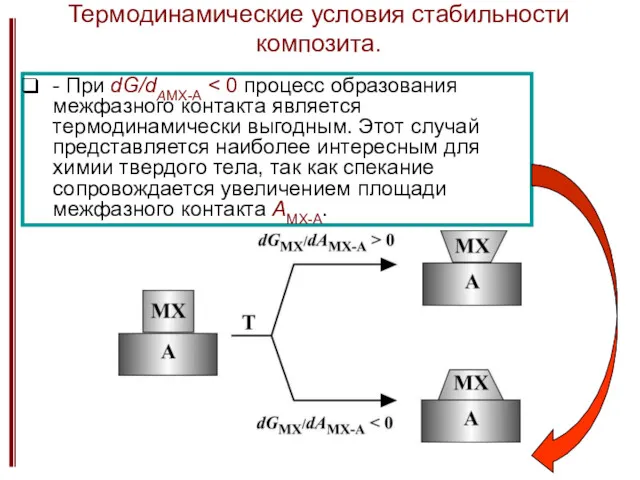
- 26. Термодинамические условия стабильности композита. - При dG/dAMX-A
- 27. Термодинамические условия стабильности композита. Выражая величину γMX-A через свободную энергию адгезии, γа: γа = γMX +
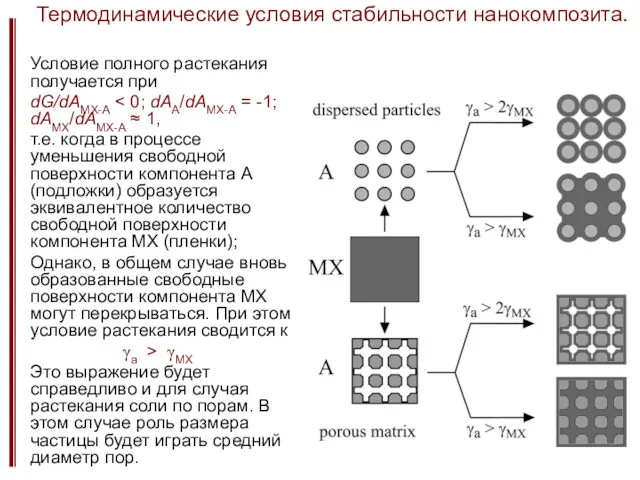
- 28. Термодинамические условия стабильности нанокомпозита. Условие полного растекания получается при dG/dAMX-A т.е. когда в процессе уменьшения свободной
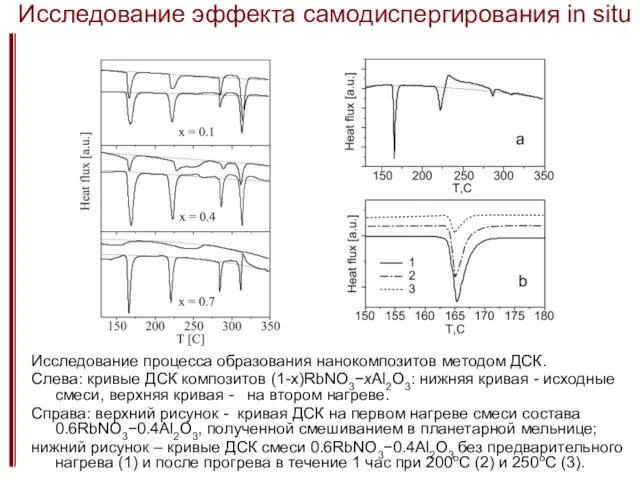
- 29. Исследование эффекта самодиспергирования in situ Исследование процесса образования нанокомпозитов методом ДСК. Слева: кривые ДСК композитов (1-x)RbNO3−xAl2O3:
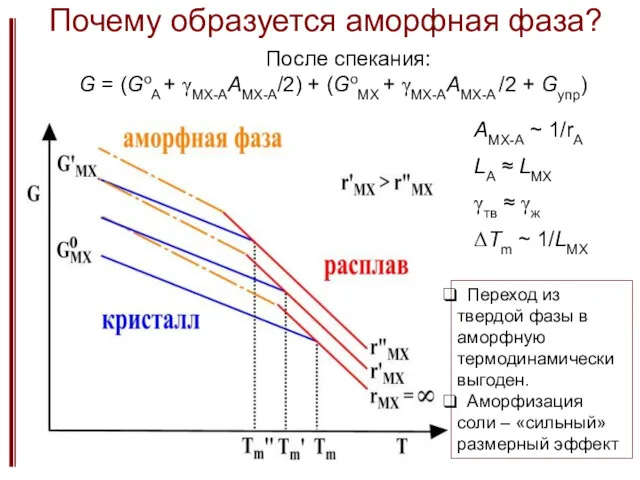
- 30. Почему образуется аморфная фаза? После спекания: G = (GoA + γMX-AAMX-A/2) + (GoMX + γMX-AAMX-A /2
- 32. Скачать презентацию











 Періодичний закон Д.І. Менделєєва. Структура періодичної системи
Періодичний закон Д.І. Менделєєва. Структура періодичної системи Химия, как часть естествознания. Предмет химии
Химия, как часть естествознания. Предмет химии Циклоалканы
Циклоалканы Водород, получение, свойства и применение
Водород, получение, свойства и применение Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов Основания. 8 класс
Основания. 8 класс Вода — это уникальное вещество
Вода — это уникальное вещество Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Альдегидтер
Альдегидтер Хромотография, явления, атомы и молекулы. 8 класс
Хромотография, явления, атомы и молекулы. 8 класс Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Алюминий и его сплавы
Алюминий и его сплавы Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Признаки химических реакций
Признаки химических реакций Строение электронных оболочек атомов
Строение электронных оболочек атомов Алифатические углеводороды. Строение, физические свойства
Алифатические углеводороды. Строение, физические свойства Кристаллическое состояние веществ
Кристаллическое состояние веществ Политетрафторэтилен
Политетрафторэтилен Коррозия металлов
Коррозия металлов Молярна маса речовини
Молярна маса речовини Химические свойства солей
Химические свойства солей Алюминий и его соединения
Алюминий и его соединения Метанол, етанол, гліцерин
Метанол, етанол, гліцерин Определение качества нефтепродуктов (на примере бензинов и дизельного топлива)
Определение качества нефтепродуктов (на примере бензинов и дизельного топлива) Типы химических реакций
Типы химических реакций