Содержание
- 2. ВІДКРИТТЯ ПЕРІОДИЧНОГО ЗАКОНУ Висновок Менделєєва: за постійного збільшення атомної маси властивості елементів періодично повторюються Дата відкриття
- 3. Властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від
- 4. Періодичний закон – один із найфундаментальніших законів природи. Йому підпорядковані всі хімічні елементи всесвіту. А оскільки
- 5. Періодичний закон Д.І. Менделєєва дав можливість пояснювати явища, в яких беруть участь хімічні елементи, та передбачати
- 6. - Д. І. Менделєєв дуже докладно описав властивості трьох ще не відкритих елементів і назвав їх
- 8. Наприкінці 1871 року Менделєєв розіслав переклад своєї роботи самим знаменитим ученим світу - і ні від
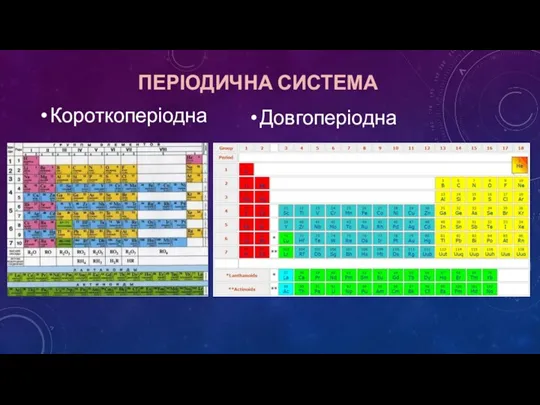
- 9. ПЕРІОДИЧНА СИСТЕМА Короткоперіодна Довгоперіодна
- 10. ПЕРІОД Твердий інертний газ Подібний до Радону =
- 11. ПЕРІОД – ГОРИЗОНТАЛЬНИЙ РЯД 1. Позначаються арабськими цифрами від 1-7 2. Малі періоди (1-3) 1 –
- 12. ГРУПА – ВЕРТИКАЛЬНИЙ СТОВПЧИК ЕЛЕМЕНТІВ , ПОДІБНИХ ЗА ВЛАСТИВОСТЯМИ ТА ФОРМУЮ ЇХ СПОЛУК. Коротка форма 1.
- 14. ДОВГА ФОРМА ПСХЕ
- 15. ПЕРЕВІРТЕ СВОЇ ЗНАННЯ: 1. Виберіть сучасне формулювання Періодичного закону А Властивості хімічних елементів і утворених ними
- 16. 2. Укажіть порядковий номер хімічного елемента Е, який належить до ІІІ періоду періодичної системи й утворює
- 17. 3. У якій групі періодичної системи (коротка форма) містяться лише металічні елементи? А ІІ. Б ІV.
- 18. 4. У періодичній системі хімічних елементів Карбон і Титан належать до: А одного періоду Б однієї
- 19. 5. Флуор, Хлор, Бром належать до: А f-елементів, Б d-елементів, В p-елементів, Г s-елементів
- 20. 6. Як розташовані хімічні елементи в періодичній системі Д. І. Менделєєва? А кожний період закінчується металічним
- 21. 7. Як змінюється склад електронної оболонки атомів хімічних елементів 3-го періоду періодичної системи Д.І. Менделєєва зі
- 22. 8. Укажіть символи хімічних елементів однієї підгрупи періодичної системи Д.І. Менделєєва. А K, Cu, Rb. Б
- 23. 9. Розташуйте хімічні елементи за зменшенням радіусів атомів. А Аl. Б Si. В С . Г
- 24. 10. Чому Сульфур і Хром розташовано в одній групі періодичної системи елементів Д.І. Менделєєва А атоми
- 25. 11. На підставі періодичного закону було виправлено: А) порядкові номери хімічних елементів; Б) назви хімічних елементів;
- 27. Скачать презентацию























 Аммиак
Аммиак Незвичайна вода
Незвичайна вода Реакции ионного обмена
Реакции ионного обмена Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії Химический элемент хлор
Химический элемент хлор Химическое равновесие и условия его смещения
Химическое равновесие и условия его смещения БАЗ-ды алу. БАЗ өндірудегі шикізат базасы. 2 Лекция
БАЗ-ды алу. БАЗ өндірудегі шикізат базасы. 2 Лекция Спирти. Загальні відомості про спирти
Спирти. Загальні відомості про спирти Геохимия природных процессов. Мономинеральный баланс рубидия в гранодиорите. (Лекция 4)
Геохимия природных процессов. Мономинеральный баланс рубидия в гранодиорите. (Лекция 4) Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Қатты оттын және оның түрлері
Қатты оттын және оның түрлері Непредельные углеводороды
Непредельные углеводороды 16_OP_05_Alkany
16_OP_05_Alkany Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері
Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері Состав, строение и свойства сырья для производства строительных материалов
Состав, строение и свойства сырья для производства строительных материалов Классификация химических элементов в географической оболочке
Классификация химических элементов в географической оболочке Растворы. Реакции ионного обмена. Гидролиз солей
Растворы. Реакции ионного обмена. Гидролиз солей Щелочные металлы. (9 класс)
Щелочные металлы. (9 класс) Respiration Module
Respiration Module 20230306_vodorod_ego_fizicheskie_svoystva
20230306_vodorod_ego_fizicheskie_svoystva Применение алканов
Применение алканов Классификация и свойства оксидов
Классификация и свойства оксидов Уравнения химических реакций
Уравнения химических реакций Правила техники безопасности при работе в кабинете химии
Правила техники безопасности при работе в кабинете химии Интоксикация ртутью
Интоксикация ртутью Порівняльний аналіз методів відновлення свинцево-кислотних акумуляторів
Порівняльний аналіз методів відновлення свинцево-кислотних акумуляторів Диссоциация электролитов
Диссоциация электролитов Валентность. Определение валентности по формулам. Химия. 8 класс
Валентность. Определение валентности по формулам. Химия. 8 класс