Содержание
- 2. Сильные и слабые электролиты Константа и степень диссоциации
- 3. Электролитами называют вещества, растворы или расплавы которых проводят электрический ток. Переносчиками тока в растворах электролитов являются
- 4. По способности к диссоциации все вещества делятся на две группы: сильные электролиты, которые в растворе диссоциированы
- 5. В растворах слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами и ионами: НСN ↔ Н+ +
- 6. Константа диссоциации электролита не зависит от концентрации раствора, но зависит от его температуры, а также от
- 7. Количественной характеристикой способности электролита распадаться на ионы является степень диссоциации – α. Степенью диссоциации электролита называется
- 8. Степень диссоциации электролита в 0,1 н. растворе принимают в качестве критерия для отнесения электролита к группе
- 9. Применительно к водным растворам сильными электролитами являются: cильные кислоты: HCI, HBr, НJ, НNO3, H2SO4, HCIO4; cильные
- 10. К слабым электролитам относятся: слабые кислоты: H2CO3, H2S, CH3COOH, H3PO4, и большинство органических веществ; cлабые основания
- 11. В случае электролита KА, диссоциирующего на ионы K+ и A-, константа и степень диссоциации связаны соотношением
- 12. Если степень диссоциации значительно меньше единицы, то при приближенных вычислениях можно принять, что 1 - α
- 15. 2. Способность выделять водород при взаимодействии с активными металлами (Zn, Fe, Mg, AI и др.). 3.
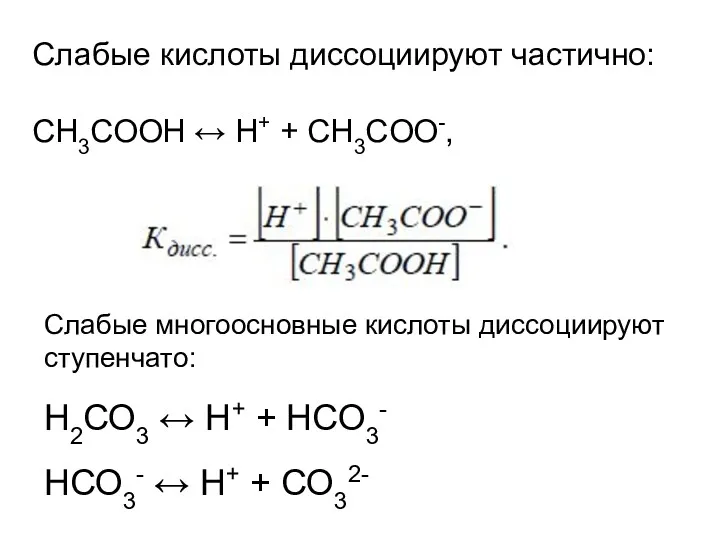
- 16. Слабые кислоты диссоциируют частично: СН3СООH ↔ H+ + CH3COO-, Слабые многоосновные кислоты диссоциируют ступенчато: Н2СО3 ↔
- 17. Наличие в молекулах оснований гидроксид-ионов обусловливают следующие общие свойства этих соединений: 1. способность взаимодействовать с кислотами
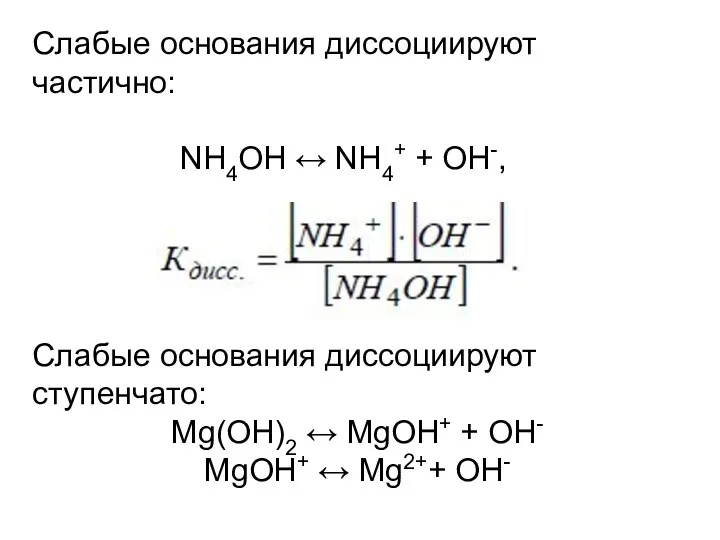
- 18. Слабые основания диссоциируют ступенчато: Mg(ОН)2 ↔ MgОН+ + ОН- MgОН+ ↔ Mg2++ OH- Слабые основания диссоциируют
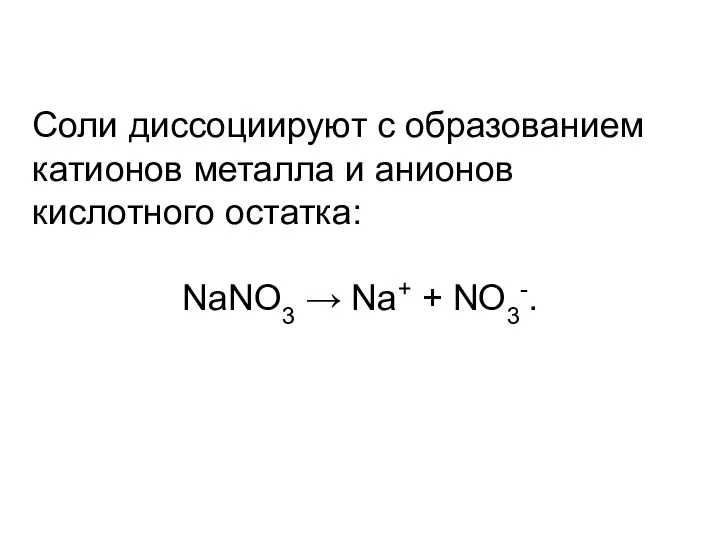
- 19. Соли диссоциируют с образованием катионов металла и анионов кислотного остатка: NaNO3 → Na+ + NO3-.
- 20. Реакции обмена в растворах электролитов
- 21. Уравнения реакций обмена обычно записывают в молекулярной и ионно-молекулярной формах. Молекулярная форма уравнения показывает, какие вещества
- 22. Ионно-молекулярная форма уравнения позволяет определить возможность превращения и его причины, которые сводятся к образованию малорастворимого либо
- 23. В виде ионов записывают формулы сильных электролитов. В виде молекул записывают формулы воды, слабых электролитов, малорастворимых
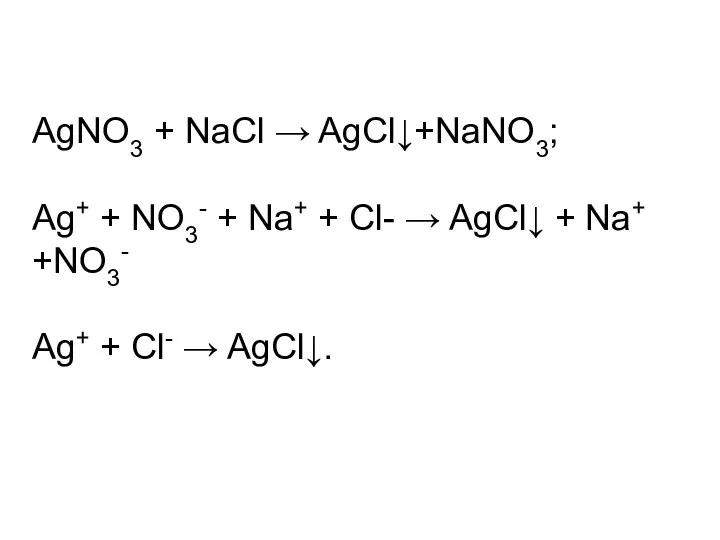
- 24. AgNO3 + NaCl → AgCl↓+NaNO3; Ag+ + NO3- + Na+ + Cl- → AgCl↓ + Na+
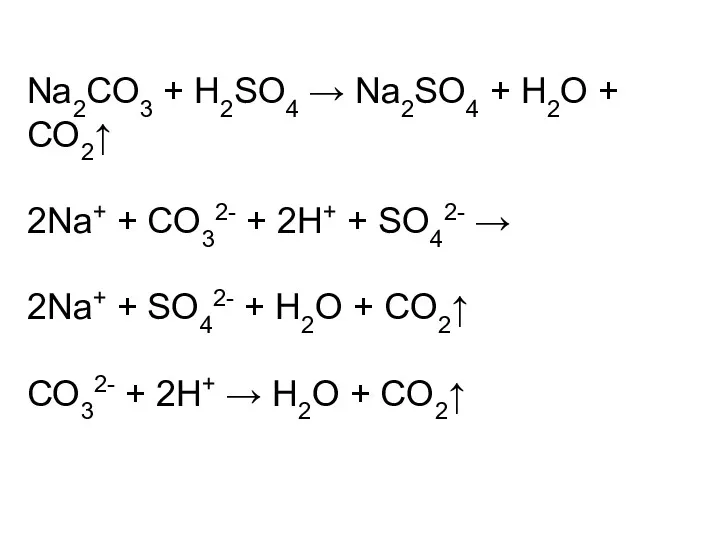
- 25. Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑ 2Na+ + CO32- + 2H+ + SO42-
- 26. NaOH + HCl → NaCl + H2O Na+ + OH- + H+ + Cl- → Na+
- 27. Смещение равновесий в растворах слабых электролитов
- 28. В растворах слабых электролитов устанавливается динамическое равновесие между недиссоциированными молекулами и образовавшимися в результате диссоциации ионами.
- 29. 2) увеличение концентрации одноименных ионов будет подавлять диссоциацию, равновесие сместится в сторону образования недиссоциированных молекул. Например:
- 30. Величина Кдисс при данной температуре -постоянная, поэтому увеличение концентрации ацетат-ионов [CH3COO-] должно привести к уменьшению концентрации
- 31. Произведение растворимости
- 32. В системе, состоящей из осадка малорастворимого электролита и насыщенного раствора над ним, устанавливается динамическое равновесие: Men
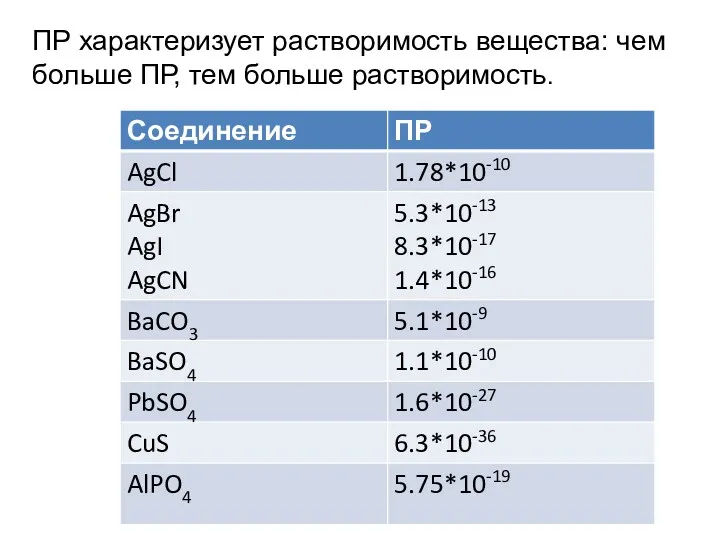
- 33. Произведение концентраций [Mem+]n·[Xn-]m представляет собой постоянную величину, называемую произведением растворимости (ПР). Например: ПР(AgCl) = [Ag+]·[Cl-], ПР(Bi2S3)
- 34. Если произведение концентраций ионов такого электролита в растворе превышает величину его ПР, то образуется осадок. Если
- 35. ПР характеризует растворимость вещества: чем больше ПР, тем больше растворимость.
- 36. Н3РО4 – ортофосфорная кислота, обычно называют просто фосфорной кислотой. Это твердое бесцветное кристаллическое вещество, плавится при
- 37. Н3РО4↔ Н+ + Н2РО4- (Кд=10-3) Н2РО4- -дигидрофосфат-ион, NaН2РО4 - дигидрофосфат натрия, Ca(Н2РО4)2 - дигидрофосфат кальция
- 38. Н2РО4-↔ Н+ + НРО42- (Кд=10-8) НРО42- - гидрофосфат-ион, K2НРО4– гидрофосфат калия, MgНРО4 -гидрофосфат магния
- 39. НРО42-↔ Н+ + РО43- (Кд=10-12) РО43- - фосфат-ион, Li3РО4- фосфат лития, Ca3(PO4)2 – фосфат кальция.
- 40. Фосфорная кислота проявляет свойства типичные для всех кислот, т.е. изменяет окраску индикатора, взаимодействует с основаниями и
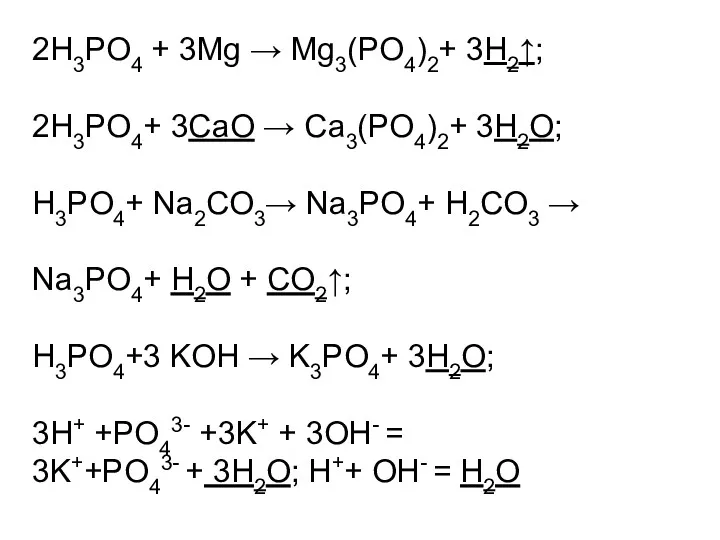
- 41. 2Н3РО4 + 3Мg → Mg3(РO4)2+ 3H2↑; 2H3РO4+ 3СаO → Са3(РO4)2+ 3H2O; H3РO4+ Na2CO3→ Na3РO4+ H2CO3 →
- 42. H3РO4+ KOH → KН2РO4+ H2O, Во всех этих реакциях при избытке кислоты образуются кислые соли. Следует
- 43. Специфической реакцией иона РO43- (т.е. кислоты и всех ее солей) является реакция с солями серебра. Ее
- 44. Получение: обычно из природных фосфатов, обрабатывают их серной кислотой, отфильтровывают и выпаривают. Са3(РO4)2 +H2SO4→СaSO4 ↓+ H3РO4
- 46. Скачать презентацию



















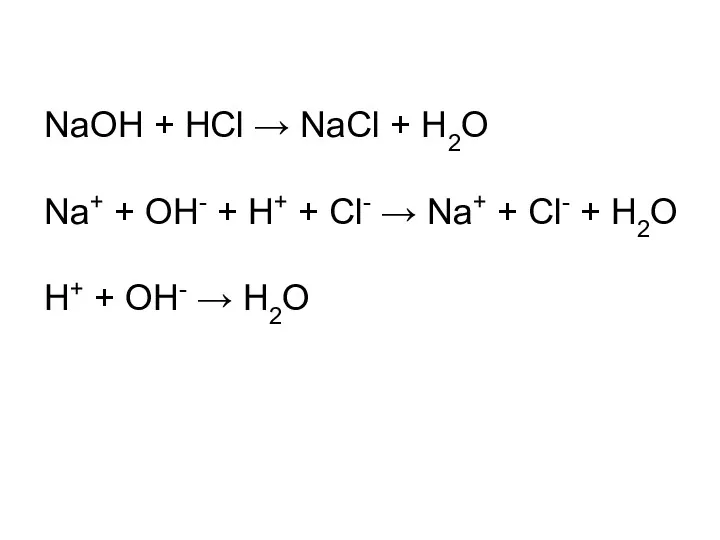






![Произведение концентраций [Mem+]n·[Xn-]m представляет собой постоянную величину, называемую произведением растворимости](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/227004/slide-32.jpg)









 Вещества и тела. Состояния веществ. Смеси
Вещества и тела. Состояния веществ. Смеси Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Теория электролитической диссоциации
Теория электролитической диссоциации Строение атома и периодический закон
Строение атома и периодический закон Минерал родонит. Месторождения
Минерал родонит. Месторождения Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Химия p-элементов
Химия p-элементов Цинк и его соединения
Цинк и его соединения Полисахаридтер – жоғары молекулалық көмірсулар
Полисахаридтер – жоғары молекулалық көмірсулар Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций Химия. 9 класс
Химия. 9 класс Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Алкандар. (қаныққан көмірсутектер. Парафиндер.)
Алкандар. (қаныққан көмірсутектер. Парафиндер.) Гель-хроматография. Бумажная хроматография
Гель-хроматография. Бумажная хроматография Минералы и их свойства
Минералы и их свойства Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Реакции электрофильного замещения в ароматическом ряду Se
Реакции электрофильного замещения в ароматическом ряду Se Химические реакции
Химические реакции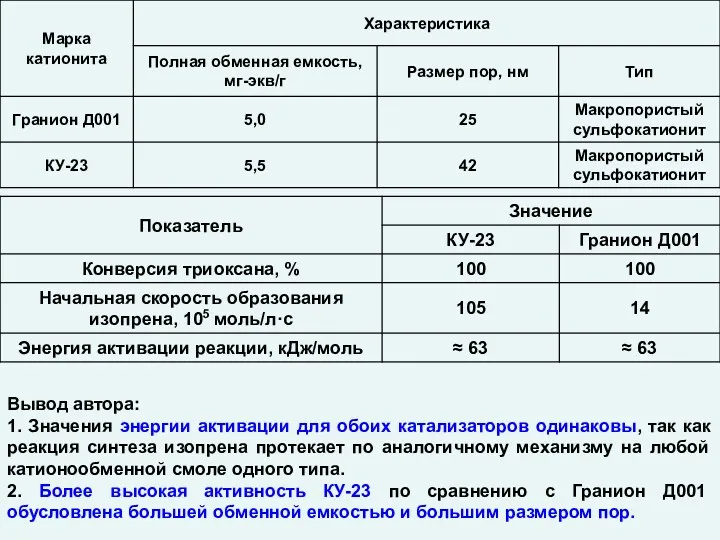 Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Галогены в природе. Хлор, бром, иод
Галогены в природе. Хлор, бром, иод Материаловедение. Придание металлам и сплавам заданных свойств
Материаловедение. Придание металлам и сплавам заданных свойств Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів
Основні поняття матеріального балансу. Розрахунок об’єму повітря та продуктів згоряння при горінні речовин та матеріалів Композиты и композиционные материалы
Композиты и композиционные материалы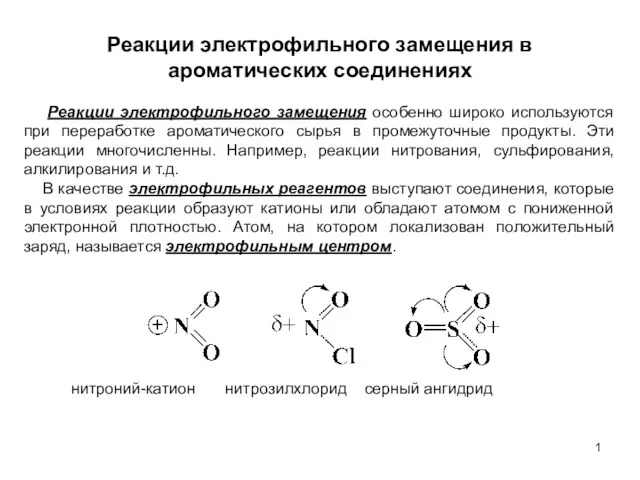 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Предмет физической и коллоидной химии. Термодинамика
Предмет физической и коллоидной химии. Термодинамика