При рабочих температурах процесса (750 – 850°С) платина взаимодействует с кислородом
образуя летучий оксид PtO2, кроме того, допускается (предполагается) механический отрыв частиц платины с поверхности катализатора.
Наличие в составе катализатора родия снижает, но полностью не подавляет унос платины; для ее улавливания предложено, например, использовать слой из огнеупорных оксидов металлов (CaO)
или
сетку на основе сплава Pd, размещаемую непосредственно за сеткой катализатора. В последнем случае платина стабилизируется на палладиевой сетке за счет образования сплава Pd-Pt [Calvin H. Bartholomew Mechanisms of catalyst deactivation // Applied Catalysis A: General 212 (2001)]
Cудя по приведенным в открытых публикациях данным (июль 2010 года), минимальные потери платины обеспечивает комбинированный процесс (dual-pressure process) в котором на стадии окисления аммиака давление составляет 4 – 6, а на стадии абсорбции оксидов азота 10 – 12 атм. В этом случае унос (primary losses) платины составляет 0,13 г, а безвозвратные потери 0,03 г на 1 тонну азотной кислоты [Nitric Acid, ThyssenKrupp, 07.2010, http://www.uhde.eu/fileadmin/documents/brochures/uhde_brochures_pdf_de_4.pdf]
Исходя из мирового производства азотной кислоты на уровне 50 млн тонн в год, при получении азотной кислоты ежегодно человечество теряет порядка 1,5 тонн платины.
21

























 Edexcel organic reaction mechanisms
Edexcel organic reaction mechanisms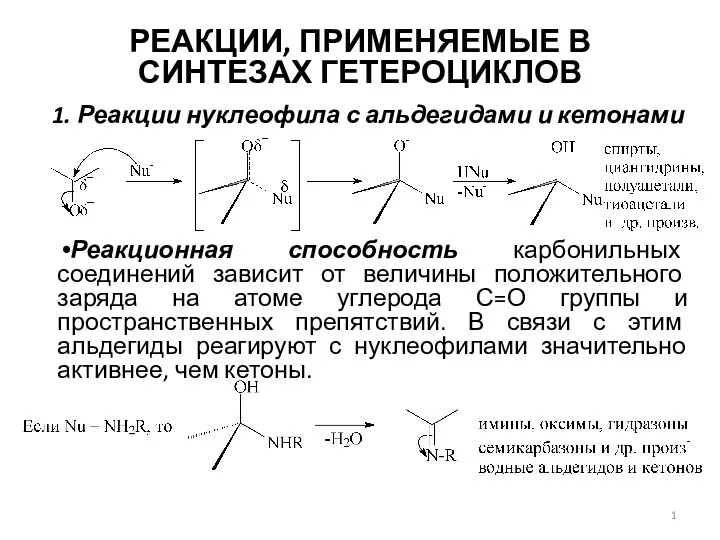 Реакции, применяемые в синтезах гетероциклов
Реакции, применяемые в синтезах гетероциклов Неметаллы. Азот
Неметаллы. Азот Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении
Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Электролиз – ОВ процесс
Электролиз – ОВ процесс Нитраттарды қолдану
Нитраттарды қолдану Углеводы. 10 класс
Углеводы. 10 класс Токсикология пестицидов
Токсикология пестицидов Некоторые d-элементы
Некоторые d-элементы Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Элемент цинк
Элемент цинк Кто хочет стать химиком
Кто хочет стать химиком Элементы IV А - группы
Элементы IV А - группы Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Использование кубового остатка ректификации стирола в процессах получения нефтяных дорожных битумов
Использование кубового остатка ректификации стирола в процессах получения нефтяных дорожных битумов Количественный анализ. Титриметрический анализ
Количественный анализ. Титриметрический анализ Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2 Водород - топливо будущего
Водород - топливо будущего Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Кафедра химической технологии лекарственных веществ (ХТЛВ)
Кафедра химической технологии лекарственных веществ (ХТЛВ) Углерод
Углерод Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Кевлар. Структура кевлара
Кевлар. Структура кевлара Концентраційні межі поширення полум'я. Лекція 7
Концентраційні межі поширення полум'я. Лекція 7