Содержание
- 2. Электролиз – ОВ процесс, протекающий при прохожде-нии постоянного электричес-кого тока через раствор или расплав электролита.
- 3. Электролизная система состоит из: электролизер (электролитическая ванна), электроды (инертные или активные), электролит (раствор или расплав), источник
- 4. Катод – электрод, подключенный к «–» полюсу внешнего источника тока, на нем идут процессы восстановления. Анод
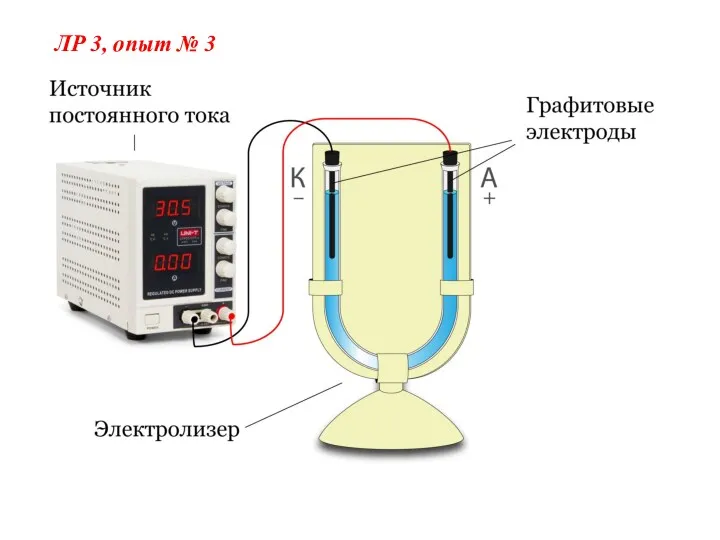
- 5. ЛР 3, опыт № 3
- 6. При отсутствии внешнего электрического поля ионы находятся в беспорядочном движении. При прохождении постоянного электрического тока через
- 7. Характер протекания электродных процессов при электролизе зависит от: состава электролита; pH среды; концентрации ионов электролита; материала
- 8. Электролиз растворов электролитов В процессах на электродах могут участвовать частицы вещества, молекулы или ионы воды. ПРАВИЛА
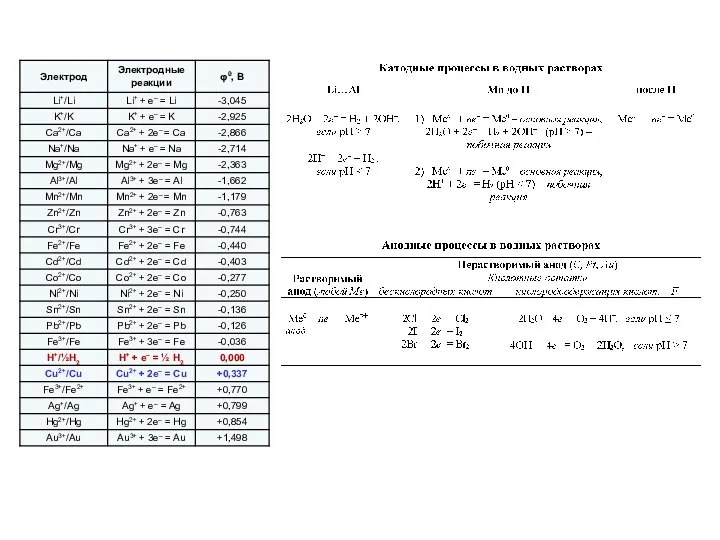
- 9. 3. Катионы малоактивных Ме, расположенные в ряду напряжений после Н , восстанавливаются. Примечание: Если в р-ре
- 10. Анодные процессы: Характер анодных процессов определяется материалом анода. При использовании активного анода (любой Ме, кроме Au
- 11. При использовании инертного анода на нем идут процессы окисления. 1. Простые анионы (Сl–, I–, Br–, S2–)
- 13. !!! Катодный процесс: зависит только от активности катиона металла. Анодный процесс: зависит в первую очередь от
- 14. При записи схемы электролиза указывается материал электродов, заряды электродов. Отрицательный электрод (катод) принято изображать слева, положительный
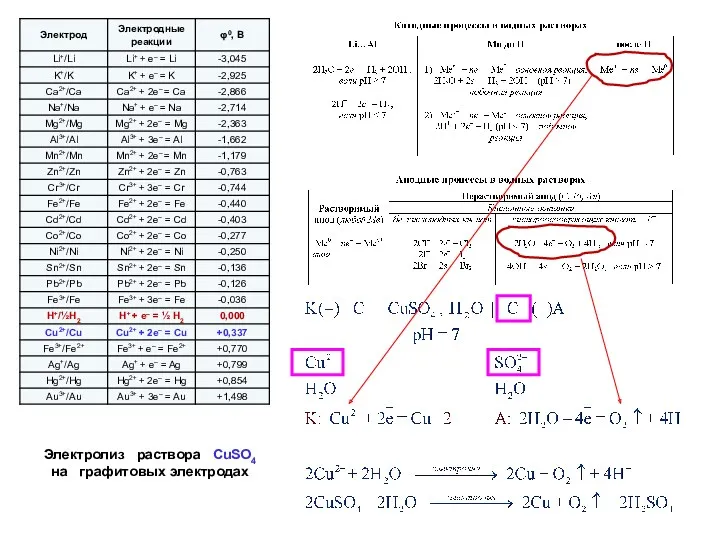
- 16. Электролиз раствора СuSO4 на графитовых электродах
- 17. Электролиз раствора СuSO4 на инертных (графитовых) электродах:
- 18. Электролиз раствора NaCl на инертных (графитовых) электродах: Что изменится: K(–) Zn│NaCl, H2O│C (+)А ?
- 19. В результате реакций, идущих у электродов, возможно изменение pH раствора у этих электродов: Этот факт используется
- 20. Электролиз NaCl На катоде выделяется газ Н2 и образуется щелочь NaОН. Увеличение СОН_ обусловило изменение окраски
- 21. Электролиз раствора Na2SO4 на инертных (платиновых) электродах:
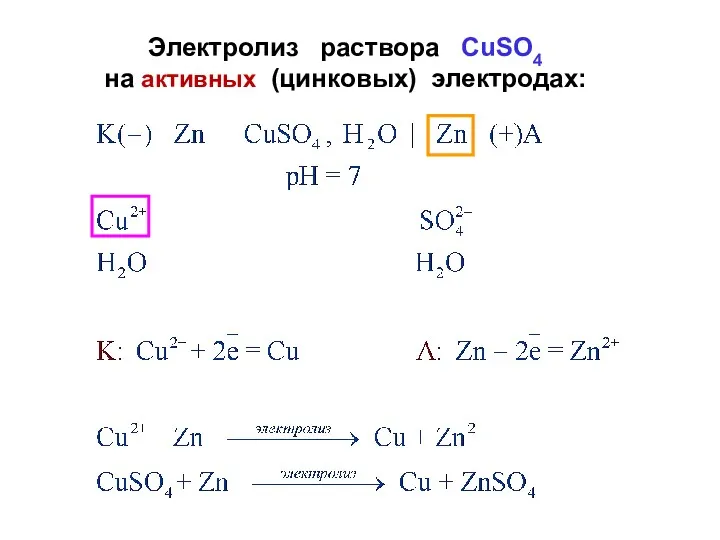
- 22. Электролиз раствора СuSO4 на активных (цинковых) электродах:
- 23. Электролиз раствора NaCl на активных (цинковых) электродах:
- 24. Электролиз раствора Na2SO4 на активных (цинковых) электродах:
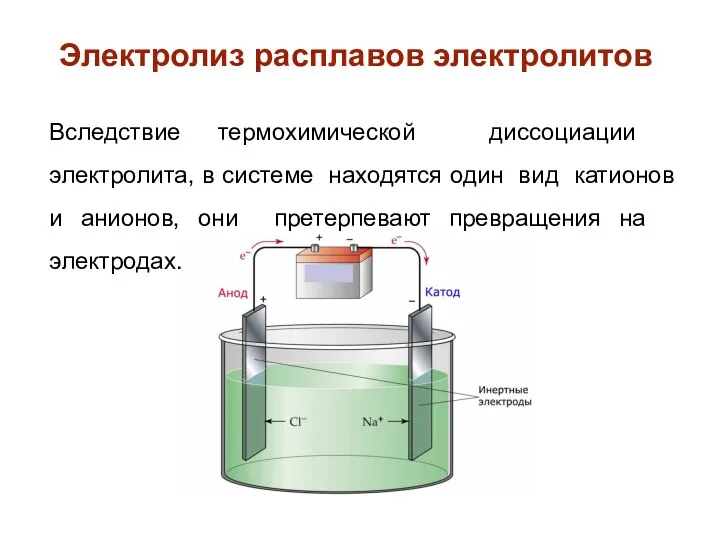
- 25. Электролиз расплавов электролитов Вследствие термохимической диссоциации электролита, в системе находятся один вид катионов и анионов, они
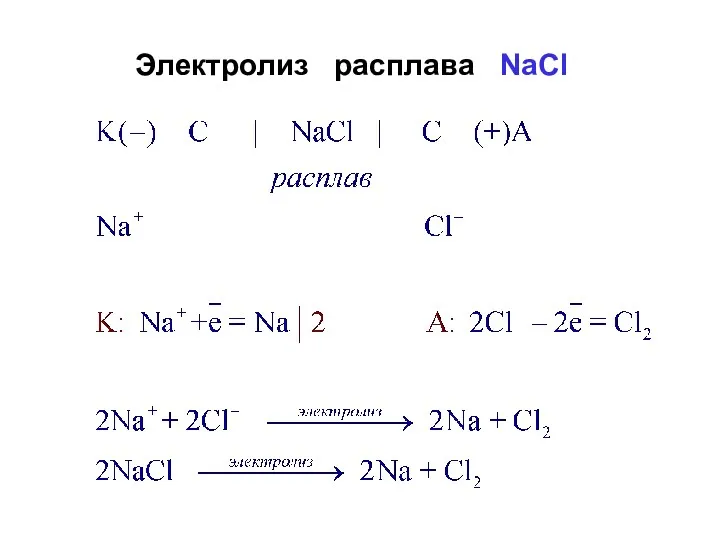
- 26. Электролиз расплава NaCl
- 27. Количественные характерис-тики процессов электролиза устанавливаются законами Фарадея: I закон Фарадея; II закон Фарадея.
- 28. I закон Фарадея Масса или объём вещества, претерпевшего изменение на электродах, прямо пропорциональна количеству прошедшего через
- 29. II закон Фарадея При прохождении одинакового количества электричества через растворы (расплавы) электролитов массы (объемы) выделяющихся веществ
- 30. Следствия из II закона Фарадея: При прохождении через электролит количества электричества Q=F масса превращенного вещества m=Э
- 31. Количество вещества эквивалента nэ (или число эквивалентов в-ва) определяется: Из II закона Фарадея получаем: nэ1 =
- 32. Пример. При электролизе раствора AgNO3 на аноде выделилось 0,28 л O2. Сколько серебра выделилось на катоде
- 33. Массы выделившихся при электролизе веществ зависят от количества прошедшего электричества и эквивалентов этих веществ и не
- 34. Выход по току Вт Показателем эффективности электролиза является величина выхода по току: Qпракт > Qтеор из-за
- 35. В реальных электролизных системах накопление продуктов электролиза на электродах изменяет их природу и величину электродных потенциалов
- 36. Для преодоления поляризации на электроды извне подается избыточное напряжение, называемое перенапряжением (η – «эта»): ηk –
- 37. Минимальная разность потенциалов, при которой процесс электролиза становится возможным, называется ЭДС разложения электролита (Еразл):
- 38. ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА 1. Электрохимическое производство химических продуктов: получение Сl2 и NaOH (электролиз водного р-ра NaCl); получение
- 39. 3. Гальванотехника: гальваностегия – нанесение Ме-х покрытий; гальванопластика – получение изделий путем электролиза. 4. Электрохимическая обработка
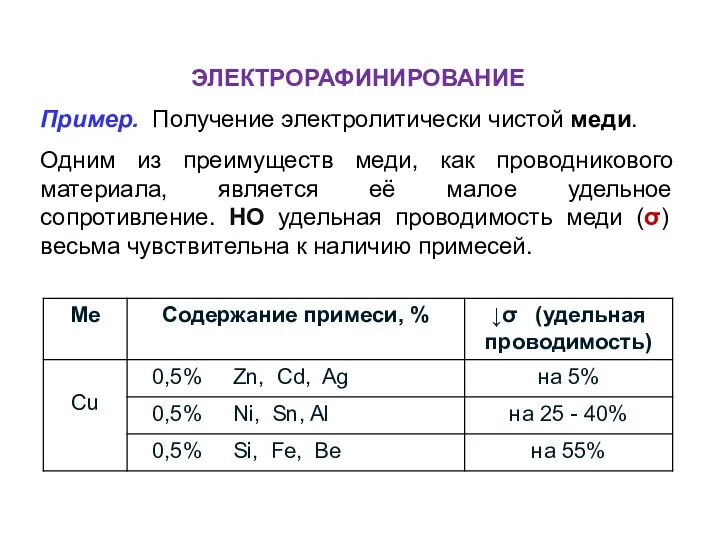
- 40. ЭЛЕКТРОРАФИНИРОВАНИЕ Пример. Получение электролитически чистой меди. Одним из преимуществ меди, как проводникового материала, является её малое
- 41. K(–) Cu ⎪ CuSO4, H2O ⎪ Cu ( Fe, Pb, Ag ) (+)А ↓ ↓ (чистая
- 43. Скачать презентацию

































 Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация)
Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация) 20230802_stroenie_atoma_avtosohranennyy_2
20230802_stroenie_atoma_avtosohranennyy_2 Методы очистки натрия от примесей
Методы очистки натрия от примесей Алюминий
Алюминий Количество вещества. Моль
Количество вещества. Моль Одноатомные и многоатомные спирты
Одноатомные и многоатомные спирты Окислительно-востановительные реакции в растворах
Окислительно-востановительные реакции в растворах Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения
Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения Ионные уравнения
Ионные уравнения Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Химияның негізгі стехиометриялық заңдары
Химияның негізгі стехиометриялық заңдары VIIА группа: галогены
VIIА группа: галогены Периодическая таблица химических элементов
Периодическая таблица химических элементов Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Цинк и его соединения
Цинк и его соединения Гибкость цепи полимеров
Гибкость цепи полимеров Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов The structure and properties of the nitrogen and ammonia molecules. Industrial production of nitrogen fertilizers (topic 4.4)
The structure and properties of the nitrogen and ammonia molecules. Industrial production of nitrogen fertilizers (topic 4.4) Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері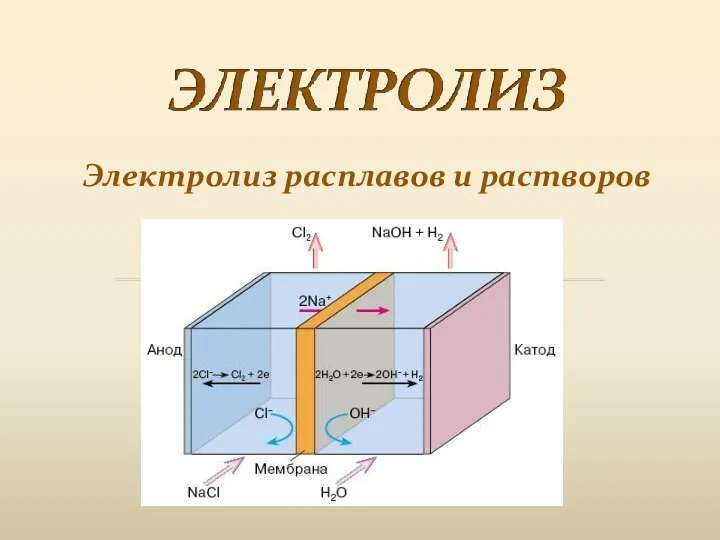 Электролиз расплавов и растворов
Электролиз расплавов и растворов Процессы проявления и фиксирования
Процессы проявления и фиксирования Жидкие вещества
Жидкие вещества Определение химического элемента на основании расчетов по химическим реакциям
Определение химического элемента на основании расчетов по химическим реакциям Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Р-элементы IV Группы Периодической Системы
Р-элементы IV Группы Периодической Системы