Содержание
- 2. Ранние модели строения атома «Пудинг с изюмом» (1902-1904 г. Дж. Томсон) «Планетарная» (1907 г. Э. Резерфорд)
- 3. Современная модель атома Атом – электронейтральная частица Ядро атома – положительно заряженное Электроны – отрицательно заряженные
- 4. Состав ядра атома Протоны. Масса = 1, заряд = +1 Нейтроны. Масса = 1, заряд =
- 5. Изотопы Изотопы – совокупность атомов, имеющих одинаковое число протонов, но различающихся количеством нейтронов в ядре атома.
- 6. Частицы микромира Корпускулярно-волновой дуализм Электрон – частица с массой m1= 9*10-28, скорость 108 см/сек, заряд -1
- 7. Важные понятия Электронное облако – пространство около ядра атома, где сосредоточены вся масса электрона и электронная
- 8. Квантовые числа Квантовые числа описывают состояние электрона в атоме n – главное квантовое число, хар-т общую
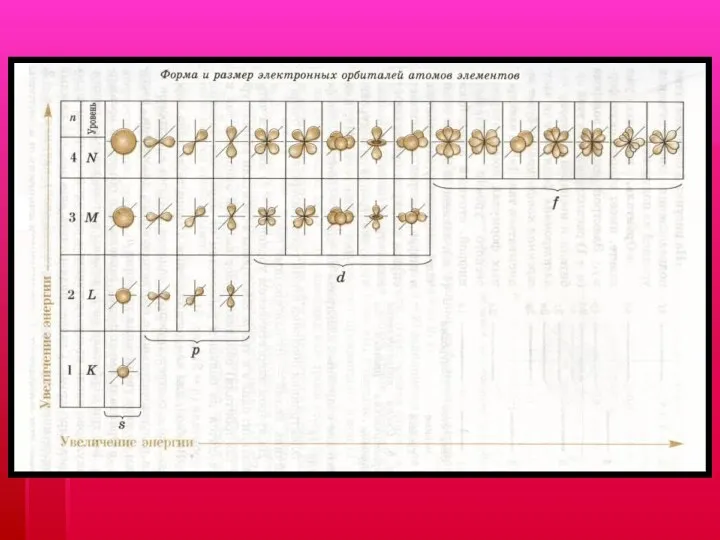
- 9. Квантовые числа l – побочное квантовое число; отражает разное энергетическое состояние электрона, определяет форму орбитали, соответствует
- 11. Квантовые числа m1 – магнитное орбитальное квантовое число Характеризует ориентацию орбитали в пространстве S-подуровень имеет 1
- 12. Квантовые числа ms – магнитное спиновое квантовое число характеризует чисто квантовое свойство электрона Это собственный момент
- 13. Принципы заполнения электронных оболочек принцип Паули правило Хунда принцип минимальной энергии или правило Клечковского
- 14. принцип Паули в атоме не может быть двух электронов с одинаковыми значениями всех квантовых чисел
- 15. правило Хунда В пределах подуровня электроны располагаются таким образом, чтобы суммарное магнитное спиновое число было максимальным
- 16. Правило Клечковского В атоме каждый электрон располагается так, чтобы его энергия была минимальной Этот принцип справдлив
- 17. Порядок заполнения подуровней 1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f, 5d,6p,7s,5f,6d,7p ит.д. D-подуровень впервые заполняется у элементов 4 периода начиная со скандия
- 18. Электронные семейства s-элементы, если заполняется s-подуровень p-элементы, если заполняется p-подуровень d-элементы, если заполняется d-подуровень f-элементы, если
- 19. Электронная формула Электронная формула атома химического элемента показывает как распределяются электроны в атоме, учитывая их характеистику
- 20. «Провал» электрона У некоторых d-элементов электрон с s-подуровня внешнего энергетического уровня переходит на d-подуровень предвнешнего энергетического
- 21. Задание Определить элемент: Составить электронные и электронно-графические формулы элемента:
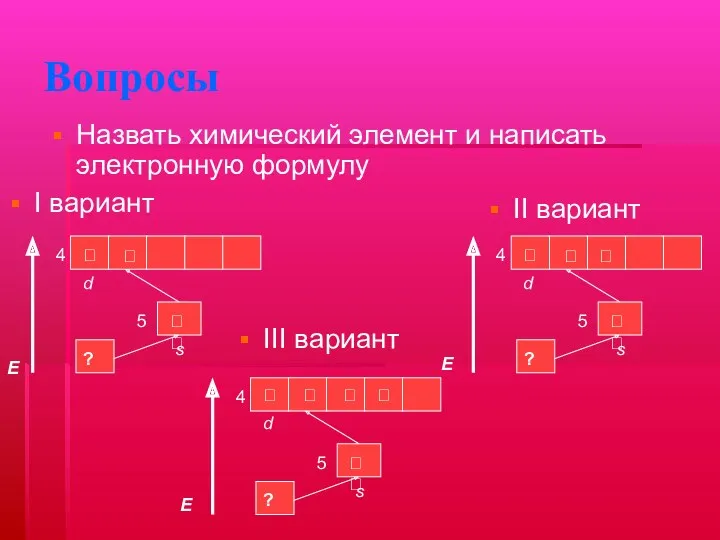
- 22. Вопросы I вариант Назвать химический элемент и написать электронную формулу III вариант
- 24. Скачать презентацию



















 Превращение веществ. Роль химии в жизни человека
Превращение веществ. Роль химии в жизни человека Природные каменные материалы. (Лекция 3)
Природные каменные материалы. (Лекция 3) Химия өнеркәсібі
Химия өнеркәсібі Алкандар. (қаныққан көмірсутектер. Парафиндер.)
Алкандар. (қаныққан көмірсутектер. Парафиндер.) Электролитическая диссоциация
Электролитическая диссоциация Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Сутектік көрсеткіш ph. Тұздар гидролизі
Сутектік көрсеткіш ph. Тұздар гидролизі Основания. Формула сильной кислоты
Основания. Формула сильной кислоты Минералы
Минералы Природные источники углеводородов
Природные источники углеводородов Молярный объем газов
Молярный объем газов Визитка химического элемента. Водород
Визитка химического элемента. Водород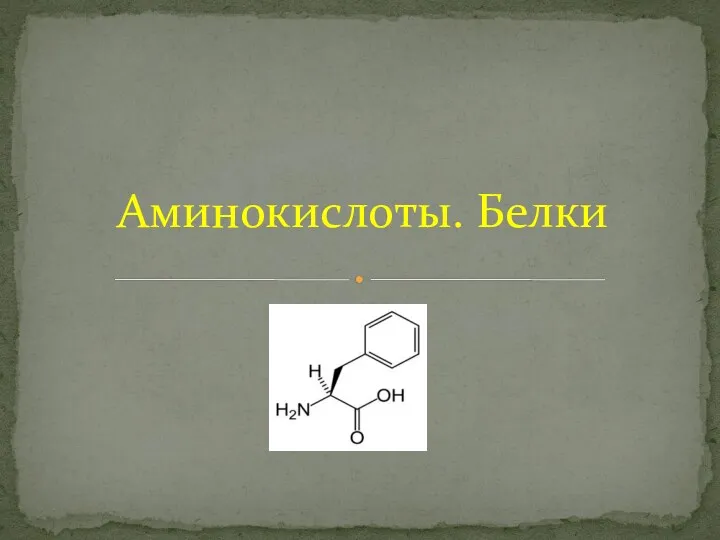 Аминокислоты. Белки
Аминокислоты. Белки Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Многоатомные спирты
Многоатомные спирты Типы химических реакций в органической химии
Типы химических реакций в органической химии Коррозия и методы борьбы с ней
Коррозия и методы борьбы с ней Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Неметаллические и композиционные материалы
Неметаллические и композиционные материалы Кислород. Распространение кислорода в природе (8 класс)
Кислород. Распространение кислорода в природе (8 класс) Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс) Химический процесс. Практические занятия
Химический процесс. Практические занятия Стехиометрия и классификация твердых веществ
Стехиометрия и классификация твердых веществ Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Тайна мыльного пузыря
Тайна мыльного пузыря Алюминий и его соединения
Алюминий и его соединения