Слайд 2

Положение
в Периодической системе
Алюминий располагается в 3 периоде, в главной подгруппе
3 группы.
Порядковый номер элемента – 13
Относительная атомная масса – 27
Алюминий – металл, соединения которого обладают амфотерными свойствами.
Слайд 3

Строение атома алюминия
Заряд ядра атома алюминия +13
В атоме 3 энергетических уровня
Электронная
оболочка атома алюминия содержит
s- и p-электроны
На внешнем электронном уровне 3 электрона (2 – спаренных s-электрона и 1 – неспаренный p-электрон)
Слайд 4

Нахождение в природе
По распространенности в земной коре алюминий занимает 3-е место после
кислорода и кремния среди всех атомов и 1-е место — среди металлов. Встречается только в составе соединений.
Слайд 5

Получение алюминия
Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825
году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы.
AlCl3 + 3K = 3KCl + Al
В настоящее время алюминий получают электролизом оксида:
эл.ток
2Al2O3 = 4Al + 3O2 – 3352 кДж
Слайд 6

Физические свойства
плотность (при 20°С) 2698,9 кг/м3;
tпл 660,24°С;
tкип около 2500°С;
Алюминий
сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопровод-ность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость, обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии).
На воздухе алюминий покрывается тонкой, но очень прочной пленкой оксида Al2О3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства.
Слайд 7

Химические свойства
Окисляется на воздухе:
4Al + 3O2 = 2Al2O3
4 Al0 - 3ē
→ Al+3 окисление, восстановитель
3 O20 + 4ē → 2O-2 восстановление, окислитель
Вытесняет водород из воды
2Al + 6H2O = 2Al(OH)3 + 3H2↑
4 Al0 - 3ē → Al+3 окисление, восстановитель
3 2H+1 + 2ē → H20 восстановление, окислитель
Слайд 8

Химические свойства
Взаимодействует с кислотами:
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al +
6H+ + 6Cl- = 2Al3+ + 6Cl-+ 3H2↑
2Al + 6H+ = 2Al3+ + 3H2↑
Взаимодействует со щелочами:
2Al + 2H2O + 2NaOH = 2NaAlO2 + 3H2↑
2Al + 2H2O + 2Na+ + 2OH- = 2Na+ + 2AlO2- + 3H2↑
2Al + 2H2O + 2OH- = 2AlO2- + 3H2↑
Слайд 9

Химические свойства
Вытесняет металлы из их оксидов
(алюминотермия):
8Al + 3Fe3O4 = 9Fe +
4Al2O3
8 Al0 - 3ē → Al+3 – окисление, восстановитель
3 24 Fe+2 + 2ē → Fe0 – восстановление, ок-ль
3 2Fe+3 + 6ē → 2Fe0 – восстановление, ок-ль
Слайд 10

Соединения алюминия. Оксид
Очень твердый порошок белого цвета.
Образуется:
а) при окислении или горении
алюминия:
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии:
2Al + Fe2O3 = 2Fe + Al2O3
в) при термическом разложении гидроксида:
2Al(OH)3 = Al2O3 + H2O
Слайд 11

Химические свойства
оксида алюминия
Al2O3 по характеру амфотерный оксид.
Взаимодействует:
а) с кислотами:
Al2O3 +
3H2SO4 = Al2(SO4)3 + 3H2O
Al2O3 + 6H+ + 3SO42- = 2Al3+ + 3SO42- + 3H2O
Al2O3 + 6H+ = 2Al3+ + 3H2O
б) со щелочами:
Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O
Al2O3 + 6Na+ + 6OH- = 6Na+ + 2AlO33- + 3H2O
Al2O3 + 6OH- = 2AlO33- + 3H2O
Слайд 12

Гидроксид алюминия
Белый нерастворимый в воде порошок
Проявляет амфотерные свойства.
Взаимодействует:
а) с кислотами:
Al(OH)3 +
3HNO3 = Al(NO3)3 + 3H2O
Al(OH)3 + 3H+ + 3NO3- = Al3+ + 3NO3- + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
б) со щелочами:
Al(OH)3 + 3KOH = K3AlO3 + 3H2O
Al(OH)3 + 3K+ + 3OH- = 3K+ + AlO33- + 3H2O
Al(OH)3 + 3OH- = AlO33- + 3H2O











 Основные интермедиаты в органических реакциях. Часть 1
Основные интермедиаты в органических реакциях. Часть 1 Цветные металлы
Цветные металлы Көмірсулар. Моносахаридтер. Жіктелуі. Гексозалар. Құрылысы
Көмірсулар. Моносахаридтер. Жіктелуі. Гексозалар. Құрылысы Л3. Учение о растворах (Химия)
Л3. Учение о растворах (Химия) Олигомеризация олефинов
Олигомеризация олефинов D-элементы VII-В группы. Марганец
D-элементы VII-В группы. Марганец Алкадиены (диены)
Алкадиены (диены) Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар Серная кислота и её свойства
Серная кислота и её свойства Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Занимательные опыты в качественном анализе
Занимательные опыты в качественном анализе Способи очищення води
Способи очищення води Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Сахароза
Сахароза Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Химические реакции в растворах электролитов. Обобщение и систематизация знаний
Химические реакции в растворах электролитов. Обобщение и систематизация знаний Органические и неорганические кислоты
Органические и неорганические кислоты БАЗ синтездеудің химиялық технологиясы Синтетикалық түсінік
БАЗ синтездеудің химиялық технологиясы Синтетикалық түсінік Фосфор и его соединения. Электронные формулы атома фосфора
Фосфор и его соединения. Электронные формулы атома фосфора Механизм и закономерности кристаллизации металлов
Механизм и закономерности кристаллизации металлов Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Активационный анализ
Активационный анализ Тема 7-Карбоновые кислоты
Тема 7-Карбоновые кислоты Переработка нефти. (10 класс)
Переработка нефти. (10 класс) Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения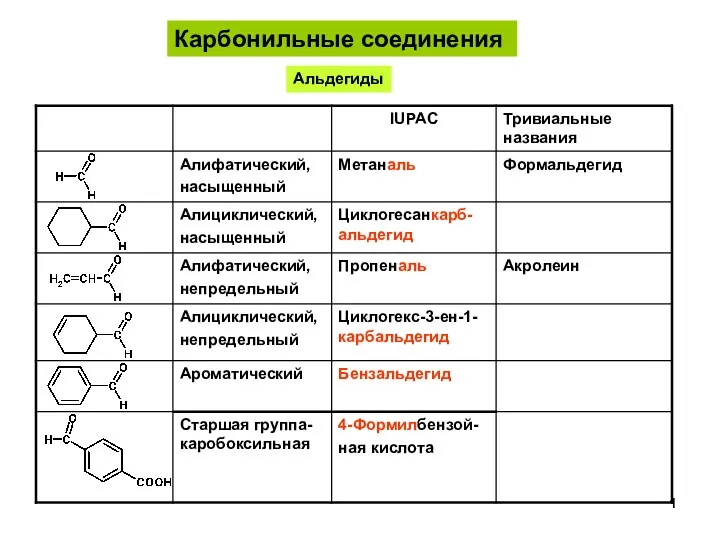 АльдегидыКетоны-1
АльдегидыКетоны-1 Алканы: общая формула, состав, гомологический ряд
Алканы: общая формула, состав, гомологический ряд