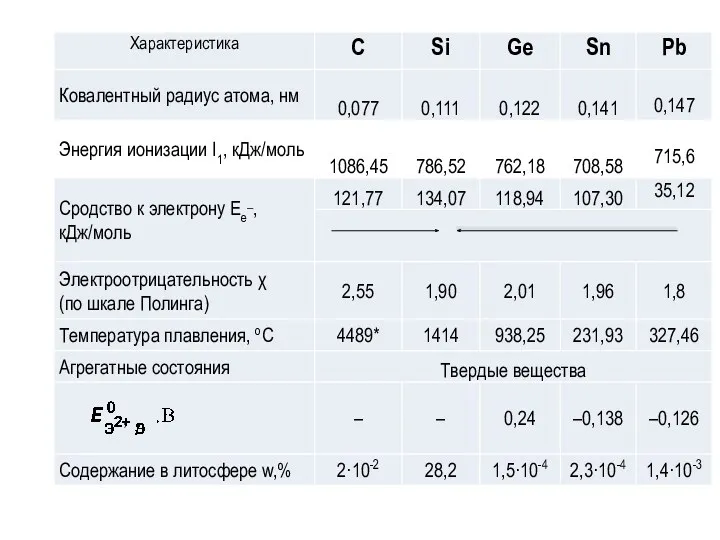
Содержание
- 3. Элементы IVА-группы Неметаллы Амфотерные элементы
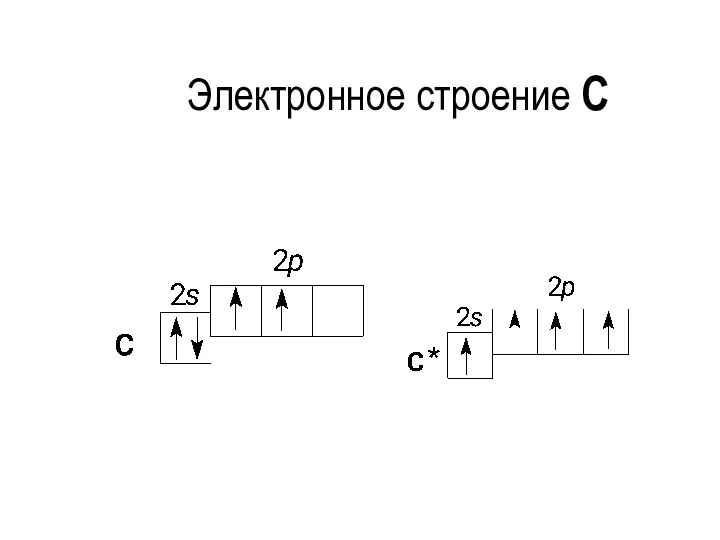
- 4. Электронное строение С
- 5. Общая электронная формула валентных электронов: […] ns 2 np2 Валентные возможности: С: макс. 4; Si, Ge,
- 6. Углерод: графит, алмаз, каменный уголь, нефть, природный газ, орг. в-ва, карбонаты
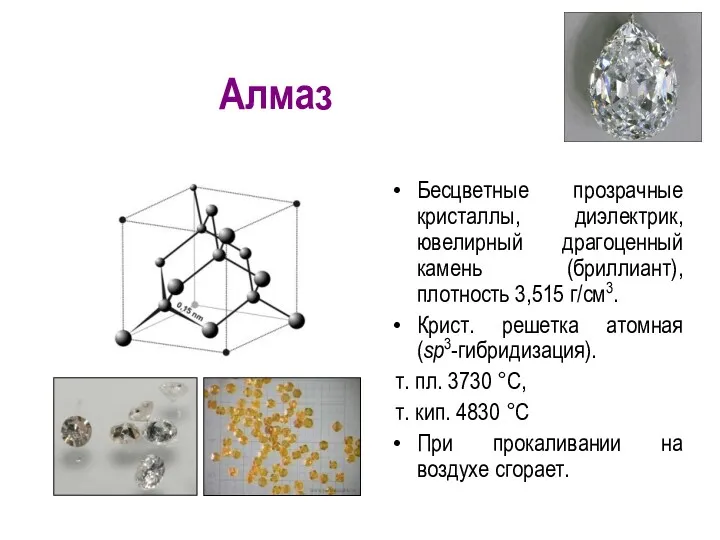
- 7. Алмаз Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3,515 г/см3. Крист. решетка атомная (sp3-гибридизация).
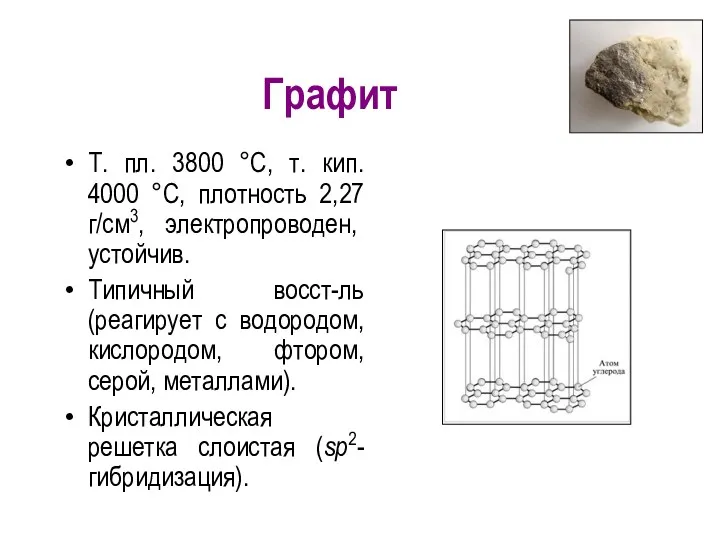
- 8. Графит Т. пл. 3800 °С, т. кип. 4000 °С, плотность 2,27 г/см3, электропроводен, устойчив. Типичный восст-ль
- 9. Карбин линейные макромолекулы, бесцветен и прозрачен, полупроводник; плотность 3,27 г/см3; выше 2300 °С переходит в графит.
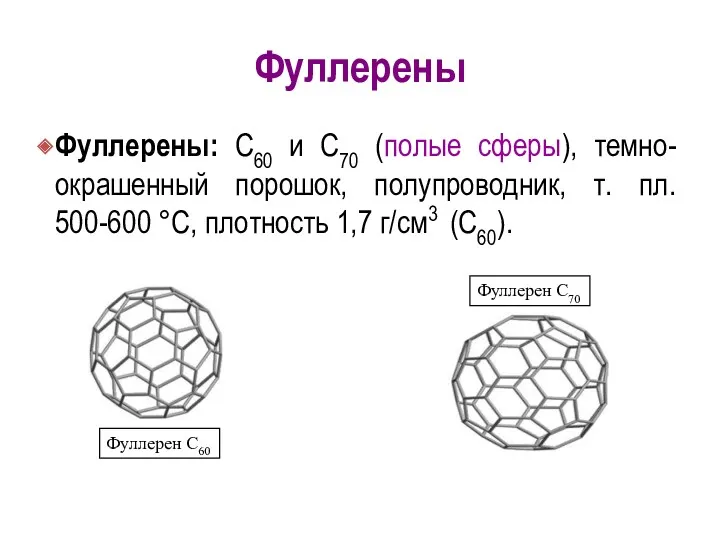
- 10. Фуллерены Фуллерены: С60 и С70 (полые сферы), темно-окрашенный порошок, полупроводник, т. пл. 500-600 °C, плотность 1,7
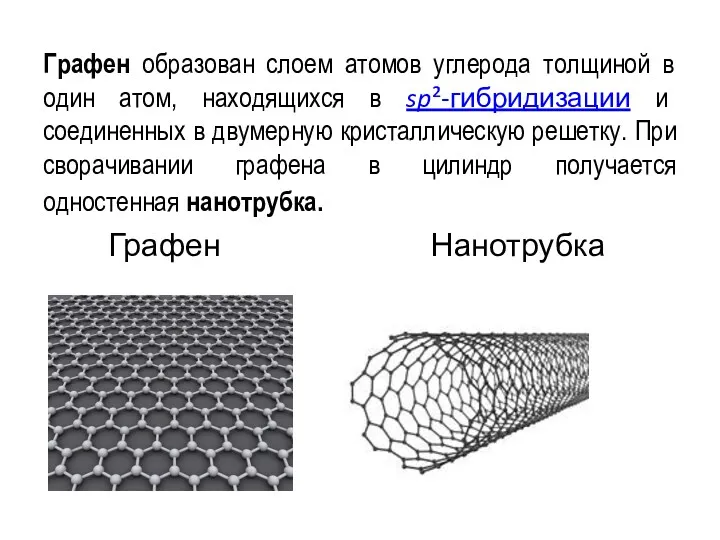
- 11. Графен образован слоем атомов углерода толщиной в один атом, находящихся в sp²-гибридизации и соединенных в двумерную
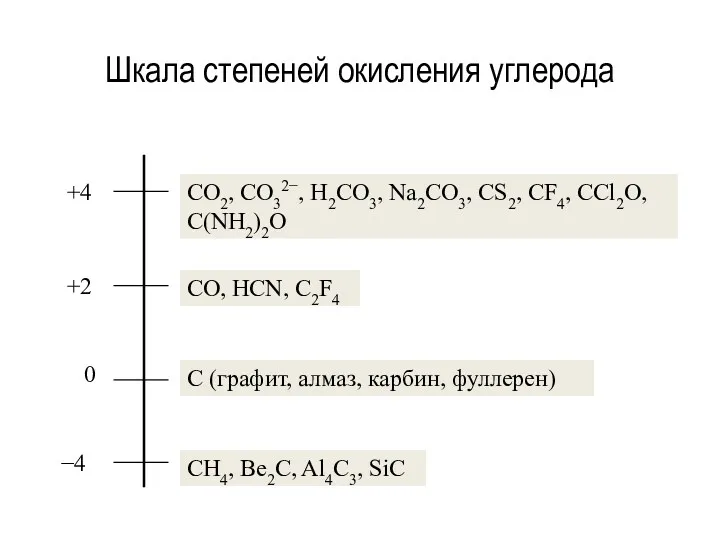
- 12. Шкала степеней окисления углерода CO2, CO32−, H2CO3, Na2CO3, CS2, CF4, CCl2O, C(NH2)2O CO, HCN, C2F4 C
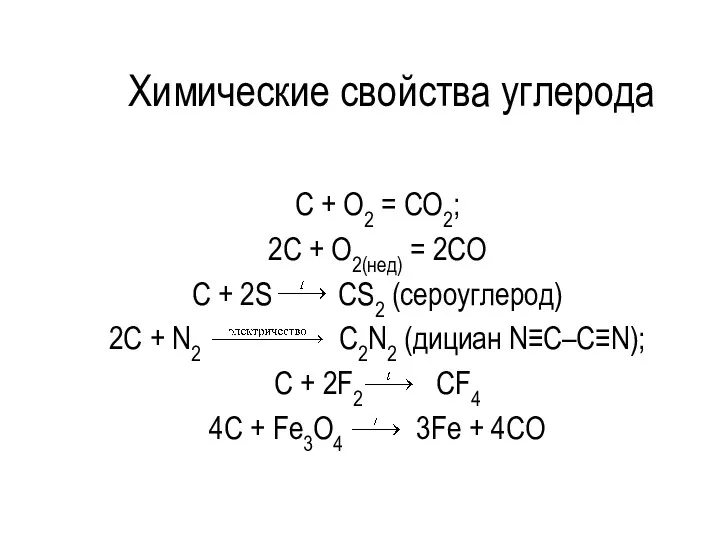
- 13. Химические свойства углерода C + O2 = CO2; 2C + O2(нед) = 2CO C + 2S
- 14. Химические свойства углерода Восстановление кремния из оксида: 2C + SiO2 Si + 2CO. Получение водяного газа:
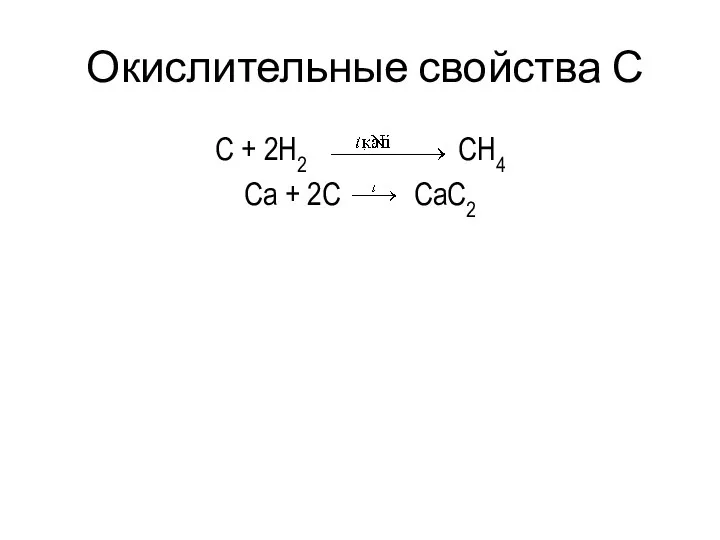
- 15. Окислительные свойства С C + 2H2 CH4 Ca + 2C CaC2
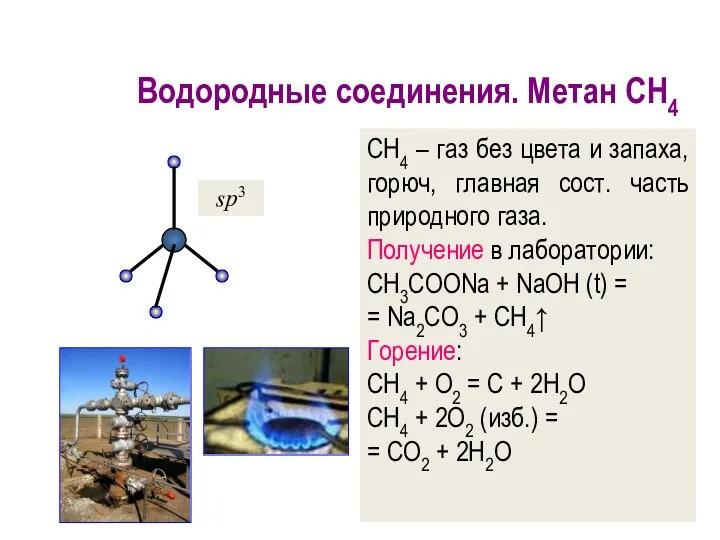
- 16. Водородные соединения. Метан CH4 СН4 – газ без цвета и запаха, горюч, главная сост. часть природного
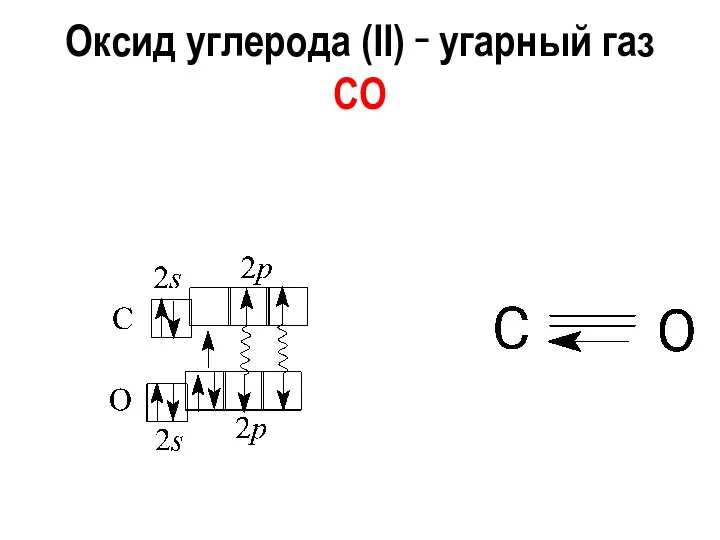
- 17. Оксид углерода (II) ‑ угарный газ CO
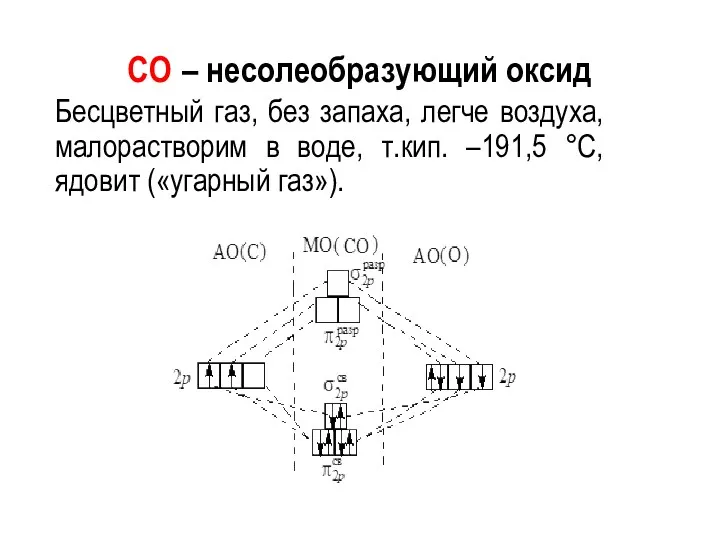
- 18. CO – несолеобразующий оксид Бесцветный газ, без запаха, легче воздуха, малорастворим в воде, т.кип. –191,5 °С,
- 19. Оксид углерода(II) CO Донорные свойства: CO образует прочные комплексы (карбонилы), например [Fe(CO)5]. : C ::: O
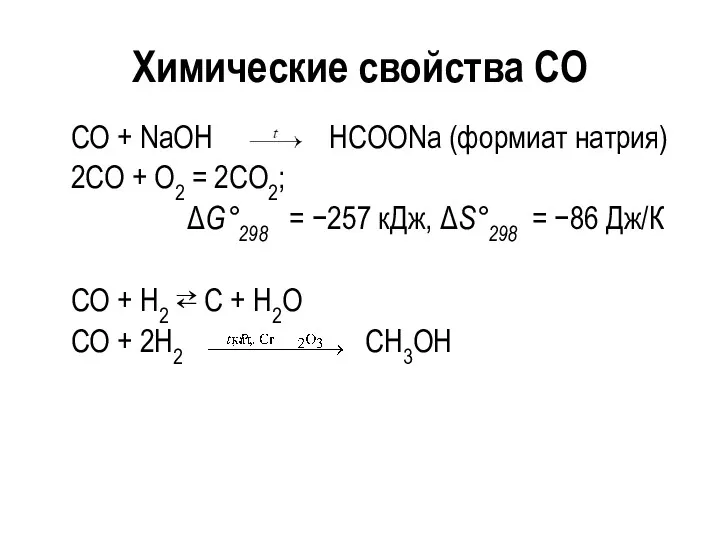
- 20. Химические свойства СО CO + NaOH HCOONa (формиат натрия) 2СО + О2 = 2СО2; ΔG°298 =
- 21. Химические свойства СО СO + Cl2 = COCl2 (фосген), ΔH°298 = –109,8 кДж 5CO + Fe
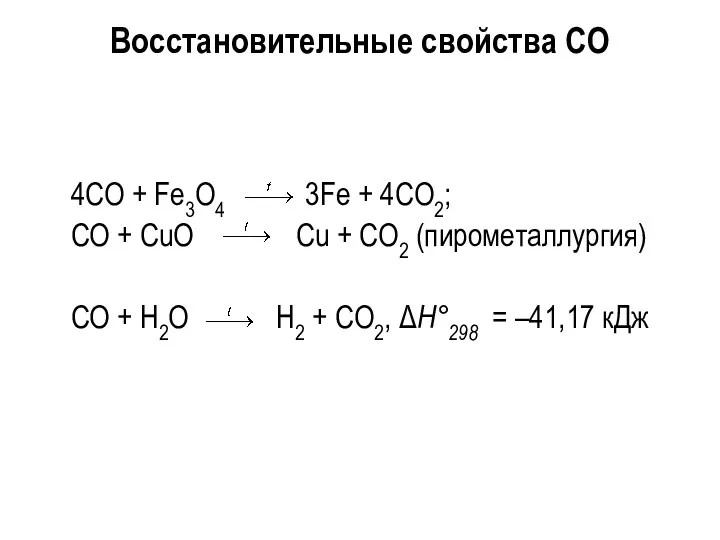
- 22. Восстановительные свойства CO 4CO + Fe3O4 3Fe + 4CO2; CO + CuO Сu + CO2 (пирометаллургия)
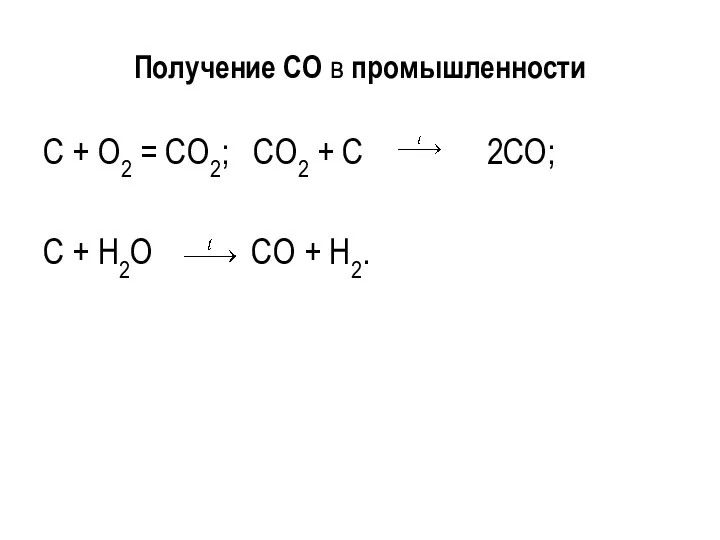
- 23. Получение CO в промышленности C + O2 = CO2; CO2 + C 2CO; C + H2O
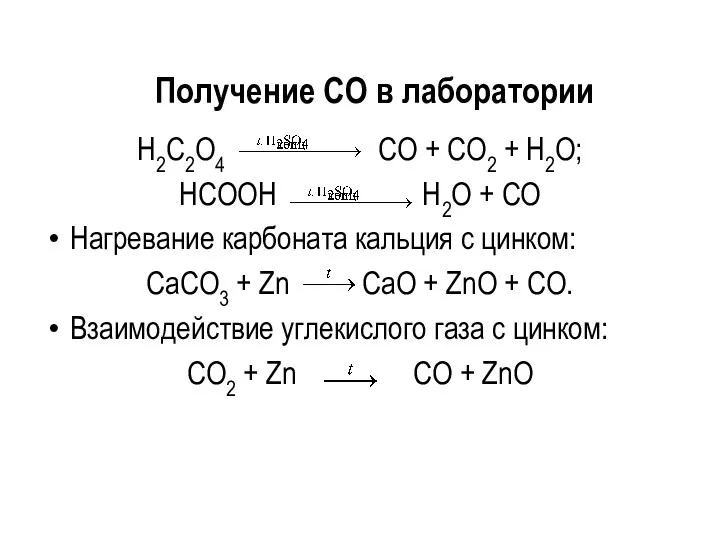
- 24. Получение CO в лаборатории H2C2O4 CO + CO2 + H2O; HCOOH H2O + CO Нагревание карбоната
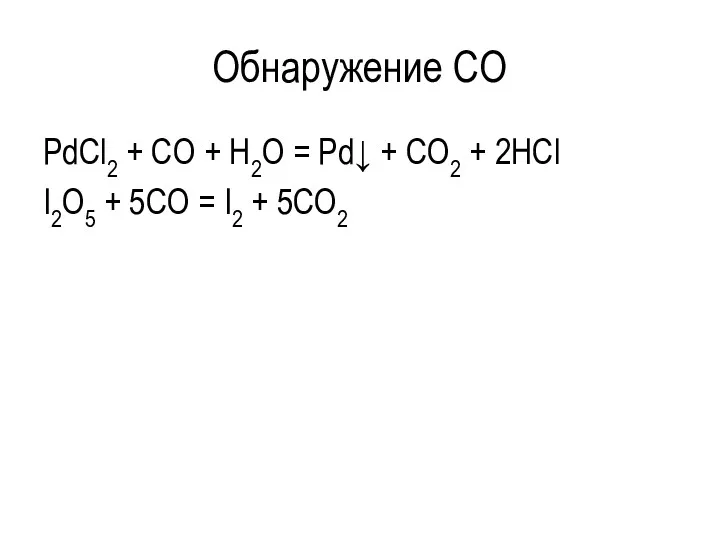
- 25. Обнаружение CO PdCl2 + CO + H2O = Pd↓ + CO2 + 2HCl I2O5 + 5CO
- 26. Оксид углерода(IV) CO2 (кислотный оксид) Бесцветный газ, без запаха, тяжелее воздуха, мало растворим в воде (при
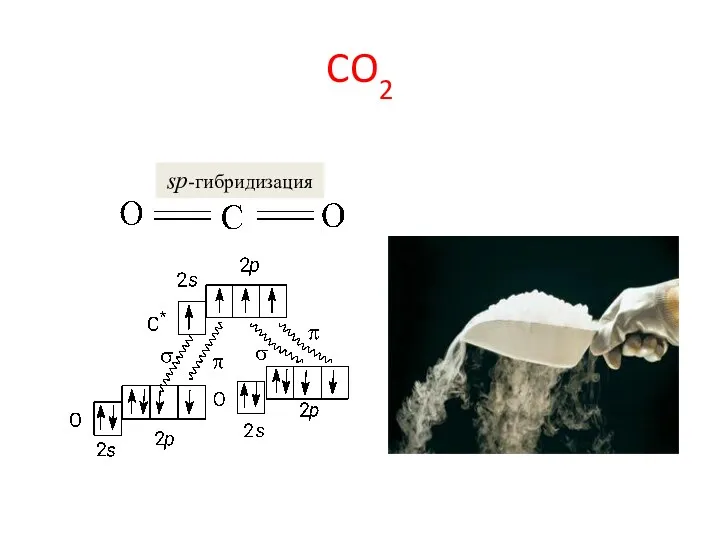
- 27. CO2 sp-гибридизация
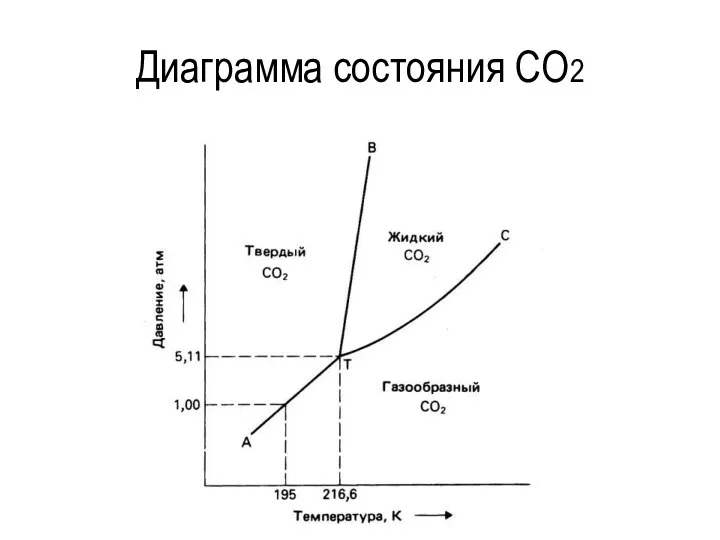
- 28. Диаграмма состояния CO2
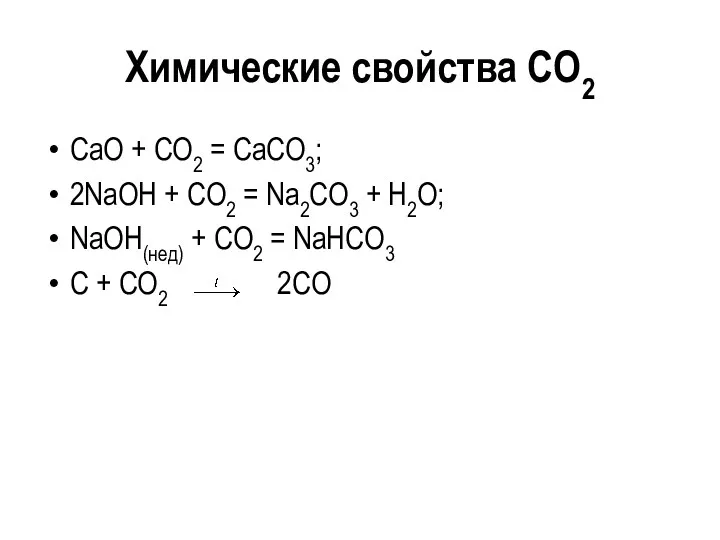
- 29. Химические свойства CO2 СaO + CO2 = СaCO3; 2NaOH + CO2 = Na2CO3 + H2O; NaOH(нед)
- 30. Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа 2Mg + CO2 = 2MgO
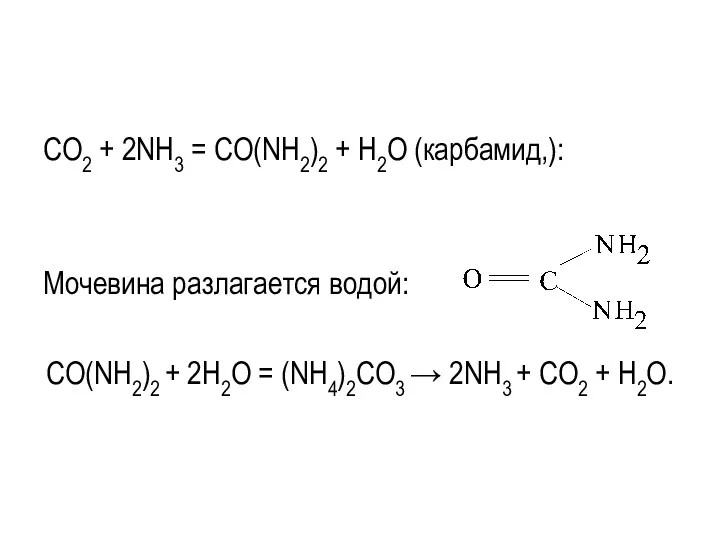
- 31. CO2 + 2NH3 = CO(NH2)2 + H2O (карбамид,): Мочевина разлагается водой: CO(NH2)2 + 2H2O = (NH4)2CO3
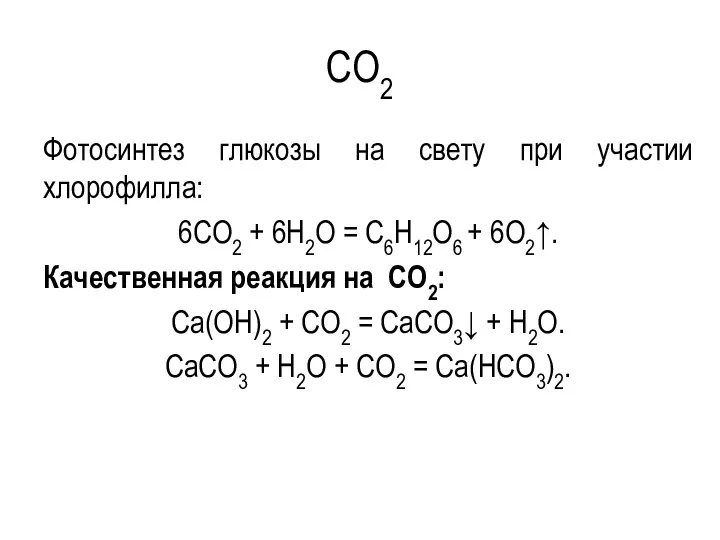
- 32. CO2 Фотосинтез глюкозы на свету при участии хлорофилла: 6CO2 + 6H2O = C6H12O6 + 6O2↑. Качественная
- 33. Моногидрат CO2 . H2O и угольная кислота H2CO3 В водном растворе: CO2 (г) + H2O ⮀
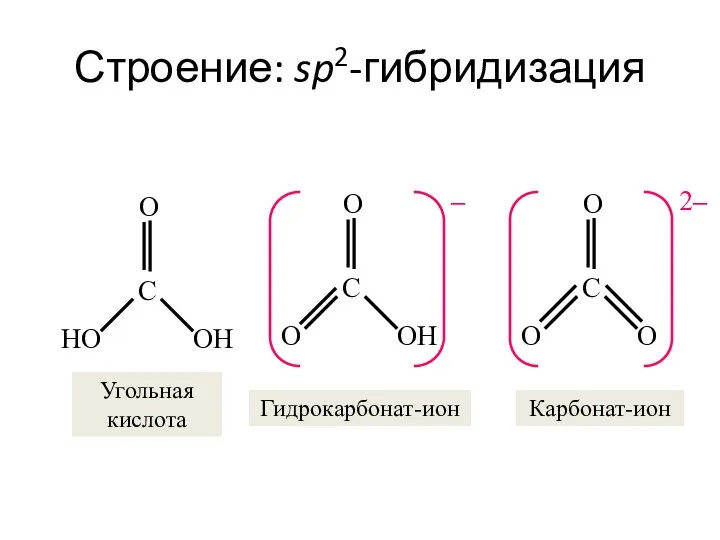
- 34. Строение: sp2-гибридизация
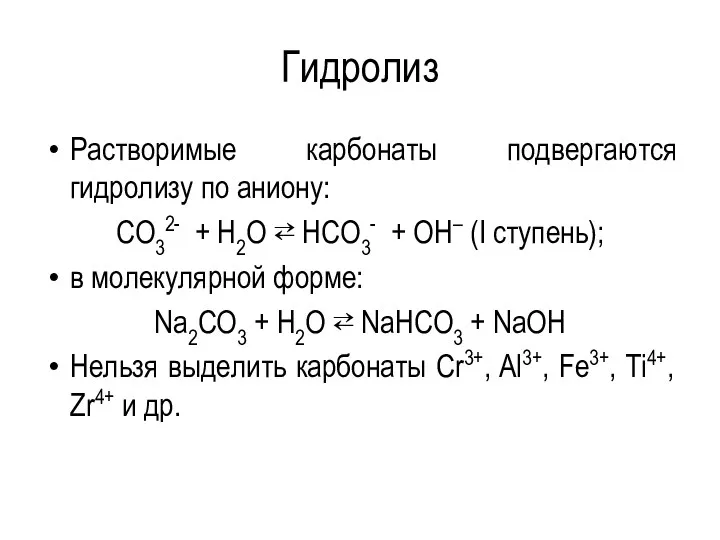
- 35. Гидролиз Растворимые карбонаты подвергаются гидролизу по аниону: CO32- + H2O ⇄ HCO3- + ОН– (І ступень);
- 36. Качественная реакция Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑; CO32- + 2H+ = CO2↑
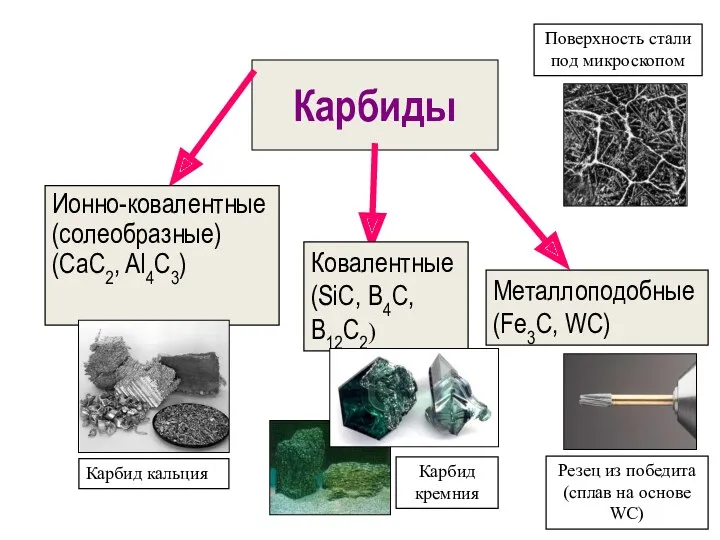
- 37. Карбиды
- 38. Ионно-ковалентные образуют щелочные, щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды. Разлагаются водой с образованием метана
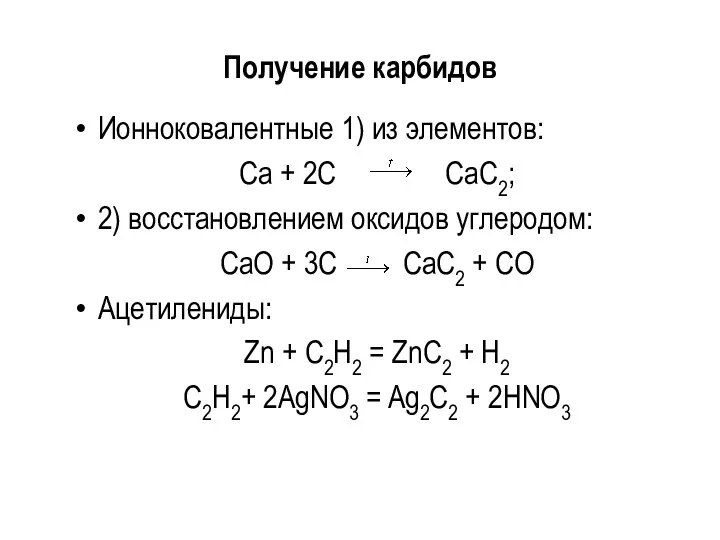
- 39. Получение карбидов Ионноковалентные 1) из элементов: Са + 2С СаС2; 2) восстановлением оксидов углеродом: СаО +
- 40. Карбонилы Общий способ получения карбонилов металлов заключается во взаимодействии оксида углерода CO с металлами или их
- 41. Карбонилы d-элементы с нечетным числом валентных электронов образуют двухъядерные карбонилы со связью металл ‒ металл: Со2(СО)8,
- 42. Соединения углерода с галогенами Углерод непосредственно реагирует только с фтором: С + 2F2 = CF4. Тефлон
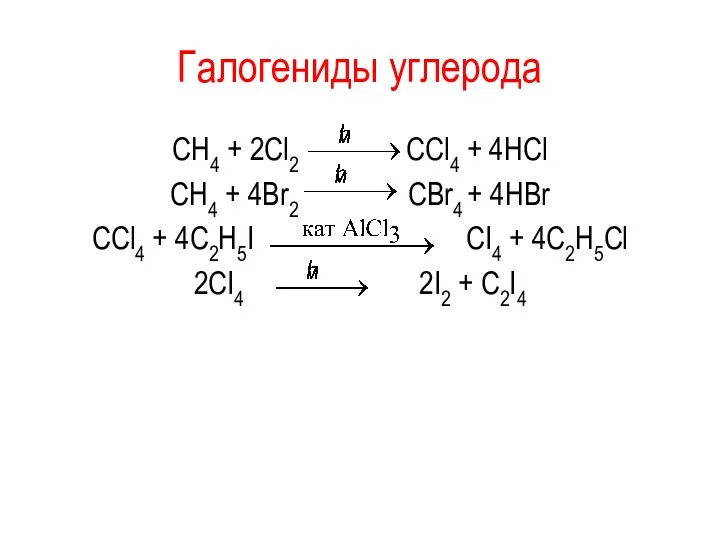
- 43. Галогениды углерода CH4 + 2Cl2 CCl4 + 4HCl СH4 + 4Br2 CBr4 + 4HBr CCl4 +
- 44. Галогениды Уменьшение термической устойчивости и повышение реакционной способности тетрагалогенидов в ряду CF4 → CCl4 → CBr4
- 45. Фосген СОCl2 COCl2 + 2H2O = 2HCl + H2CO3 COCl2 + 4KOH = K2CO3 + 2KCl
- 46. Циановодород (HCN) В жидком состоянии HCN - смесь двух изомерных форм – нормальной и изоформы. В
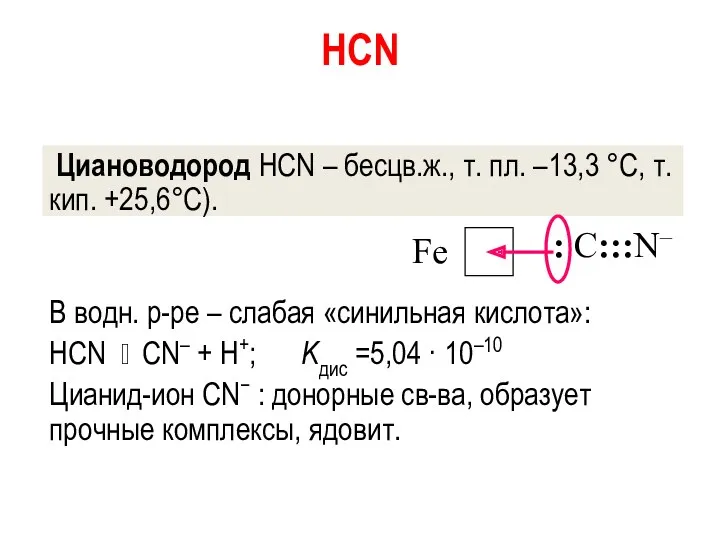
- 47. HCN Циановодород HCN – бесцв.ж., т. пл. –13,3 °С, т.кип. +25,6°С). В водн. р-ре – слабая
- 48. Химические свойства HCN Гидролиз: HCN + 2H2O = HCOOH + NH3. С воздухом: 4HCN + 5O2
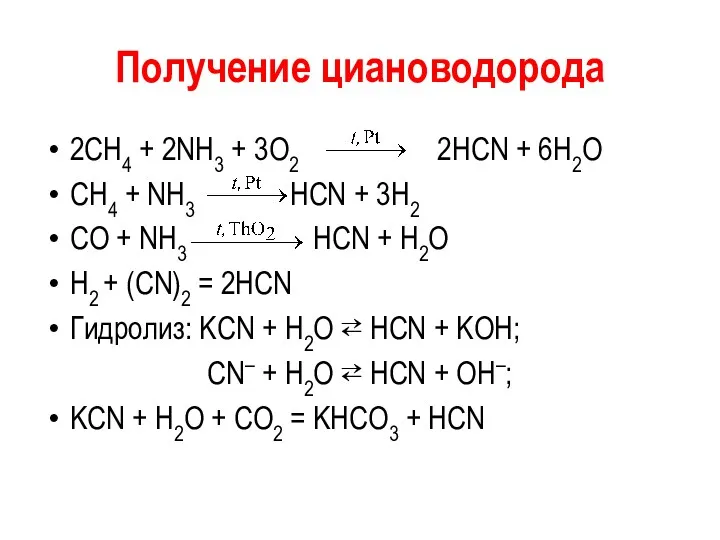
- 49. Получение циановодорода 2CH4 + 2NH3 + 3O2 2HCN + 6H2O CH4 + NH3 HCN + 3H2
- 50. Получение цианидов Na2CO3 + C + 2NH3 2NaCN + 3H2O; NaNH2 + C NaCN + H2
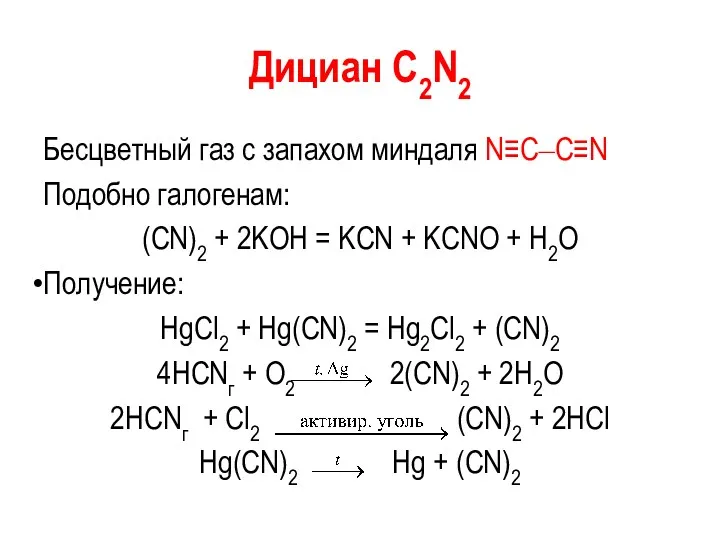
- 51. Дициан С2N2 Бесцветный газ с запахом миндаля N≡C‒C≡N Подобно галогенам: (CN)2 + 2KOH = KCN +
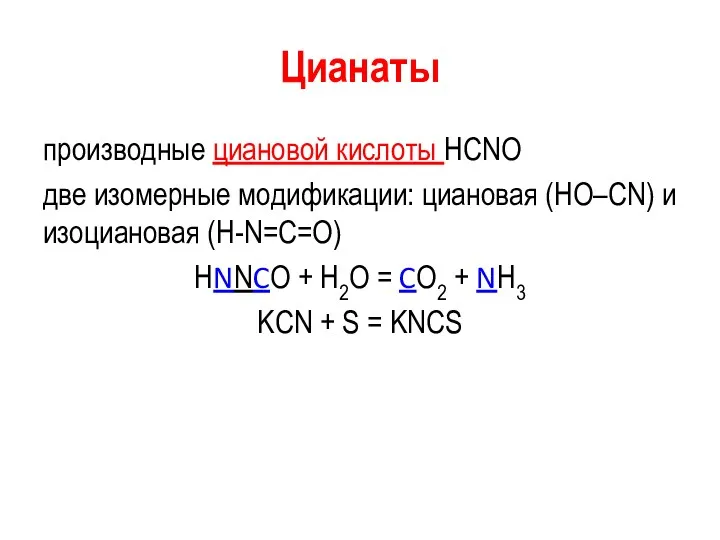
- 52. Цианаты производные циановой кислоты HCNO две изомерные модификации: циановая (HO–CN) и изоциановая (H-N=C=O) HNNCO + H2O
- 53. Псевдогалогениды Неорганические вещества, молекулы которых состоят более чем из двух электроотрицательных атомов, которые в свободном состоянии
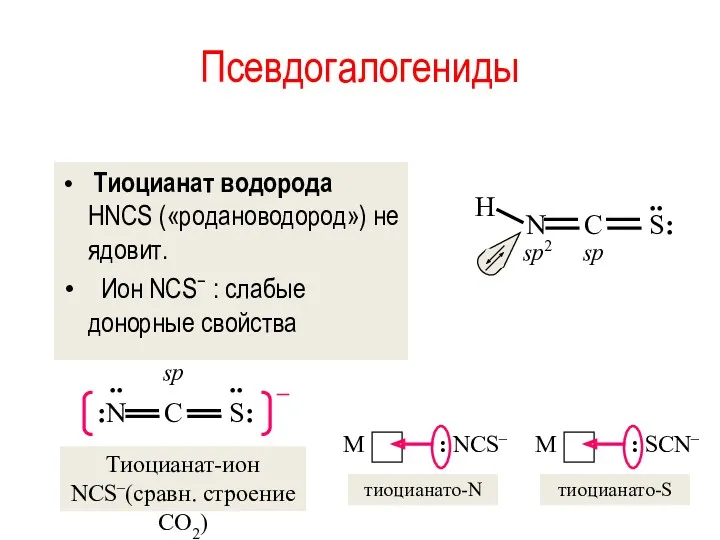
- 54. Псевдогалогениды Тиоцианат водорода HNCS («родановодород») не ядовит. Ион NCS− : слабые донорные свойства
- 55. Родановодородная (тиоциановая) кислота HNCS Н–N=C=S Роданиды (тиоцианаты) образуют комплексные соединения, в которых донорным атомом может быть
- 56. Сероуглерод C + 2S СS2 CS2 + ЗО2 = СО2 + 2SO2 CS2 + 2H2О =
- 57. Тиокарбонаты Na2CS3 + 2HCl = H2CS3 + 2NaCl Тиоугольная кислота: H2CS3 = H2S + CS2
- 58. Распространение в природе и важнейшие минералы Si Кремний (29,5% в литосфере) Кремний: кварц, яшма, агат, опал,
- 59. Минералы Si SiO2 – кремнезем, кварц, горный хрусталь K2O⋅Al2O3⋅6SiO2 – полевой шпат; 3MgO⋅2SiO2⋅2H2O – асбест; Al2O3⋅2SiO2⋅2H2O
- 60. Физические свойства кремния Кристаллический кремний
- 61. Химические свойства Si Si + 2F2 = SiF4 С хлором при t 400–600°С: Si + 2Cl2
- 62. Химические свойства Si При температуре около 2000°С: Si + C SiC Si + 3B B3Si При
- 63. Химические свойства Si С фтороводородом реагирует при обычных условиях, с хлороводородом и бромоводородом – при нагревании:
- 64. Химические свойства Si Кремний взаимодействует только со смесью плавиковой и азотной кислот: 3Si + 4HNO3 +
- 65. Получение Si в промышленности восстановлением оксида коксом в электрических печах: SiO2 + 2C Si + 2CO
- 66. Получение кремния в лаборатории SiO2 + 2Mg Si + 2MgO 3SiO2 + 4Al 3Si + 2Al2O3
- 67. Силаны Oбщая формула SinH2n+2 (n ≤ 8). Моносилан SiH4 Дисилан Si2Н6 Трисилан Si3Н8 Ограниченность гомологического ряда
- 68. Получение силанов Силаны получают, разлагая кислотами (HCl, H2SO4) силициды металлов: Mg2Si + 4HCl = 2MgCl2 +
- 69. Получение силанов реакции в неводных растворах, например в эфире или в аммиаке: Li[AlH4] + SiCl4 SiH4↑
- 70. Свойства силанов Поскольку энергия связи Si–Si и Si–H меньше, чем энергия связей C–C и C–H, силаны
- 71. Силициды Силициды щелочных и щелочноземельных металлов легко разлагаются водой, кислотами: Na4Si + 3H2O = Na2SiO3 +
- 72. Карборунд SiC имеет структуру алмаза. Он характеризуется высокой твердостью и температурой плавления, а также высокой химической
- 73. Получение силицидов: 2Mg + Si Mg2Si SiO2 + 4Mg Mg2Si + 2MgO
- 74. Галогениды кремния SiГ4 Получение: Si + 2Г2 = SiГ4 SiO2 + 2C + 2Cl2 2CO +
- 75. Гидролиз SiCl4 + 3H2O = H2SiO3 + 4HCl., ∆G◦298 = ‑238 кДж. Гидролиз SiF4: SiF4 +
- 76. H2SiF6 гексафторокремниевая кислота в свободном виде не получена. При упаривании растворов разлагается: H2SiF6 ⇄ SiF4↑ +
- 77. Оксид кремния (II) SiO 2Si + O2(нед) 2SiO SiO2 + Si 2SiO
- 78. Оксид кремния (IV) SiO2 Энергия связи Е(Si–О) = 466 кДж/молъ Кварц скрученный Кварц горный хрусталь Кварц
- 80. халцедон изумруд
- 81. каолин (белая глина) Al2O3·2SiO2·2H2O полевой шпат – K2O⋅Al2O3⋅6SiO2
- 82. SiO2 В основе тетраэдр [SiO4]:
- 83. Физические свойства SiO2 Аллотропные модификации:
- 84. Химические свойства SiO2 SiO2 + 2Mg Si + 2MgO при избытке металла – силициды: SiO2 +
- 85. Cвойства SiO2 SiO2 + 2KOH K2SiO3 + H2O SiO2 + MgО MgSiO3 SiO2 + K2CO3 K2SiO3
- 86. SiO2 Силикагель (SiO2)n. ‑ адсорбент Мелкодисперсный аморфный белый порошок диоксида кремния SiO2 ‑ белая сажа.
- 87. Травление стекла SiO2 + 4HF = SiF4↑ + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] +
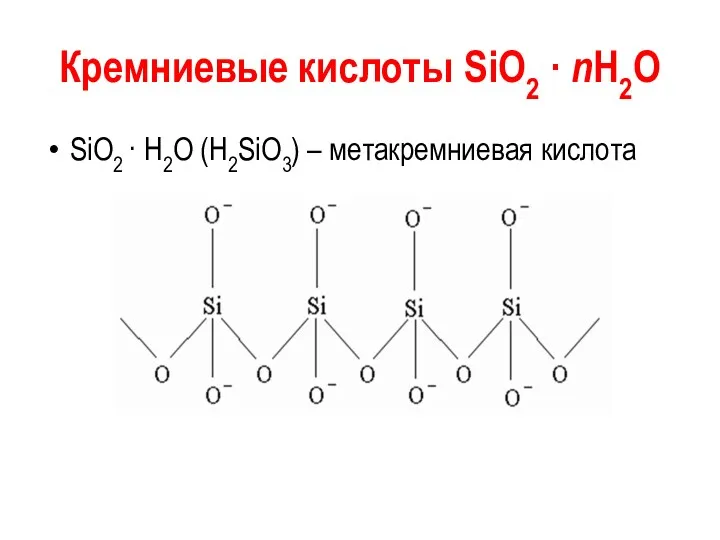
- 88. Кремниевые кислоты SiО2 · nН2О SiO2 · Н2О (Н2SiO3) – метакремниевая кислота
- 89. 2SiO2 · Н2О (Н2Si2O5) – дикремниевая кислота SiO2 · 2Н2О (Н4SiO4) – ортокремниевая
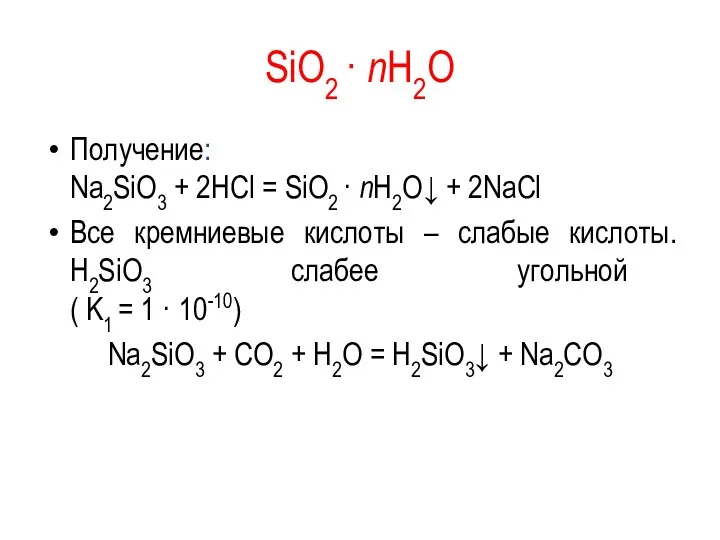
- 90. SiО2 · nН2О Получение: Nа2SiО3 + 2НСl = SiО2 · nН2О↓ + 2NаСl Все кремниевые кислоты
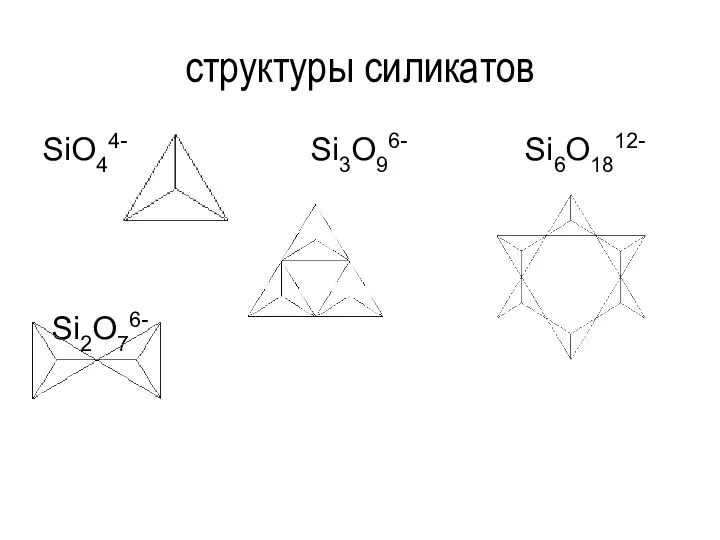
- 91. структуры силикатов SiO44- Si3O96- Si6O1812- Si2O76-
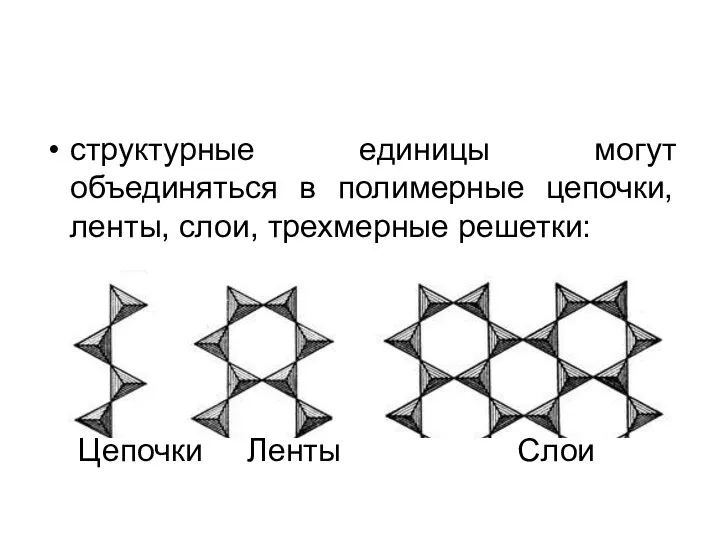
- 92. структурные единицы могут объединяться в полимерные цепочки, ленты, слои, трехмерные решетки: Цепочки Ленты Слои
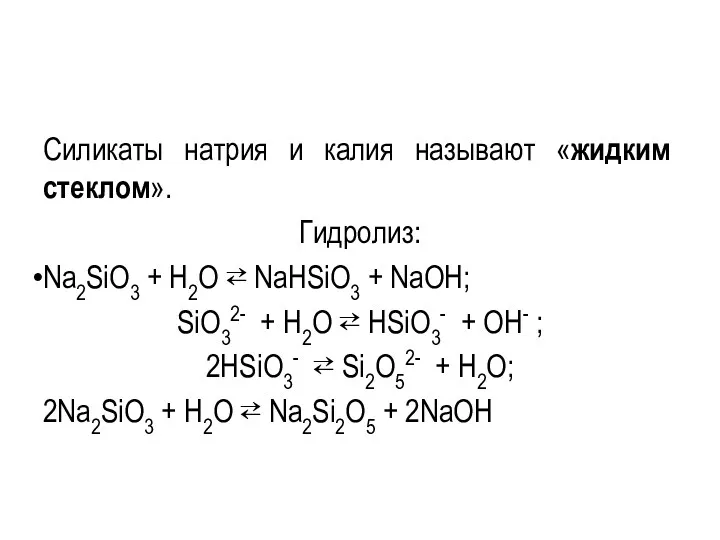
- 93. Силикаты натрия и калия называют «жидким стеклом». Гидролиз: Nа2SiО3 + Н2О ⇄ NаНSiО3 + NаОН; SiО32-
- 94. Силикатная промышленность Фарфор – керамический материал, состоящий из каолина, обычной глины, кварца и полевого шпата. Фарфор
- 95. Фаянс – керамический материал, отличный от фарфора тем, что содержит 85% глины, обладает высокой пористостью и
- 96. фаянсовая посуда
- 97. Керамика Огнеупорные материалы
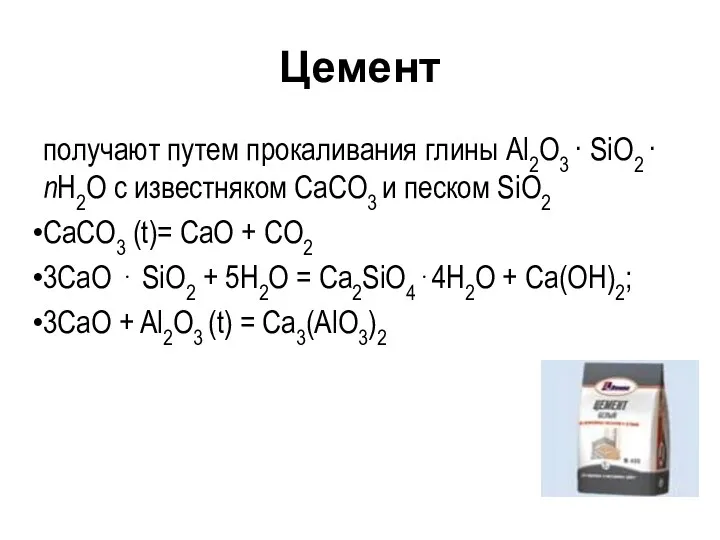
- 98. Цемент Цементы – вяжущие вещества, употребляемые в строительстве для скрепления между собой твёрдых предметов. Цементы различают
- 99. Цемент получают путем прокаливания глины Al2O3 · SiO2 · nH2O с известняком СаСО3 и песком SiO2
- 100. При замешивании цемента с водой «схватывание») получается тестообразная, через некоторое время отвердевающая масса. Схватывание цемента объясняется
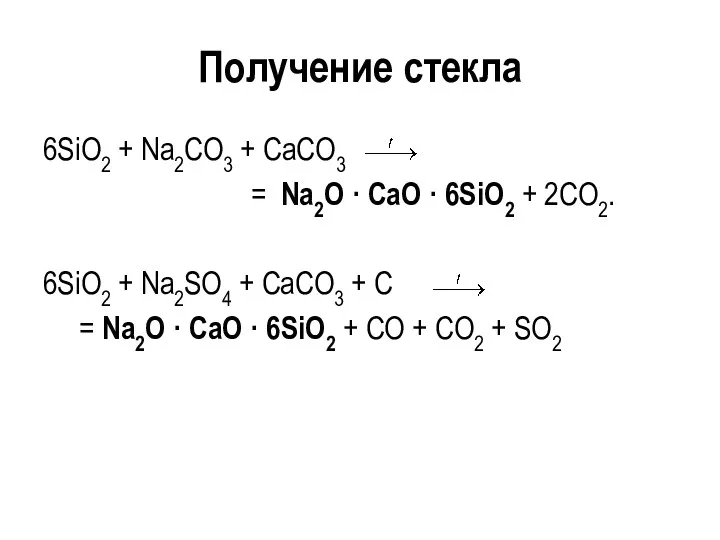
- 101. Стекло – твёрдый силикатный материал, основными свойствами которого являются прозрачность и химическая стойкость. Стекло получают варкой
- 102. Получение стекла 6SiO2 + Na2CO3 + CaCO3 = Na2O · CaO · 6SiO2 + 2CO2. 6SiO2
- 104. Кварцевое стекло Кварцевое стекло Хрустальное стекло
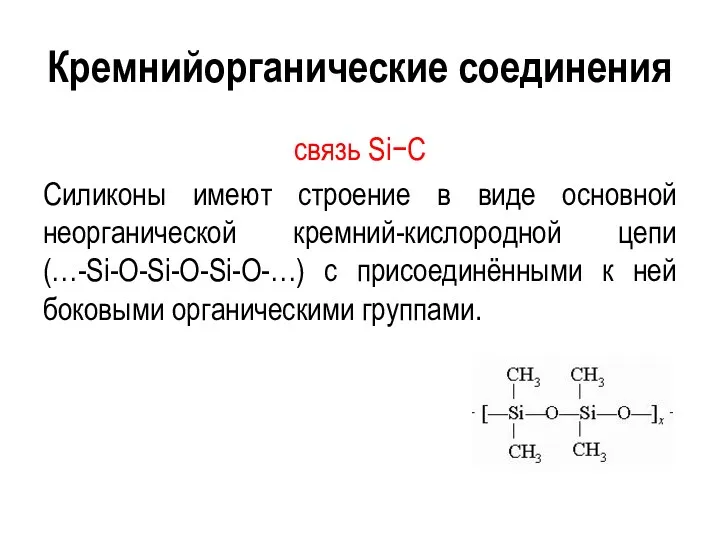
- 105. Кремнийорганические соединения связь Si−C Силиконы имеют строение в виде основной неорганической кремний-кислородной цепи (…-Si-O-Si-O-Si-O-…) с присоединёнными
- 107. Германий, олово, свинец
- 108. Природные соединения
- 109. Получение германия, олова и свинца GeO2 + 2H2 Ge очищают зонной плавкой SnO2 + 2C Sn,
- 110. Физические свойства германия Алмазоподобная кристаллическая решетка, обладает высокой для металлов твердостью, высокой температурой плавления (938,25°С) и
- 112. Олово Белое β-Sn Серое α-Sn Cуществует в виде трех аллотропных модификаций: серое олово (α-Sn), белое олово
- 113. свинец Оловянные солдатики
- 114. Физические свойства Белое олово устойчиво при температурах выше 13,2°С, оно имеет невысокую твёрдость и высокую пластичность.
- 115. Химические свойства При нагревании германий, олово, свинец окисляются кислородом (образуя GeO2, SnO2 и PbO или Pb3O4):
- 116. Химические свойства С галогенами образуются GeГ4, SnГ4, PbГ2. С серой ‑ GeS или GeS2, SnS или
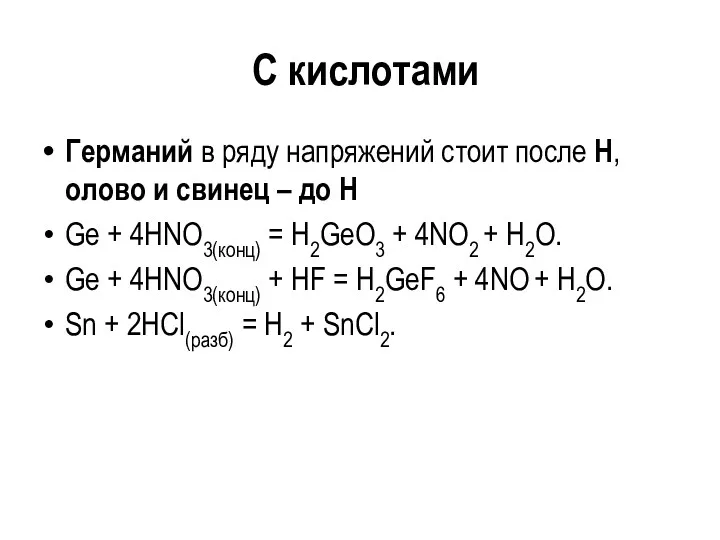
- 117. С кислотами Германий в ряду напряжений стоит после Н, олово и свинец – до Н Ge
- 118. С кислотами В концентрированной HCl скорость растворения увеличивается, происходит образование комплексов : Sn + 4HCl(конц) =
- 119. С кислотами 4H2SO4(разб) действует на Sn как HCl. H2SO4(конц) является окислителем: Sn + 4H2SO4(конц) = Sn(SO4)2
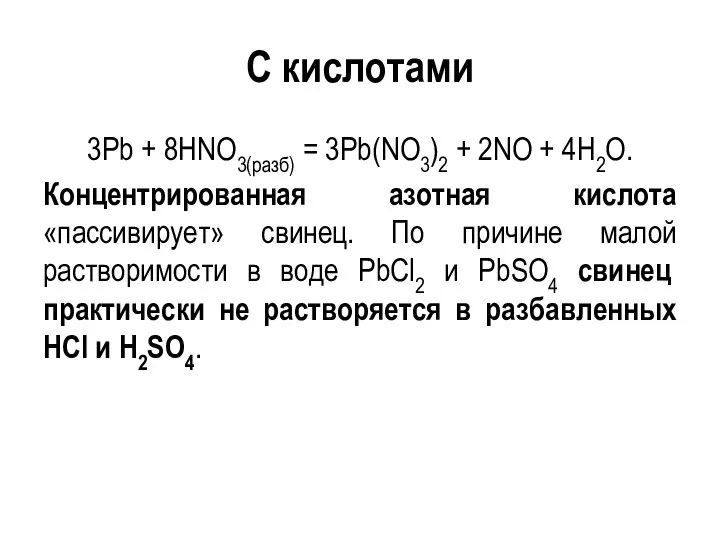
- 120. С кислотами 3Pb + 8HNO3(разб) = 3Pb(NO3)2 + 2NO + 4H2O. Концентрированная азотная кислота «пассивирует» свинец.
- 121. С кислотами Концентрированная серная кислота реагирует со свинцом : Pb + 3H2SO4(конц) = Pb(HSO4)2 + SO2+2H2O
- 122. Со щелочами Германий со щелочами взаимодействует только при наличии окислителей: Ge + 2KOH + 2H2O2 =
- 123. Со щелочами При кипячении с растворами щелочей олово растворяется с образованием гидроксостаннатов: Sn + 4NaOH +
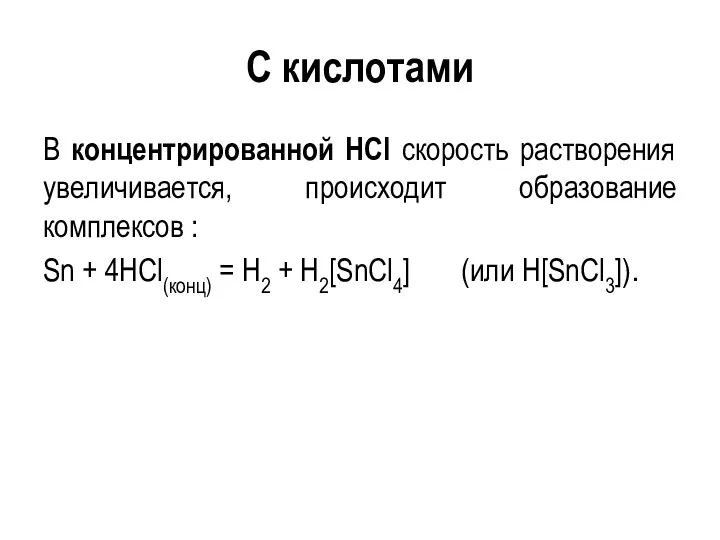
- 124. Со щелочами При добавлении окислителя (Н2О2) Ge, Sn, Pb активно растворяются в щелочах при комнатной температуре:
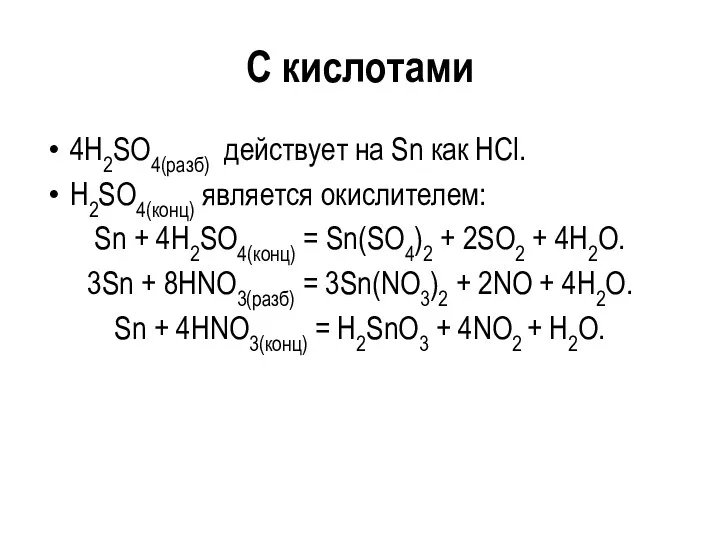
- 125. Лучшим растворителем свинца является разбавленная азотная кислота, а олова – царская водка: Sn + 4HNO3 +
- 126. Галогениды германия, олова и свинца Гидролиз GeF4, GeCl4аналогично SiF4: 3GeF4 + 2H2O = GeO2 + 2H2[GeF6];
- 127. Галогениды Э(II) Галогениды германия (II), олова (II) и свинца (II) являются типичными солями. Растворимые соли германия
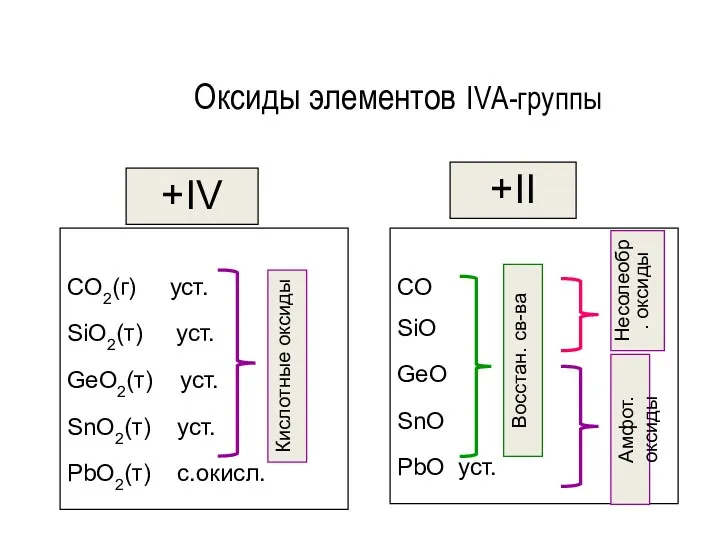
- 128. Оксиды элементов IVА-группы +IV CO2(г) уст. SiO2(т) уст. GeO2(т) уст. SnO2(т) уст. PbO2(т) с.окисл. +II CO
- 129. Оксиды PbO2 ‑ очень сильный окислитель ( Е°298 = +1,46 В), выделяет хлор из HCl конц.:
- 130. Свинцовый сурик Pb3O4 Pb2PbO4 − ортоплюмбат свинца (II): Pb3O4 + 8CH3COOH = Pb(CH3COO)4 + + 2Pb(CH3COO)2
- 131. Получение 2Pb + O2 2PbO 2PbO2 2PbO + O2 2Pb(NO3)2 2PbO + 4NO2 + O2 PbCO3
- 132. GeO2 SnO2 PbO2
- 133. Pb3O4
- 134. Амфотерные свойства PbO + 2HNO3 = Pb(NO3)2 + H2O PbO + 2KOH + H2O = K2[Pb(OH)4]
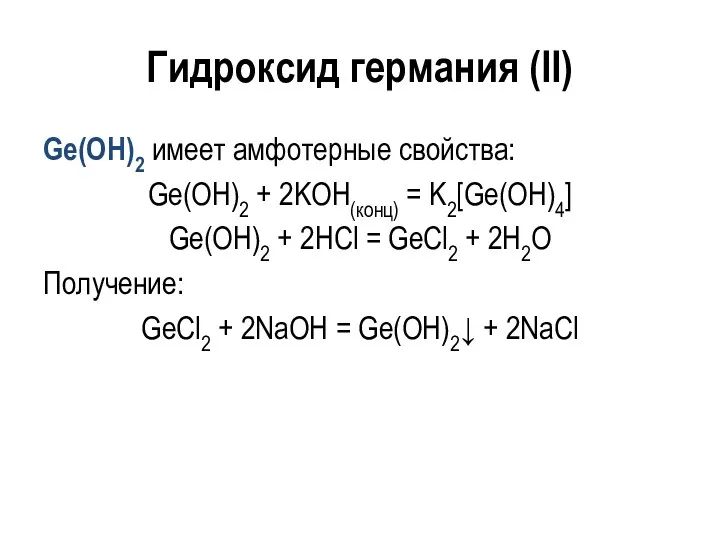
- 135. Гидроксид германия (II) Ge(OH)2 имеет амфотерные свойства: Ge(OH)2 + 2KOH(конц) = K2[Ge(OH)4] Ge(OH)2 + 2HCl =
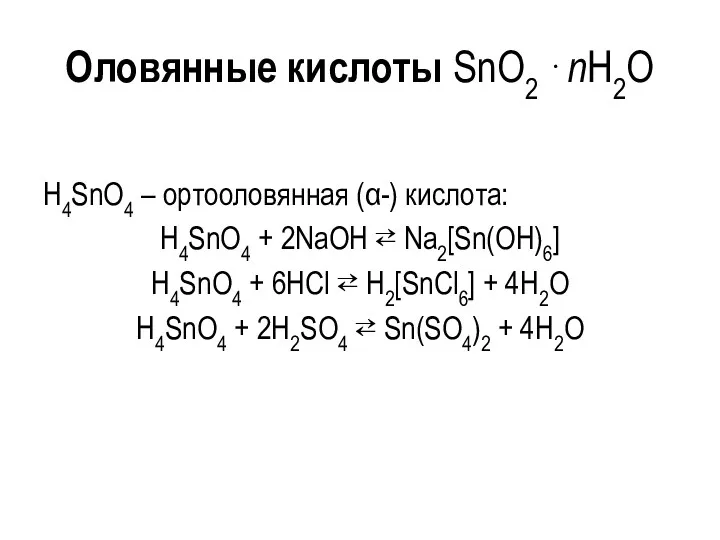
- 136. Оловянные кислоты SnO2 ⋅nH2O H4SnO4 – ортооловянная (α-) кислота: H4SnO4 + 2NaOH ⇄ Na2[Sn(OH)6] H4SnO4 +
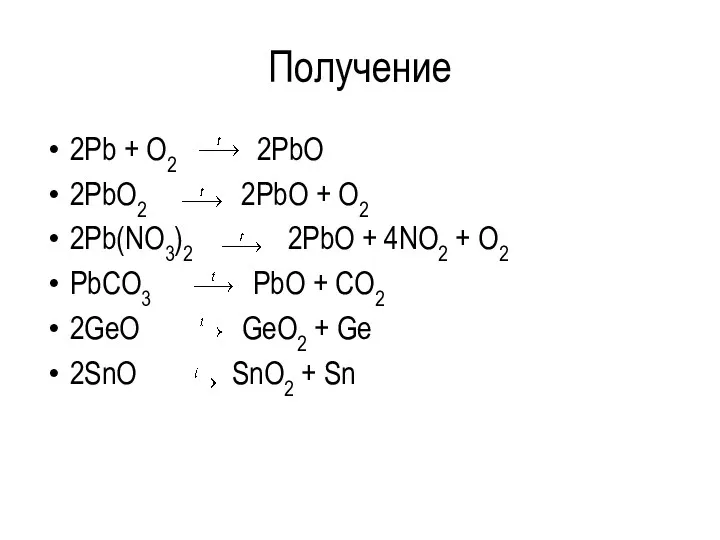
- 137. Оловянные кислоты β-оловянная кислота – полимер (H2SnO3)n Sn + 4HNO3(конц) = β-H2SnO3↓ + 4NO2 + H2O
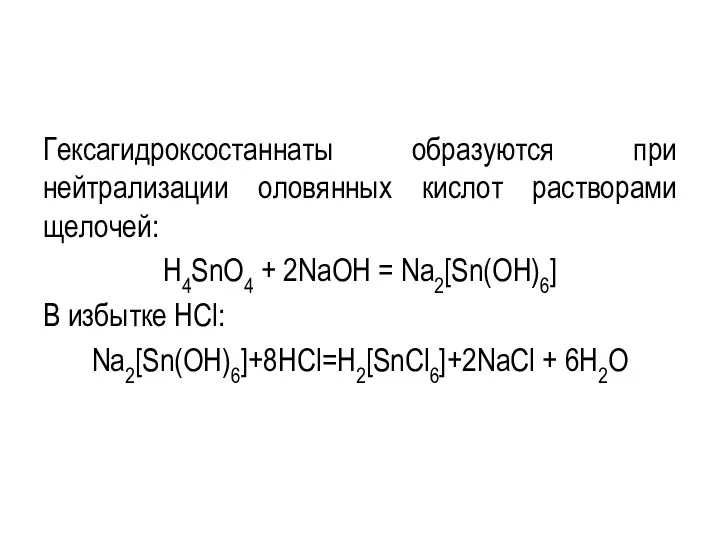
- 138. Гексагидроксостаннаты образуются при нейтрализации оловянных кислот растворами щелочей: H4SnO4 + 2NaOH = Na2[Sn(OH)6] В избытке HCl:
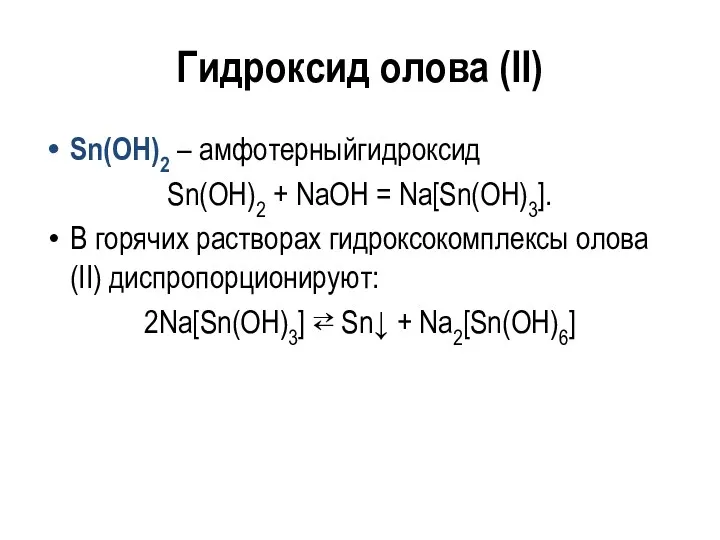
- 139. Гидроксид олова (II) Sn(OH)2 – амфотерныйгидроксид Sn(OH)2 + NaOH = Na[Sn(OH)3]. В горячих растворах гидроксокомплексы олова
- 140. Соли Sn2+ в водных растворах сильно гидролизуются: Sn2+ + H2O ⇄ SnOH+ + H+; Для подавления
- 141. Соли олова (II) являются хорошими восстановителями, как в кислой, так и щелочной среде: E°298 Sn(4+)/ Sn(2+)=
- 142. Метаплюмбаты MeI2PbO3 и MeIIPbO3 (где MeI = Na+ , K+, Ag+, MeII = Ca2+, Zn2+, Cu2+,
- 143. Гексагидроксоплюмбаты получают растворением PbO2 в горячих концентрированных щелочах: PbO2 + 2KOH + 2H2O = K2[Pb(OH)6]. при
- 144. Гидроксид свинца (II) Pb(OH)2 – белое вещество, плохо растворимое в воде и аммиаке, обладает амфотерными свойствами:
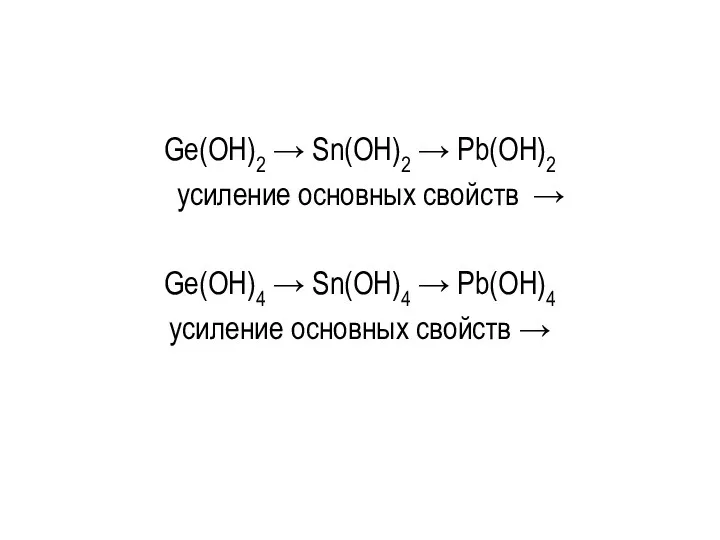
- 145. Ge(OH)2 → Sn(OH)2 → Pb(OH)2 усиление основных свойств → Ge(OH)4 → Sn(OH)4 → Pb(OH)4 усиление основных
- 146. Ортоплюмбаты Me2PbO4 (где Me = Ca2+, Sr2+, Ba2+, Pb2+) получают сплавлением PbO2 c оксидами или карбонатами:
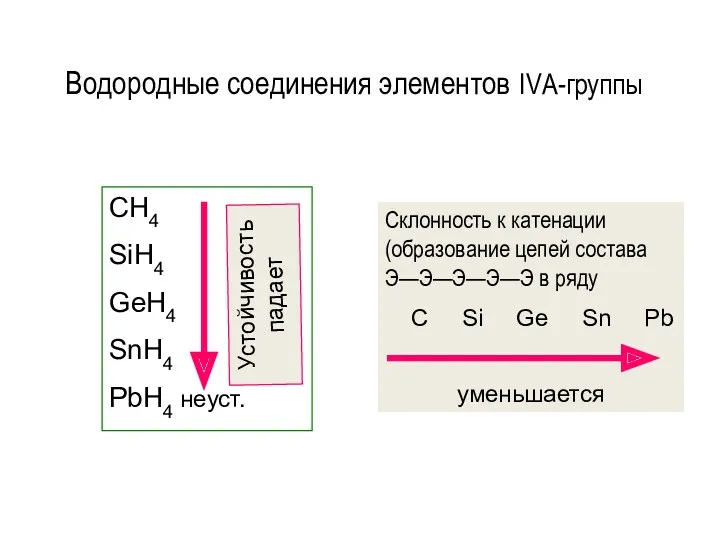
- 147. Водородные соединения элементов IVА-группы СH4 SiH4 GeH4 SnH4 PbH4 неуст. Склонность к катенации (образование цепей состава
- 148. Все гидриды обладают восстановительными свойствами и горят на воздухе. SnH4 горит пламенем василькового цвета: SnH4 +
- 149. Моносульфиды MS малорастворимые соли, их получают: GeCl2 + H2S ⇄ 2HCl + GeS↓ (красно-коричневый) SnCl2 +
- 150. Дисульфиды GeS2 и SnS2 получают взаимодействием простых веществ при нагревании или пропусканием сероводорода через кислые растворы
- 151. H2[SnCl6] + 2H2S ⇄ 6HCl + SnS2↓ (золотисто-желтый).
- 153. Скачать презентацию

![Общая электронная формула валентных электронов: […] ns 2 np2 Валентные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/606893/slide-4.jpg)



![Оксид углерода(II) CO Донорные свойства: CO образует прочные комплексы (карбонилы), например [Fe(CO)5]. : C ::: O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/606893/slide-18.jpg)










































![SiO2 В основе тетраэдр [SiO4]:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/606893/slide-81.jpg)
















































![H2[SnCl6] + 2H2S ⇄ 6HCl + SnS2↓ (золотисто-желтый).](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/606893/slide-150.jpg)
 Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Соединения железа
Соединения железа Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Общая характеристика неметаллов
Общая характеристика неметаллов Титан. Хром
Титан. Хром Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии Хімічні властивості кислот
Хімічні властивості кислот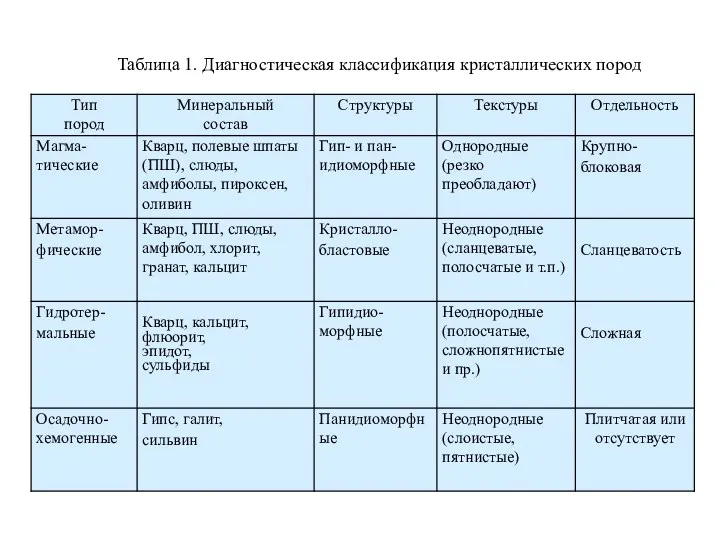 Диагностика метаморфических и гидротермальных горных пород
Диагностика метаморфических и гидротермальных горных пород Нуклеиновые кислоты
Нуклеиновые кислоты Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар
Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар Аммиак. Строение атома азота
Аммиак. Строение атома азота Азотсодержащие соединения. Амины. Аминокислоты
Азотсодержащие соединения. Амины. Аминокислоты Organic molecules
Organic molecules Щелочные металлы
Щелочные металлы Чисті речовини і суміші
Чисті речовини і суміші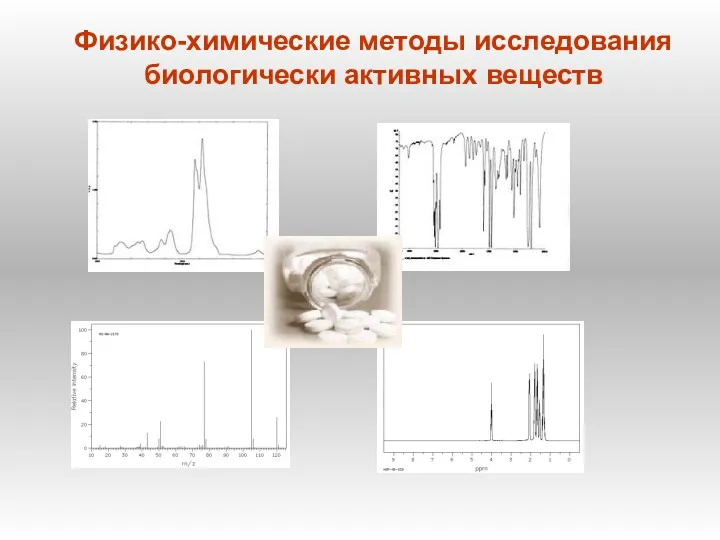 Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них Поливинилхлорид
Поливинилхлорид Неметаллы. Занятие 20
Неметаллы. Занятие 20 Омыватель лобового стекла
Омыватель лобового стекла Неон (Ne)
Неон (Ne) Основные разделы химии
Основные разделы химии Строение атома
Строение атома Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Химия нефти и газа
Химия нефти и газа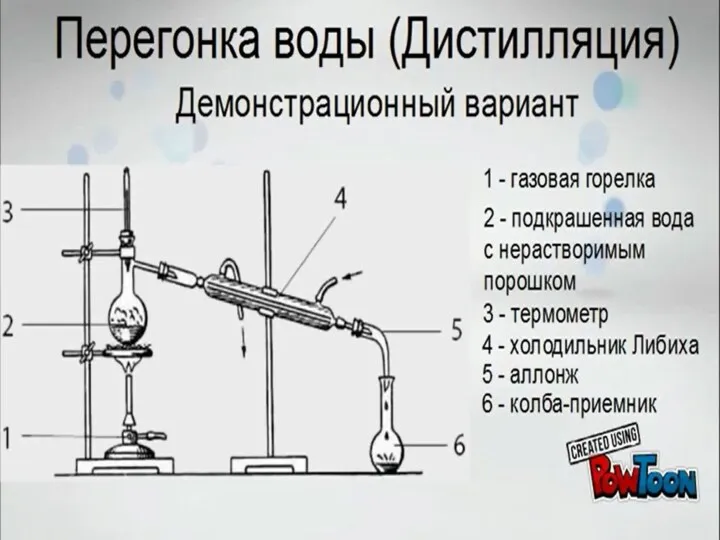 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Водород. Строение, свойства, получение, применение
Водород. Строение, свойства, получение, применение