Содержание
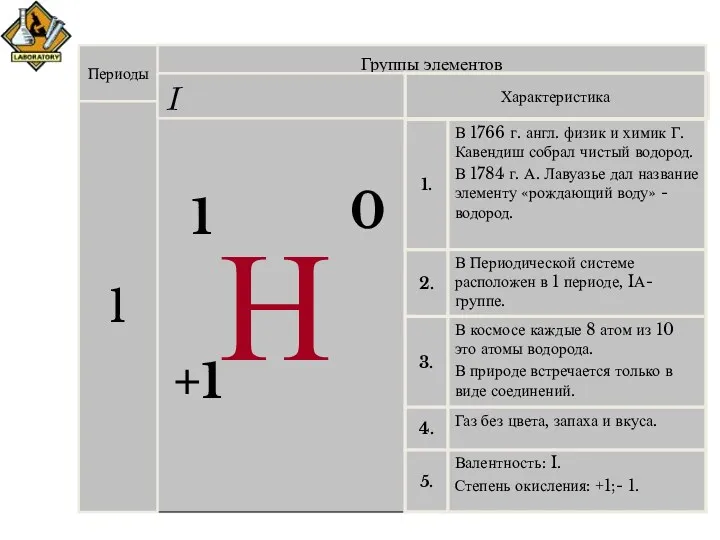
- 2. Периоды 1 Группы элементов I +1 Н 1 0
- 3. Водород Н 1 +1 0 1 P = 1 e = 1 N = 0 −
- 4. Получение водорода в промышленности В основном получают из природного газа путем конверсии (превращения) под действием водяных
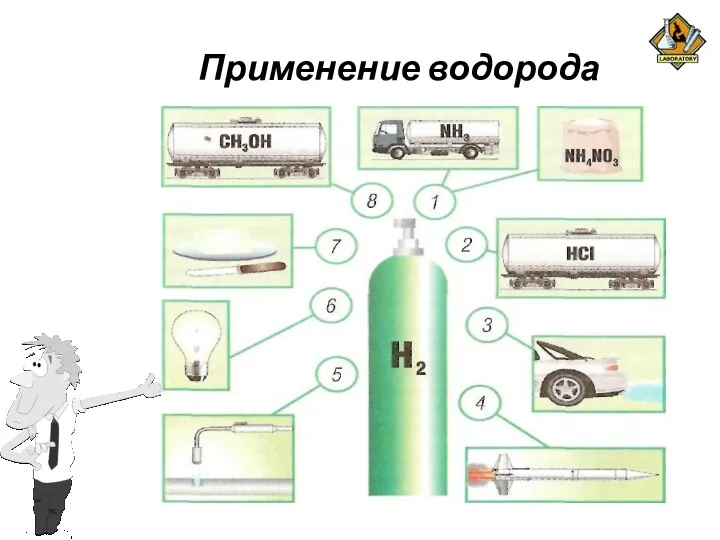
- 5. Применение водорода
- 6. Допиши химические реакции и укажи их тип: 1. H2O2 = 6. HgO= 2. S + O2=
- 8. Скачать презентацию
Слайд 2
Периоды
1
Группы элементов
I
+1
Н
1
0
Периоды
1
Группы элементов
I
+1
Н
1
0
Слайд 3
Водород
Н
1
+1
0
1
P = 1
e = 1
N = 0
−
1s
Строение атома
Химические свойства
Восстановительные
Водород
Н
1
+1
0
1
P = 1
e = 1
N = 0
−
1s
Строение атома
Химические свойства
Восстановительные
свойства:
2Н2 + О2 = 2 Н2О
N2 + 3H2 = 2NH3
Cl2 + H2 = 2 HCl
CuO + H2 = Cu + H2O
2Н2 + О2 = 2 Н2О
N2 + 3H2 = 2NH3
Cl2 + H2 = 2 HCl
CuO + H2 = Cu + H2O
2. Окислительные свойства:
2Nа + H2 = 2NаH
Cа + H2 = CаН2
Водород в 14 раз легче воздуха и поэтому его собирают в перевернутый вверх дном сосуд. Получают его действием кислот на металлы в аппарате Киппа.
Слайд 4
Получение водорода в промышленности
В основном получают из природного газа путем конверсии
Получение водорода в промышленности
В основном получают из природного газа путем конверсии
(превращения) под действием водяных паров и катализатора:
СН4 + 2Н2О → 4Н2↑+СО2
Нагревание:
CH4 →2H2↑ +C
Разложение воды под действием электрического тока:
2Н2О→Н2↑ +О2↑
В промышленности водород получают, пропуская водяные пары над раскаленным углем:
С + Н2О = СО + Н2.
СН4 + 2Н2О → 4Н2↑+СО2
Нагревание:
CH4 →2H2↑ +C
Разложение воды под действием электрического тока:
2Н2О→Н2↑ +О2↑
В промышленности водород получают, пропуская водяные пары над раскаленным углем:
С + Н2О = СО + Н2.
Слайд 5
Применение водорода
Применение водорода
Слайд 6
Допиши химические реакции и укажи их тип:
1. H2O2 = 6. HgO=
2.
Допиши химические реакции и укажи их тип:
1. H2O2 = 6. HgO=
2.
S + O2= 7. Al + O2=
3. Al + HCl= 8. Zn + H2SO4=
4. HgO + H2= 9. PbO +H2 =
5. H2 + Cl2= 10. Na +H2=
3. Al + HCl= 8. Zn + H2SO4=
4. HgO + H2= 9. PbO +H2 =
5. H2 + Cl2= 10. Na +H2=
1. H2O2=2H2O+O2 6. 2HgO=Hg+O2
2. S + O2=SO2 7.4Al +3O2=2Al2O3
3.2Al+6HCl=2AlCl3+3H2 8. Zn+H2SO4=ZnSO4+H2
4. HgO +H2=Hg+H2O 9. PbO +H2 =Pb+H2O
5. H2 + Cl2 =2HCl 10. 2Na + H2=2NaH



 Товары бытовой химии
Товары бытовой химии Алкадиены
Алкадиены Основания, их классификация и свойства в свете ТЭД
Основания, их классификация и свойства в свете ТЭД Separation amp confirmation
Separation amp confirmation Магний и кальций
Магний и кальций Характеристика химических элементов IV группы, главной подгруппы. Углерод
Характеристика химических элементов IV группы, главной подгруппы. Углерод Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости
Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости Метаморфические породы
Метаморфические породы Высокомолекулярные соединения (синтетическое волокно капрон)
Высокомолекулярные соединения (синтетическое волокно капрон) Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Электроотрицательность. Ковалентная полярная связь. (Тема 12)
Электроотрицательность. Ковалентная полярная связь. (Тема 12) Строительное материаловедение. Лекция 1
Строительное материаловедение. Лекция 1 Кристаллография и основы кристаллохимии
Кристаллография и основы кристаллохимии Получение кислот
Получение кислот Фенол. Фізичні та хімічні властивості
Фенол. Фізичні та хімічні властивості Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция
Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева
Общая характеристика элементов I группы главной подгруппы Периодической системы химических элементов Д.И. Менделеева Теоретические основы органической химии
Теоретические основы органической химии Алюминий и его соединения. Характеристика химического элемента: 3-й период, 3-я А подгруппа
Алюминий и его соединения. Характеристика химического элемента: 3-й период, 3-я А подгруппа Утворення асимілятів та їхнє перетворення
Утворення асимілятів та їхнє перетворення Феноли (бензенол)
Феноли (бензенол) Свойства фосфора
Свойства фосфора Значення хімії у розв’ язанні енергетичної проблеми
Значення хімії у розв’ язанні енергетичної проблеми Признаки химических реакций. Урок химии в 8 классе
Признаки химических реакций. Урок химии в 8 классе Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения