Алюминий и его соединения. Характеристика химического элемента: 3-й период, 3-я А подгруппа презентация
Содержание
- 3. Характеристика химического элемента: 3-й период, 3-я А подгруппа Порядковый номер Относительная атомная масса Заряд ядра атома
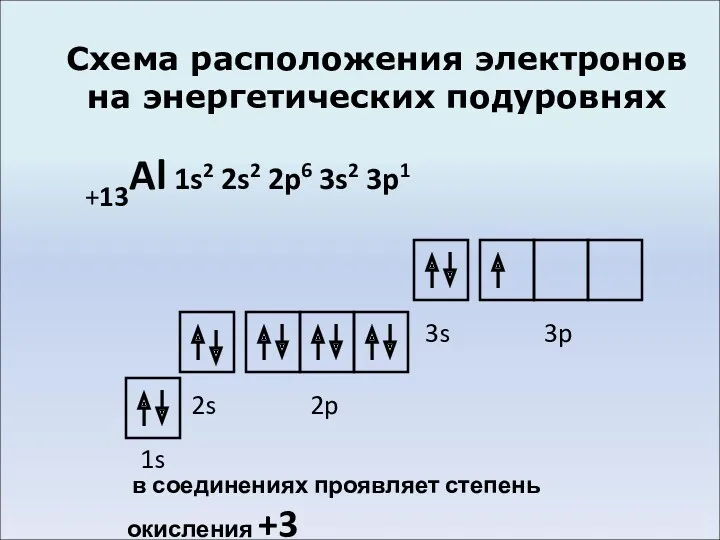
- 4. Схема расположения электронов на энергетических подуровнях +13Al 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s
- 5. Кристалл алюминия: Металлическая кристаллическая решетка алюминия Металлическая химическая связь в металле.
- 6. Датский физик Ганс Эрстед (1777-1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия
- 7. IНахождение в природе По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния
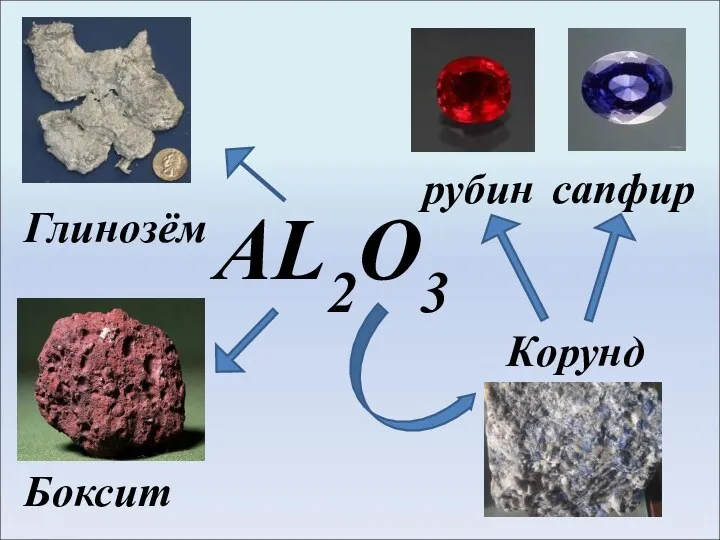
- 8. AL2O3 Глинозём Корунд сапфир рубин Боксит
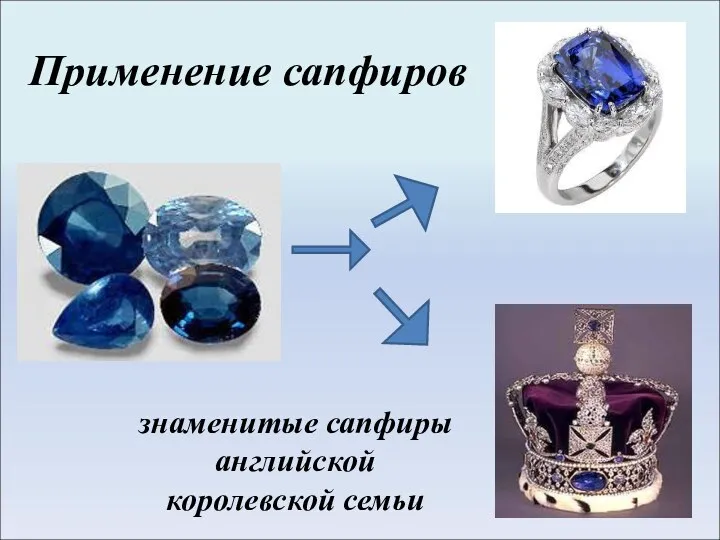
- 9. Применение сапфиров знаменитые сапфиры английской королевской семьи
- 10. Применение рубинов
- 11. Физические свойства вещества Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает
- 12. Особенности физических и химических свойств алюминия, его нахождения в природе и применения: Алюминий – самый распространенный
- 13. Химические свойства алюминия: Алюминий – активный металл Al - 3ē ↔ Al восстановитель +3 0
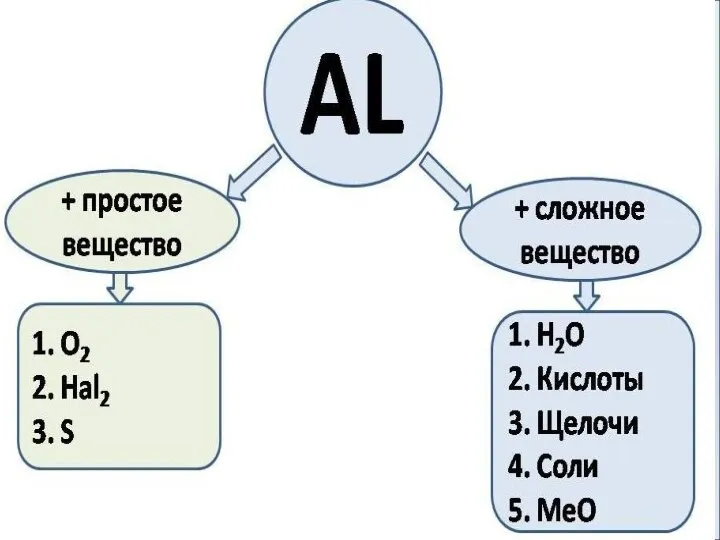
- 15. Алюминий реагирует с простыми веществами - неметаллами 4Al+3O2 = 2Al2O3 Поверхность покрывается пленкой оксида, в мелкораздробленном
- 16. Алюминий реагирует со сложными веществами: Алюминий растворяется в растворах кислот 2Al + 6HCl = 2AlCl3 +
- 17. Взаимодействие с кислотами Легко взаимодействует с разбавленными кислотами, образуя соли: 2Al + 6HCl = 2AlCl3 +
- 18. Алюминий реагирует со сложными веществами: 3. Алюминий при высокой температуре реагирует с оксидами менее активных металлов
- 19. Взаимодействие со щелочами Алюминий – амфотерный металл, он легко реагирует со щелочами: в растворе с образованием
- 20. Взаимодействие с водой Очищенный от оксидной пленки алюминий энергично взаимодействует с водой: 2Al + 6H2O =
- 21. Получение алюминия Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) и электролизом расплава AlCl3
- 22. Способы получения и применения Металлический алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na2AlF6 при
- 23. Применение алюминия
- 24. Применение Al
- 25. Потребительские качества алюминия. Для изготовление профилей, механической обработке, нанесение защитно-декоративных покрытий, сборке, монтаже и эксплуатации. Высокая
- 26. Соединения алюминия В природе алюминий встречается только в виде соединений и по распространенности в земной коре
- 27. Гель из гидроксида алюминия входит в состав лекарств для лечения болезней желудка. Гидроксид алюминия используется для
- 28. Оксид алюминия Al2О3: Очень твердый (корунд, рубин)в кристаллическом состоянии, порошок белого цвета, тугоплавкий - 20500С. Не
- 29. Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl
- 30. Проверь себя Ответь «Да» или «Нет» Алюминий – металл 3-ей группы. У алюминия 13 нейтронов. Степень
- 31. да нет да да да нет да да нет да
- 32. Домашнее задание: Параграф 13 (учить в тет.) №4, 6 , 7 2. Задачи №1,2 из Таблицы
- 34. Скачать презентацию

























 Термопластические полимеры
Термопластические полимеры Состав, свойства, виды и способы получения дегтей
Состав, свойства, виды и способы получения дегтей Углерод и кремний
Углерод и кремний Классы неорганических веществ. Лекция №4
Классы неорганических веществ. Лекция №4 Строительное материаловедение. (Лекции 1-2)
Строительное материаловедение. (Лекции 1-2) Рафинирование металлических расплавов
Рафинирование металлических расплавов Химическая взрывчатка
Химическая взрывчатка Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества Карбоновые кислоты. Строение
Карбоновые кислоты. Строение Инертные газы
Инертные газы Процессы и операции формообразования. Неметаллические материалы
Процессы и операции формообразования. Неметаллические материалы Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Классификация химических реакций
Классификация химических реакций Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Склад і властивості нафти
Склад і властивості нафти Crystal structure and surface phase composition of palladium oxides thin films for gas sensors
Crystal structure and surface phase composition of palladium oxides thin films for gas sensors Тұндыру әдістері
Тұндыру әдістері Геометрическая кристаллография
Геометрическая кристаллография Теория электролитической диссоциации
Теория электролитической диссоциации Химические свойства кислот
Химические свойства кислот Получение обогащенного изопарафинами компонента бензина на цеолитсодержащих катализаторах
Получение обогащенного изопарафинами компонента бензина на цеолитсодержащих катализаторах Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Органічні сполуки. Предмет органічної хімії
Органічні сполуки. Предмет органічної хімії Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Простые вещества неметаллы
Простые вещества неметаллы Кремний и его соединения
Кремний и его соединения Степень окисления
Степень окисления Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1